局限期小细胞肺癌放化疗后诱发治疗相关性急性髓系白血病一例报道
冀青青,刘峥,李海燕,孙风亭
小细胞肺癌(small cell lung carcinoma,SCLC)是肺癌中一种特殊的病理类型,占所有肺癌的15%~20%,临床上因其病情进展迅速、早期播散、对放化疗敏感等独特的生物学行为,30年前就将其与非小细胞肺癌(non-small cell lung cancer,NSCLC)相区分[1-2]。SCLC根据发现时的转移情况分为局限期SCLC和广泛期SCLC,其中局限期SCLC的定义为病灶局限于一侧胸腔,并且能够被一个放射野涵盖,包括对侧纵隔和同侧锁骨上淋巴结转移;广泛期SCLC的定义为病灶超出一侧胸腔,其中可能包括恶性胸膜浸润或心包浸润或血源性转移,包括对侧肺门和锁骨上淋巴结转移[3]。SCLC患者预后较差,其中局限期SCLC患者的中位生存期为15~20个月,5年生存率为10%~13%[1-2];广泛期SCLC患者的中位生存期为8~13个月,5年生存率为1%~2%[4]。
治疗相关性急性髓系白血病(therapy-related acute myeloid leukemia,t-AML)是白血病的一个分型亚组,指接受烷化剂和/或放疗以及拓扑异构酶Ⅱ抑制剂等治疗后发生的白血病[5]。t-AML在血液系统恶性肿瘤和乳腺癌患者中的发生率较高[6]。由于影响SCLC患者预后的因素主要为发病时的疾病分期,故相对于广泛期SCLC,局限期SCLC患者预后较好。对于局限期SCLC患者,其标准治疗方案为依托泊苷联合铂类方案(EP方案)化疗和胸部放疗(同步放化疗)以及全脑预防性放射治疗。笔者查阅相关文献发现,SCLC放化疗后诱发的t-AML的病例罕有报道。本文报道邯郸市中心医院收治的1例局限期SCLC放化疗后诱发的t-AML患者,以帮助临床医生及时鉴别诊断t-AML,从而改善患者的临床预后。
本文价值:
治疗相关性急性髓系白血病(therapy-related acute myeloid leukemia,t-AML)经常发生于血液系统恶性肿瘤和乳腺癌患者中,并且拓扑异构酶Ⅱ抑制剂引起的t-AML常发生于治疗2~3年后,当拓扑异构酶Ⅱ抑制剂总剂量为2 000 mg/m2或更多时,t-AML发病率将会上升。既往有关小细胞肺癌合并t-AML的报道,但缺乏局限期小细胞肺癌治疗后诱发t-AML的报道。因此,本文对邯郸市中心医院收治的局限期小细胞肺癌放化疗后诱发t-AML的患者进行报道,以期引起各位读者的关注,亦为局限期小细胞肺癌患者的治疗提供参考。
1 病例简介
患者,女,57岁,主因“咳嗽、咳痰伴胸闷、气促2个月”于2018-06-26就诊于邯郸市中心医院。高血压病史4年余,父亲因食管癌去世,家族中无血液系统恶性肿瘤病史。入院查体:全身浅表淋巴结未触及肿大,心腹未见异常,肝脾未触及。胸部增强CT示:右肺上叶肺癌伴远端炎性病变,右肺门及纵隔淋巴结转移。肺部病变穿刺活检病理报告示:(肺)小细胞恶性肿瘤,考虑为SCLC,免疫组化标记肿瘤细胞 CK5/6(-),P40(-),P63(-),CK7(-),TTF-1(+),CD56(+),Ki-67(+,约60%),Syn(+)。血常规示:白细胞计数9.80×109/L,血红蛋白117 g/L,血小板计数296×109/L,余各项指标均在参考范围内。于2018年6月—2019年3月共进行6次EP方案化疗及2次放疗,接受的药物总剂量为:依托泊苷2 400 mg,顺铂(cisplatin,DDP)600 mg;胸部放疗:放疗剂量60 Gy/30 F;全脑预防性放射治疗:放疗剂量25 Gy/10 F。放化疗后患者一般情况可。临床评估:部分缓解(partial remission,PR),见图1~2。2019-08-17患者诉乏力、食欲不振、发热,门诊复查血常规:白细胞计数2.67×109/L,血红蛋白106 g/L,血小板计数157×109/L。于2019-08-21入院进一步治疗。入院查体:体温38.7 ℃,贫血貌,皮肤巩膜无黄染,浅表淋巴结未触及肿大,胸骨无压痛,双肺呼吸音粗,肝脾肋下未触及。入院后查血常规:血红蛋白96 g/L,红细胞计数3.03×1012/L,平均红细胞体积(mean corpuscular volume,MCV)97.0 fl,平均红细胞血红蛋白量(mean corpuscular hemoglobin,MCH)31.7 pg,红细胞平均血红蛋白浓度(mean corpuscular hemoglobin concentration,MCHC)327 g/L,网织红细胞计数(reticulocyte count,Ret)0.019 1×1012/L,白细胞计数3.69×109/L,中性粒细胞绝对值0.80×109/L,血小板计数137×109/L。送检骨髓涂片,外周血白细胞分类计数示:分叶核粒细胞占18%,淋巴细胞占49%,单核细胞占31%;粒细胞比例减低,形态未见明显异常;成熟红细胞形态未见明显异常,计数100个白细胞未见有核红细胞;淋巴细胞比例增高,为成熟淋巴细胞,血小板单个、小堆分布,易见;单核细胞比例增高,偶见幼单核细胞。行骨髓穿刺示:骨髓增生活跃(-),粒系=13%,红系=9.5%,粒红比值=1.37/1;粒系比例减低,形态未见明显异常,红系比例减低,以晚幼红细胞为主,成熟红细胞形态无明显异常;淋巴细胞比例正常,为成熟淋巴细胞;全片共见巨核细胞10个,其中成熟有血小板形成巨核细胞1个,成熟无血小板形成巨核细胞9个,血小板单个、小堆分布,易见;原幼单核细胞比例增高,约占23%。骨髓活检示:HE染色及PAS染色示送检组织少量骨髓增生较低下(30%~40%),幼稚阶段细胞广泛增生,胞体中等,胞浆丰富,椭圆或不规则形,核染色质细致,部分可见核仁,少量偏成熟阶段粒红系细胞散在分布,未见巨核细胞,网状纤维染色(MF-1级),见图3(高清彩图见本文二维码)。免疫组化染色示:中性粒细胞碱性磷酸酶阳性率100%。染色体检查未见克隆性异常,见图4。考虑:急性髓系白血病,急性单核细胞白血病。现给予患者最佳支持治疗。
2 讨论
局限期SCLC最常用的初治方案是EP方案,而同步放化疗是局限期SCLC的标准治疗[2,7]。本例患者经胸部CT与肺部穿刺活检病理结果诊断为SCLC(局限期)。治疗前血常规未见异常,家族中无血液系统恶性肿瘤病史。同步放化疗结束后5个月出现白细胞计数下降,行骨髓活检考虑为急性髓系白血病。根据患者治疗经过,可以诊断为t-AML。

图1 放疗前胸部CT检查结果Figure 1 Chest CT examination results before radiotherapy
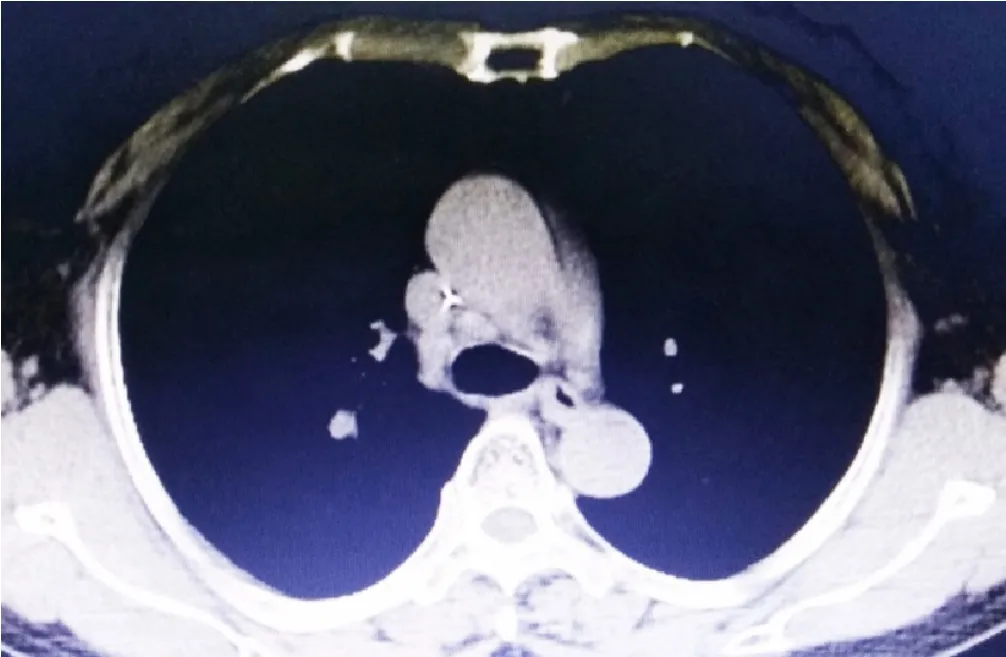
图2 放疗后胸部CT检查结果Figure 2 Chest CT examination results after radiotherapy

图3 骨髓活检结果(HE染色,PAS染色,×50)Figure 3 Bone marrow biopsy results
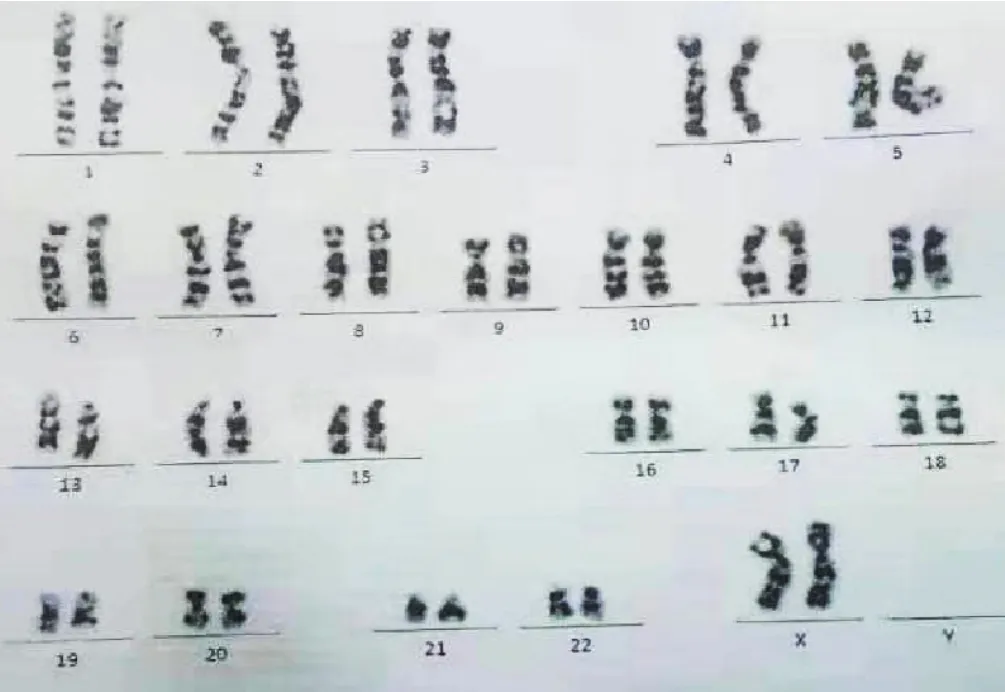
图4 染色体检查结果Figure 4 Chromosome examination results
t-AML有两个重要的特点:首先,t-AML通常发生在接受烷化剂或拓扑异构酶抑制剂治疗后,大多数患者是在使用烷化剂治疗至少5年后出现t-AML,其与5号或7号染色体频发异常有关;其他患者在暴露于拓扑异构酶Ⅱ抑制剂1~3年后出现t-AML,且常伴有11号或21号染色体易位[8-9]。值得注意的是,本例患者染色体检查未见异常,说明并非所有t-AML患者会发生染色体突变,且本例患者放化疗结束后5个月发生急性髓系白血病,说明t-AML的发生可能与放化疗时间、剂量、遗传因素及药物在体内代谢差异有关。依托泊苷为拓扑异构酶Ⅱ抑制剂,对肿瘤细胞有明显的细胞毒性作用,使细胞分裂停止在S晚期或G2早期,其作用机制主要是形成三联体阻断拓扑异构酶Ⅱ的连接活性,引起DNA链损伤,或抑制拓扑异构酶Ⅱ的催化作用而抑制DNA双链断裂后重新连接,从而引起细胞凋亡。且既往曾有报道拓扑异构酶Ⅱ抑制剂可导致t-AML[10]。DDP为铂的金属络合物,可作用于多个靶点,主要作用靶点为DNA,作用于链间及链内交链,形成DDP-DNA复合物,干扰DNA的复制,或与核蛋白及胞浆蛋白结合,属于非特异性周期药物。有研究显示,铂类与其他抗肿瘤药物联合治疗时可引发t-AML[11]。此外,常规剂量铂类所致的t-AML可能与遗传因素及药物在体内的代谢情况有关。其次,本例患者治疗原发肿瘤的同时也接受了放疗,推测恶性肿瘤放疗也是引发t-AML的可能原因,其发生率可能与放疗剂量有关。其机制可能是放疗引起造血干细胞DNA碱基脱落、转换、颠换产生移码突变或点突变,DNA链断裂,产生基因突变和染色体畸变,使白血病发生率增加,或放疗引起机体免疫功能紊乱,进而打破体内平衡,导致抑癌基因突变,从而增加细胞增殖能力[12]。目前尚缺乏对t-AML的前瞻性随机临床试验,因此尚没有证据表明t-AML的治疗方案优于标准的急性髓系白血病的治疗方案,即t-AML无特效治疗方案[13]。而对于既往接受过放化疗的老年患者,其机体骨髓造血储备能力已经下降,因此支持治疗成为最佳的治疗方法。
综上所述,t-AML可以在SCLC治疗结束后较短时间内发生,且患者预后不良。在临床工作中,骨髓抑制是抗癌治疗中常见的不良事件,及早区别骨髓抑制与t-AML具有重要意义。因此,当抗癌治疗过程中或治疗结束后遇到血细胞减少时,应仔细检查外周血涂片,必要时行骨髓活检,尤其是曾接受过拓扑异构酶抑制剂治疗的患者,以排除t-AML,进而帮助患者选择更为合适的治疗方案,并改善其预后。
作者贡献:冀青青进行文章的构思与设计、资料收集及整理,并撰写论文;刘峥对文章进行可行性分析并进行修订,对文章整体负责、监督管理;李海燕、孙风亭负责文章的质量控制及审校。
本文无利益冲突。

