姜黄素固体分散体处方工艺优化及体外溶出度评价
陆 颖,徐子寒
(南京中医药大学附属张家港医院药学部,江苏 苏州215600)
姜黄素(CUR)是从姜科植物(如姜黄、莪术、郁金)根茎中提取出的一种天然酚类物质,属于二酮类化合物[1-2],具有利胆、抗感染、抗病毒、抗氧化、抗凝血、调血脂、抗动脉粥样硬化等多种药理作用[3-8]。但CUR的水溶性极低(仅为0.96μg/mL)[9],且在胃肠道易发生葡萄糖醛酸转移酶(UGTs)诱导的Ⅱ相代谢[10-11],生物利用度极低,极大地限制了其开发应用。胡椒碱(PIP)是胡椒科植物胡椒和荜菝中的一种酚类活性物质[12-13],也属水难溶性药物,25℃下溶解度仅为22.34μg/mL[14-15]。此外,PIP为肝脏和肠内UGTs抑制剂,可有效抑制药物UGTs诱导的Ⅱ相代谢。PIP可抑制CUR的UGTs代谢,两者联用,具有协同作用,可降低对脂质的摄取,解决肥胖问题[16];有效降低大脑神经中炎性因子肿瘤坏死因子-α(TNF-α)及凋亡因子caspase-3水平,减少抑郁症状的发生,增强神经保护作用[17];治疗溃疡性结肠炎疗效显著[18];可抑制乳腺癌细胞的自我更新,且对正常细胞无毒副作用[19],起到防癌、抗癌作用;可减轻DNA损伤和神经毒性,增强免疫作用[20]。将难溶性药物制备成固体分散体(SD)是改善药物溶解度、溶出度及生物利用度的常用方法[21-22]。本研究中选择CUR与PIP的临床常用配比(3∶1,m/m)的药物组合物,利用溶解度参数,筛选出与CUR和PIP 2种药物相容性均良好的载体;通过溶剂法,制备姜黄素固体分散体(CUR SD);根据CUR与PIP 2种药物的溶出度,进一步优选出最佳载体及药物与载体的比例;通过差示扫描量热分析(DSC)法、X-射线粉末衍射分析(XRPD)法、傅立叶红外光谱(FTIR)法对制备的CUR SD进行表征,并测定CUR与PIP的溶解度与溶出度,以评价CUR与PIP溶解度与溶出度的改善情况。现报道如下。
1 仪器与试药
1.1 仪器
LC-2010A HT型高效液相色谱仪、IRTracer-100型红外光谱仪(日本Shimadzu公司);XP/XS型微量分析天平(瑞士Mettler Toledo公司,精度为十万分之一);Milli-Q型超纯水系统(美国Millipore公司);D8 Advance型X-射线粉末衍射仪(德国Bruker公司);Q2000型示差扫描量热仪(美国TA公司);HY68/RCY-1型智能溶出试验仪(北京中西远大科技有限公司);SNE-4500型扫描电镜(日本Hitachi公司);MXS1100型涡旋混合仪(美国赛洛捷克公司);KH500DE型超声清洗仪(昆山超声仪器有限公司,功率为250 W,频率为40 kHz)。
1.2 试药
姜黄素对照品(批号为110823-201405,纯度为98.9%)、胡椒碱对照品(批号为110775-201405,纯度为98.9%),均购自中国食品药品检定研究院;姜黄素原料药(批号为BD9137,纯度>98%,上海毕得医药科技有限公司);胡椒碱原料药(批号为91197C,纯度>98%,上海泰坦科技股份有限公司);聚乙烯吡咯烷酮K30(PVP K30)、聚乙烯吡咯烷酮BS630(PVP S630),均购自上海阿拉丁生化科技股份有限公司;羟丙基纤维素(HPC)、羟丙基甲基纤维素(HPMC),均购自上海贤鼎生物科技有限公司;盐酸(分析纯),乙腈、甲醇(色谱纯),均购自国药集团化药试剂有限公司;无水乙醇、氢氧化钠、吐温-80、磷酸二氢钾(分析纯,上海麦克林生化科技有限公司);水为超纯水。
2 方法与结果
2.1 CUR SD分析方法的建立
2.1.1 色谱条件
色谱柱:Kromasil C18柱(250 mm×4.6 mm,5μm);流动相:乙腈-0.5%磷酸溶液(60∶40,V/V);流速:1 mL/min;柱温:35℃;进样量:10μL;检测波长:342 nm(PIP),425 nm(CUR)。
2.1.2 线性关系考察
取CUR对照品5.205 mg、PIP对照品5.185 mg,精密称定,置25 mL容量瓶中,加甲醇定容,超声(功率为250 W,频率为40 kHz)使溶解,即得CUR对照品贮备液(质量浓度为208.2μg/mL)和PIP对照品贮备液(质量浓度为207.4μg/mL)。吸取适量上述溶液,分别逐级稀释0,2,4,8,16,32,64倍,按拟订色谱条件进样测定。分别以CUR与PIP对照品质量浓度(X,μg/mL)为横坐标、峰面积(Y)为纵坐标进行线性回归。结果,CUR的回归方程为YC=83 480 XC+82 499(R2=0.999 9),线性范围为3.25~208.20μg/mL;PIP的回归方程为YP=67 359 XP+62 547(R2=0.999 9),线性范围为3.24~207.40μg/mL。
2.2 CUR SD的载体优选
2.2.1 药物与载体相容性研究
只有药物与载体间的相容性良好,才能形成性质稳定的SD。选用基团贡献法,采用Molecular Modeling Pro分子模型预测软件,计算CUR和PIP及不同载体的Hansen溶解度参数(δ),分析CUR和PIP与载体间的相容性。当药物与载体溶解度参数差(Δδ<7 MPa1/2)时,药物和载体相容性良好;当Δδ>10 MPa1/2时,药物与载体相容性差[23-24]。分析结果见表1,根据溶解度参数计算结果,初步筛选的载体有PVP K30,PVP S630,HPC,HPMC。
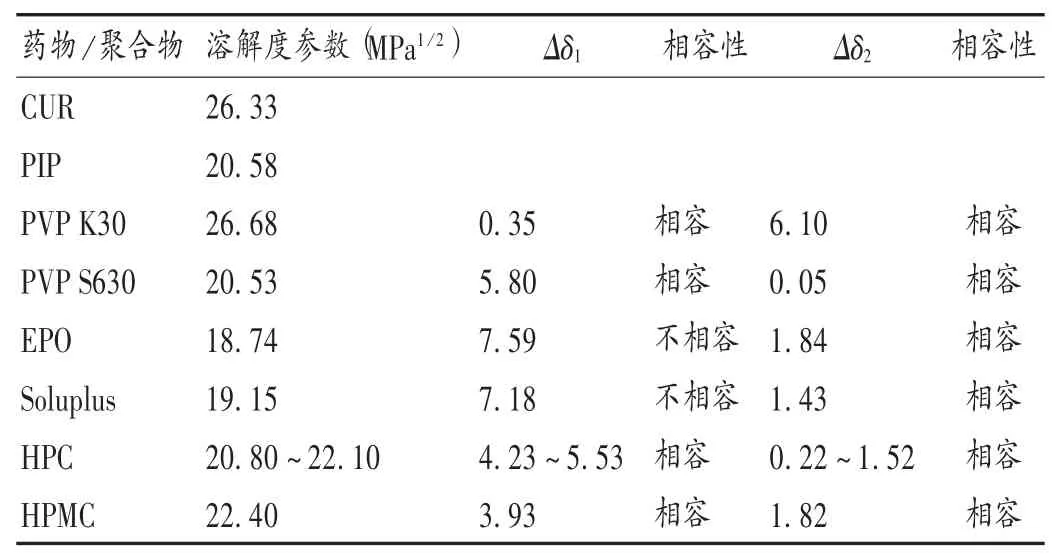
表1 姜黄素和胡椒碱及各高分子载体的溶解度参数Tab.1 Solubility parameters of CUR,PIP and other polymer carriers
2.2.2 载体筛选
根据2.2.1项下计算结果,取上述4种载体,采用溶剂法制备CUR-PIP聚合物三元固体分散体(CURPIP-PVP K30 SD,CUR-PIP-PVP S630 SD,CURPIP-HPC SD,CUR-PIP-HPMC SD)。按药物[CURPIP(3∶1,m/m)]与载体(PVP K30,PVP S630,HPC,HPMC)质量比为1∶3,加入无水乙醇,使CUR和PIP及载体溶解。通过旋转蒸发除去溶剂(45℃),真空干燥过夜,研成细粉,过60目筛,制备得不同载体的CUR SD。以不同SD中CUR和PIP的累积溶出率为考察指标,进一步优选载体。为模拟人体胃肠道生理环境,选择4种不同溶出介质[0.5%吐温-80的盐酸溶液(pH 1.2),含0.5%吐温-80的醋酸盐缓冲液(pH 4.5),含0.5%吐温-80的磷酸盐缓冲液(pH 6.8)和含0.5%吐温-80的水]考察CUR SD的溶出行为,介质体积为900 mL,温度为37℃,转速为50 r/min,平行操作3份,分别于5,10,15,20,30,45,60 min时取样5 mL(随即补足等温度等量的溶出介质),经0.45μm微孔滤膜滤过。按拟订色谱条件测定,计算各时间点CUR和PIP的累积溶出率,结果见图1和图2。可见,在4种不同溶出介质中,以PVP K30为载体制备的SD中CUR及PIP都在5 min时就已基本全部溶出,溶出速率明显优于用其他3种载体(PVP S630,HPC,HPMC)制备的CUR SD,故选择PVP K30为载体制备CUR SD。
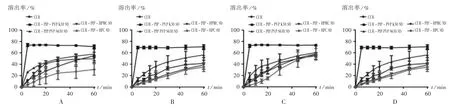
图1 姜黄素与不同载体在不同溶出介质中的溶出曲线(n=3)A.Hydrochloric acid solution(pH 1.2)B.Acetate buffer solution(pH 4.5)C.Phosphate buffer solution(pH 6.8)D.Aqueous solutionFig.1 Dissolution profile of curcumin with different polymer carriers in different dissolution medium(n=3)
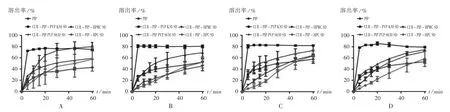
图2 胡椒碱与不同载体在不同溶出介质中的溶出曲线(n=3)A.Hydrochloric acid solution(pH 1.2)B.Acetate buffer solution(pH 4.5)C.Phosphate buffer solution(pH 6.8)D.Aqueous solutionFig.2 Dissolution profile of piperine with different polymer carriers in different dissolution medium(n=3)
2.3 药物与载体比例的筛选
以PVP K30为载体,采用溶剂法制备SD。选择药物[CUR-PIP(3∶1,m/m)]与载体质量比1.5∶1,1∶1.5,1∶3比例,加入无水乙醇使CUR,PIP,PVP K30溶解。旋转蒸发除去溶剂(45℃),真空干燥过夜,研成细粉,过60目筛,得到3种比例的CUR SD(1∶3,1∶1.5,1.5∶1,m/m)。考察不同比例CUR SD在上述4种溶出介质中的累积溶出率,介质体积为900 mL,温度为37℃,转速为50 r/min,平行操作3份,分别于5,10,15,20,30,45,60 min时取样5 mL(随即补足等温度等量的溶出介质),经0.45μm微孔滤膜滤过。结果见图3和图4。可见,不同比例的SD中CUR及PIP的溶出速率均比原料药快,而PVP K30比例越大,溶出速率越快。因在不同溶出介质中的药物溶出行为相似,故选择含0.5%吐温-80 pH 1.2盐酸溶液中的溶出结果进行分析。5 min时,不同比例的CUR SD中CUR的溶出速率分别为CUR原料药的6.51,4.24,2.78倍,PIP的溶出速率分别为PIP原料药的4.33,3.73,3.05倍。与CUR和PIP原料药相比,不同比例的CUR SD均有较好的溶出度,溶出速率为CUR SD(1∶3,m/m)>CUR SD(1∶1.5,m/m)>CUR SD(1.5∶1,m/m),故选择CUR SD(1∶3,m/m)和CUR SD(1∶1.5,m/m)进行下一步研究。
2.4 CUR SD的表征
2.4.1 差式扫描量热分析(DSC)法
取样品4~8 mg,置铝坩埚中。测试条件:氮气流速为50 mL/min;升温速 率为10℃/min;升温范围为25~200℃。分别对CUR原料药、PIP原料药、PVP K30、2种比例的药物(1∶3,1∶1.5,m/m)与PVP K30物理混合物及2种比例CUR SD(1∶3,1∶1.5,m/m)进行热力学分析,结果见图5。可见,CUR与PIP原料药分别在183.1℃与129.9℃处吸热峰尖锐,该峰为CUR与PIP的熔点特征峰,表明CUR与PIP原料药以晶体形式存在。PVP K30无尖锐吸热峰,表明其以无定型形式存在;2种比例的物理混合物尽管在CUR与PIP对应的熔点处无晶体特征吸收峰,但物理混合物(1∶3,m/m)和物理混合物(1∶1.5,m/m)分别在118.0℃和120℃附近各有1个吸热峰,推测在2种比例的物理混合物中,CUR与PIP发生了低共熔;而CUR SD(1∶3,m/m)和CUR SD(1∶1.5,m/m)中CUR及PIP的熔点特征峰均消失,证实CUR与PIP以无定型形式分散在PVP K30中。
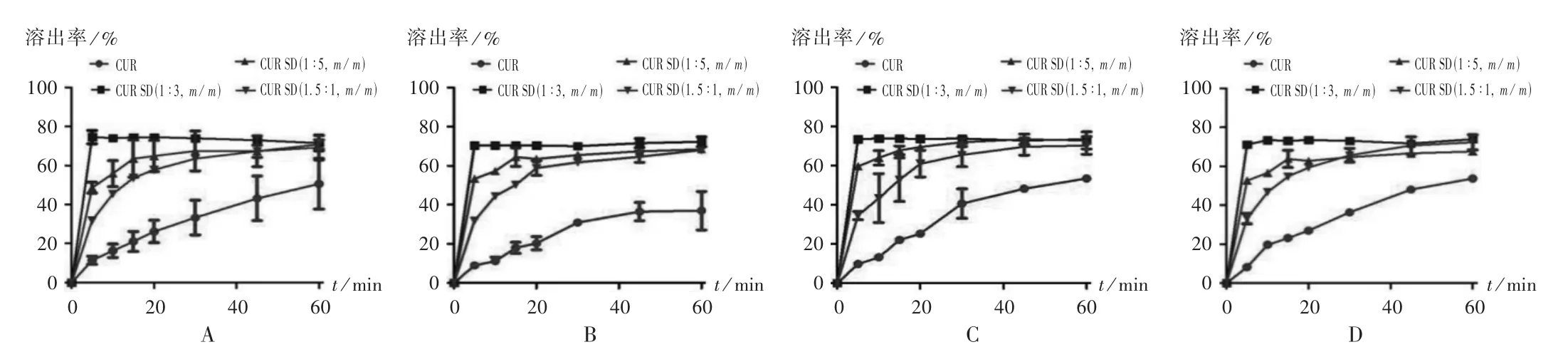
图3 不同比例姜黄素固体分散体中姜黄素在不同溶出介质中的溶出曲线(n=3)A.Hydrochloric acid solution(pH 1.2)B.Acetate buffer solution(pH 4.5)C.Phosphate buffer solution(pH 6.8)D.Aqueous solutionFig.3 Dissolution profile of curcumin in CUR SD with different proportion in different dissolution medium(n=3)
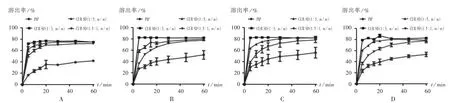
图4 不同比例姜黄素固体分散体中胡椒碱在不同溶出介质中的溶出曲线(n=3)A.Hydrochloric acid solution(pH 1.2)B.Acetate buffer solution(pH 4.5)C.Phosphate buffer solution(pH 6.8)D.Aqueous solutionFig.4 Dissolution profile of piperine in CUR SD with different proportion in different dissolution medium(n=3)
2.4.2 X-射线粉末衍射分析(XRPD)法
测定条件:Cu靶为40 kV,40 mA;步长为0.02°;扫描速度为2°/min;扫描范围为3°~40°(2θ)。分别对CUR原料药、PIP原料药、PVP K30、2种比例的药物(1∶3,1∶1.5,m/m)与PVP K30物理混合物及2种比例CUR SD(1∶3,1∶1.5,m/m)进行分析,结果见图6。可见,CUR原料药在7.8°,8.7°,14.4°,15.8°,17.2°,21.0°,23.2°,23.6°,24.6°,25.5°,26.6°,28.1°处有较强的晶体衍射峰;PIP原料药在12°~30°有多个较强晶体衍射峰,表明CUR和PIP原料药以晶体形式存在;PVP K30在3°~40°间无特征衍射峰,表明PVP K30为无定型载体;药物与PVP K30的物理混合物中,尽管衍射峰强度减弱,但仍存在多个CUR及PIP原料药的衍射峰,表明简单混合不会改变药物晶型状态;CUR SD(1∶3,m/m)和CUR SD(1∶1.5,m/m)中,CUR和PIP的晶体衍射峰消失,表明CUR与PIP以无定型状态分散在PVP K30中,与DSC法结果相符,成功制备成无定型CUR SD。
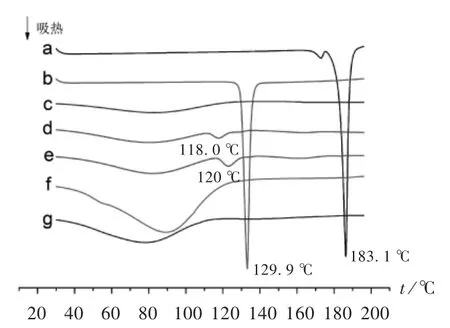
图5 差示扫描量热分析图a.CUR API b.PIP API c.PVP K30 d.Physical mixture(1∶3,m/m)e.Physical mixture(1∶1.5,m/m)f.CUR SD(1∶3,m/m)g.CUR SD(1∶1.5,m/m)Fig.5 DSC analysis diagram
2.4.3 傅立叶红外光谱分析(FTIR)法
分别取CUR原料药、PIP原料药、PVP K30、2种比例的药物(1∶3,1∶1.5,m/m)与PVP K30物理混合物及2种比例CUR SD(1∶3,1∶1.5,m/m)适量,置红外光谱仪中分析,波长范围为400~4 000 cm-1,结果见图7。可知,CUR原料药的主要特征吸收峰有:3 502 cm-1处为—OH伸缩振动,1628cm-1处为C=O伸缩振动[25];PIP原料药在1 710 cm-1处附近有C=O特征峰[26];PVP K30在3 453 cm-1处有O—H伸缩振动峰,在1 662 cm-1处有C=O伸缩振动峰;2种物理混合物中,药物及载体的特征峰仍存在,表明2种药物与PVP K30未发生相互作用;CUR SD中CUR的—OH特征峰变宽,C=O振动峰消失,PIP在1 710 cm-1处的C=O特征峰减弱,可能是由于药物与PVP K30间发生了分子间氢键的相互作用,氢键能通过抑制相转变和重结晶来提高SD的稳定性,稳定SD中药物的存在状态[27]。
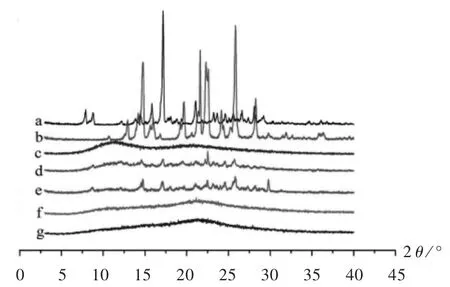
图6 X-射线粉末衍射分析图a.CUR API b.PIP API c.PVP K30 d.Physical mixture(1∶3,m/m)e.Physical mixture(1∶1.5,m/m)f.CUR SD(1∶3,m/m)g.CUR SD(1∶1.5,m/m)Fig.6 XRPD analysis diagram
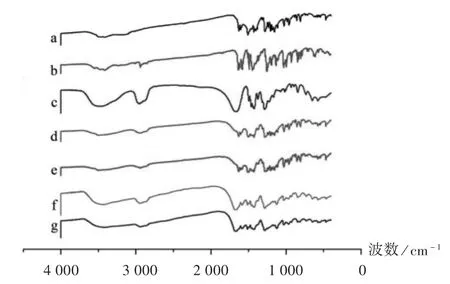
图7 傅立叶红外光谱分析图a.CUR API b.PIP API c.PVP K30 d.Physical mixture(1∶3,m/m)e.Physical mixture(1∶1.5,m/m)f.CUR SD(1∶3,m/m)g.CUR SD(1∶1.5,m/m)Fig.7 FTIR analysis diagram
2.4.4 扫描电镜(SEM)分析
采用SNE-4500型扫描电镜观察CUR原料药、PIP原料药及2种比例CUR SD(1∶3,1∶1.5,m/m)的表面形貌。样品均匀撒于贴有导电胶带的样品座上,喷金5 min,用干净镊子取出,置SEM仪器内,采用3 kV的加速电压扫描其表面,并进行拍照,结果见图8。可见,CUR原料药具有明显的晶形特征,呈规则的柱状结构;PIP原料药多呈大小不一的椭球状;而2种比例CUR SD(1∶3,1∶1.5,m/m)呈不规则块状、颗粒状,CUR的柱状特征和PIP的椭球形特征已完全消失。

图8 扫描电镜图A.CUR API B.PIP API C.CUR SD(1∶3,m/m)D.CUR SD(1∶1.5,m/m)Fig.8 SEM photographs
2.5 溶解度测定
分别加入含0.5%吐温-80的盐酸溶液(pH 1.2)、含0.5%吐温-80的醋酸盐缓冲液(pH 4.5)、含0.5%吐温-80的磷酸盐缓冲液(pH 6.8)和含0.5%吐温-80的水等4种溶出介质置15 mL离心管中,分别称取过量的CUR与PIP原料药、2种比例原料药(1∶3,1∶1.5,m/m)与PVP K30物理混合物、2种比例CUR SD(1∶3,1∶1.5,m/m),置空气摇床中,37℃下振摇24 h,取出,平衡,取上清液2 mL,经0.45μm微孔滤膜滤过,按拟订色谱条件测定,结果见表2。在不同溶出介质中,CUR和PIP原料药的溶解度差异不大,2种比例PM中CUR和PIP的溶解度均大于原料药,表明PVP K30可能具有一定的助溶效果;与CUR和PIP原料药相比,2个CUR SD中的CUR和PIP的溶解度显著提高(P<0.01)。如在pH 1.2缓冲液中,与原料药相比,物理混合物(1∶3,m/m)和物理混合物(1∶1.5,m/m)中CUR的溶解度提高至1.71倍和1.96倍,PIP溶解度提高至1.24倍和1.32倍,可能是PVP K30为亲水性载体,使得药物润湿性增强,增加了药物的溶解度;CUR SD(1∶3,1∶1.5,m/m)中,CUR的 溶解度提高至4.18倍和3.92倍(P<0.01),PIP溶解度也提高至2.13倍和1.94倍(P<0.01),表明将PVP K30与CUR和PIP组合物共同制备成无定型CUR SD,可显著提高CUR和PIP的溶解度。
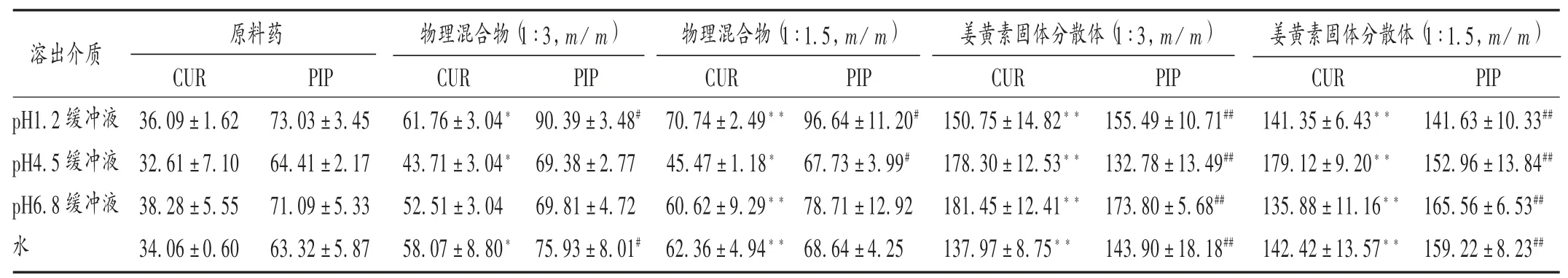
表2 不同样品中姜黄素和胡椒碱的溶解度(μg/mL,n=3)Tab.2 Solubility of curcumin and piperine in different samples(μg/mL,n=3)
2.6 体外溶出试验
为了考察不同样品的累积溶出率,精密称取CUR原料药、PIP原料药、2种比例物理混合物及CUR SD(1∶3,1∶1.5,m/m),按2015年版《中国药典(四部)》通则0931溶出度与释放度测定法进行体外溶出试验,以含0.5 %吐温-80的盐酸溶液(pH 1.2)为溶出介质,转速为50 r/min,溶出介质体积为900 mL,温度为37℃,分别于5,10,15,20,30,45,60 min时取样5 mL,并随即补足等温度等量的溶出介质,经0.45μm微孔滤膜滤过,按拟订色谱条件测定,分别记录峰面积,计算出各时间点CUR和PIP的累积溶出率。结果见图9。与CUR和PIP原料药及2种比例物理混合物相比,CUR SD中CUR和PIP的累积溶出率和溶出速率均显著提高。5 min时,CUR SD(1∶3,m/m)中CUR与PIP的累积溶出率分别达78.21%与73.32%,CURSD(1∶1.5,m/m)中CUR与PIP的溶出率分别为65.58%和54.03%;物理混合物(1∶3,m/m)中CUR与PIP的溶出率为10.31%和14.65%,物理混合物(1∶1.5,m/m)中CUR与PIP的溶出率分别为5.42%和13.95%;CUR原料药及PIP原料药累积溶出率仅为2.75%和17.64%。表明制备为CUR SD后,CUR及PIP的累积溶出率和溶出速率均显著提高,CUR SD(1∶3,m/m)累积溶出率和溶出速率优于CUR SD(1∶1.5,m/m)。
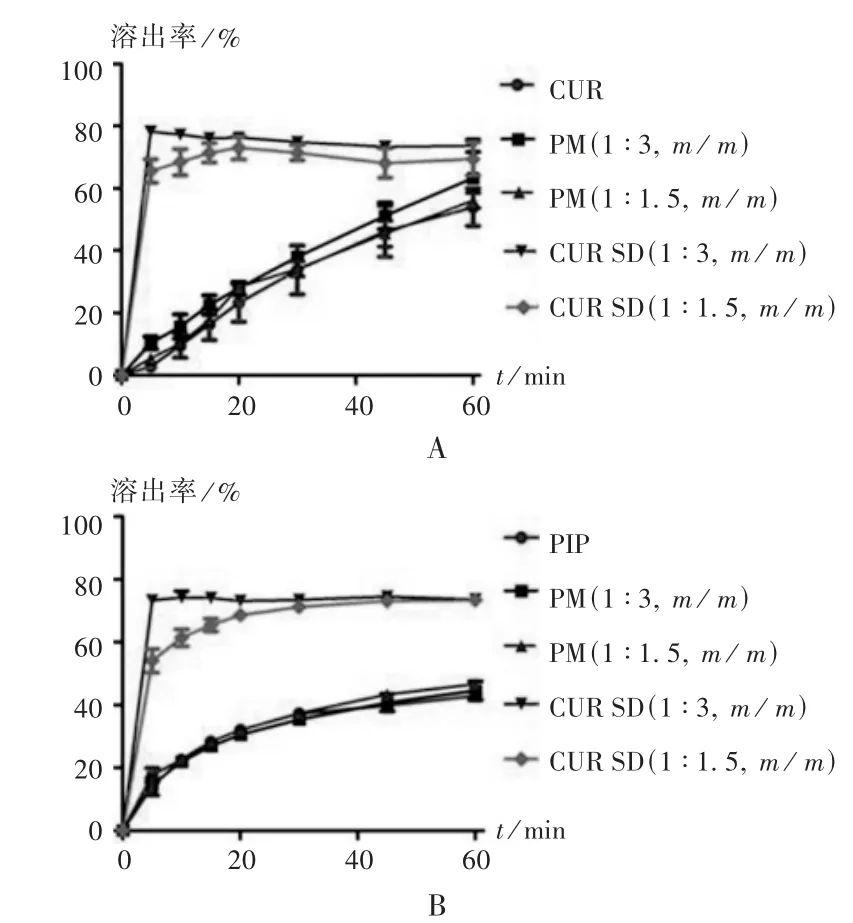
图9 溶出曲线图(n=3)A.Curcumin B.PiperineFig.9 Dissolution profile(n=3)
3 讨论
CUR的水溶性极低,属生物药剂学分类(BCS)Ⅳ类药物,在胃肠道发生UGTs的Ⅱ相代谢,极大限制了CUR的生物利用度。但CUR具有多种药理活性,临床应用潜力较大,亟需改善生物利用度。PIP难溶于水,生物利用度也较差,但已被证实作为药物生物利用度增强剂广泛使用,可抑制参与药物代谢的酶,减缓药物体内的代谢;诱导胃肠道膜动力学改变,促进药物快速吸收。本研究中将CUR和PIP配伍使用,通过固体分散技术,改善2种药物的溶解度及溶出速率,同时抑制CUR的体内代谢,达到改善2种药物在体内吸收的目的。此外,CUR与PIP联用,可发挥协同治疗的优势,改善药物临床应用的缺陷。
本研究中首先根据CUR和PIP与不同聚合物载体的溶解度参数进行模拟分析,选择与CUR和PIP相容性均较好的载体,通过溶剂法制备CUR SD,以溶出率为指标,最终确定PVP K30为制备CUR SD的最佳载体。进一步筛选药物与载体比例时发现,3种不同比例的聚合物固体分散体溶出速率较原料药均有增加,其中2种比例CUR SD(1∶3,1∶1.5,m/m)的溶出速率较快,而CUR SD(1.5∶1,m/m)的溶出速率相对较差。结合溶解度测定结果,选择CUR SD(1∶3,m/m)和CUR SD(1∶1.5,m/m)进行下一步研究。
通过DSC和XRPD对制备的CUR SD进行表征分析,证实成功制备了CUR三元无定型SD。FTIR结果表明,药物与PVP K30间可能发生分子间氢键相互作用,使CUR和PIP分散于PVP K30的网状结构中,阻滞药物重新聚集,发生重结晶[26-27]。2种比例CUR SD(1∶3,1∶1.5,m/m)在不同pH的缓冲液中饱和溶解度显著增大,体外溶出速率也有明显提高,其中CUR SD(1∶3,m/m)累积溶出度和溶出速率优于CUR SD(1∶1.5,m/m)。
综上所述,将CUR和PIP组合物与PVP K30联合制备成的CUR SD可有效改善CUR及PIP的溶出率和溶出速率,有助于提高2种难溶性药物的生物利用度,扩展其临床应用。本研究中针对CUR的理化性质及应用缺陷,有针对性地选择PIP配伍使用,共同制备成三元无定型SD,为解决其他难溶性药物的溶解度、生物利用度及联合应用的问题提供了新的思路。

