茶氨酸防治肿瘤研究进展
李超玲,雷明盛
恶性肿瘤在全世界范围内是需要去攻克的难题之一,对于肿瘤治疗,目前以手术结合放化疗、靶向治疗及免疫治疗等为主,虽取得了一定的效果,但仍需寻求高效预防和缓解,乃至最终治愈恶性肿瘤的方法,目前国内外有多项研究表明茶氨酸及其合成的衍生物可诱导肿瘤细胞凋亡并抑制其生长和侵袭转移,从而防治肿瘤(如肺癌、乳腺癌、肝癌及宫颈癌等)。研究表明茶氨酸还可增强某些抗癌药物的活性并在缓解抗肿瘤药物不良反应上也有一定的效果,在癌症化学疗法的发展中起到重要作用。
1 吸收与代谢
茶氨酸是谷氨酸盐的衍生物,具有两种手性异构体,即D-茶氨酸和L-茶氨酸,但一般以L型存在于自然界中,且L型在体内的生物活性很高。研究表明,茶氨酸主要通过肠道内Na+介导的耦合转运蛋白吸收,并且主要是以L-茶氨酸吸收为主,而D-茶氨酸则无法在肠道内被吸收和代谢从而直接被肾脏排泄。L-茶氨酸被吸收后会迅速进入血及各组织脏器。茶氨酸的主要代谢部位在肾脏,茶氨酸在肾脏中一部分被分解为乙胺和谷氨酸,未分解部分则随尿液排出体外。
2 诱导肿瘤细胞凋亡
肿瘤细胞由于失去正常的细胞周期可导致其持续增殖分化和细胞凋亡的异常及缺失。肿瘤细胞凋亡抑制在肿瘤的发生发展过程中尤为重要。细胞凋亡过程由多因素诱导、多基因严格控制,目前最熟知的主要有2种凋亡途径:(1)由Fas-Fasl介导的细胞凋亡的膜受体通路即死亡受体凋亡途径;(2)由细胞色素C(Cyt-C)介导的线粒体凋亡途径。这两条途径均可激活Caspase家族蛋白产生级联反应介导细胞凋亡,其中线粒体是细胞凋亡的中心,也是最关键的凋亡途径,两条凋亡途径相互作用,相互影响[1]。
研究报道,茶氨酸可通过线粒体途径诱导肿瘤细胞凋亡,其机制可能是通过降低Bcl-2/Bax比例并上调Cyt-C,caspase-3凋亡信号蛋白表达水平,从而诱导肿瘤细胞凋亡并抑制肿瘤细胞生长[2-3]。Bcl-2蛋白家族参与细胞凋亡调控,主要分为促凋亡蛋白Bax和抗凋亡蛋白Bcl-2,Bcl-2/Bax比例是否平衡决定了细胞是否发生凋亡及凋亡的程度,即当Bax表达增多时可拮抗Bcl-2的作用从而诱导细胞凋亡,反之当Bcl-2表达增加时可减少细胞凋亡[4-5]。Cyclin D1是细胞周期中重要的调控因子,当Cyclin D1表达水平升高时,会使细胞出现失控性生长,并使细胞癌性转化率增高,而茶氨酸可通过上调P53蛋白的表达水平,并下调Cyclin D1表达水平,进而诱导肿瘤细胞凋亡及诱导肿瘤细胞周期阻滞,抑制其失控性生长[6-7]。P53蛋白也是机体内一种重要的凋亡诱导蛋白,可通过上调Bax及下调Bcl-2表达水平促进细胞凋亡,还可参与细胞周期调节、抑制肿瘤血管生成等的调控。研究表明,茶氨酸还可通过下调NF-κB表达水平,或抑制Akt磷酸化从而减少NF-κB的异常活化,从而达到抑制肿瘤细胞的生长并促进肿瘤细胞的凋亡的作用[8]。NF-κB是一种转录因子,具有重要的转录激活作用,主要参与机体的凋亡与抗凋亡、细胞增殖分化及炎性反应与免疫反应等生理过程,当NF-κB被激活后可促进肿瘤细胞的生长并抵抗细胞的凋亡[9]。
3 抑制肿瘤细胞侵袭和转移
侵袭和转移是恶性肿瘤最重要的生物学特性,也是影响预后和导致死亡的主要原因之一,恶性肿瘤的侵袭和转移是由多基因调控、多步骤、多因素相互作用的序贯复杂的过程[10]。肿瘤新生血管的生成在肿瘤侵袭转移过程中起着至关重要的作用。肿瘤血管生成是由血管生成刺激因子和抑制因子共同作用的结果,在这个过程中肿瘤细胞会分泌促血管生成因子进入肿瘤微环境诱导血管生成,同时内皮细胞也会旁分泌某些血管生长因子刺激肿瘤细胞的生长。在促进肿瘤新生血管生成过程中最关键的是血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)和血管内皮细胞生长因子受体(vascular endothelial growth factors receptors,VEGFRs)介导的信号通路,前者以VEGF-A在调控血管生成过程中最关键,可高效特异作用于血管内皮细胞,增强血管通透性,并促进肿瘤新生血管生成,而后者主要以VEGFR2介导的血管内皮细胞增殖分化、迁移,在血管生成、肿瘤的发生发展等过程中起促进作用[11]。因此当VEGF与VEGFR结合后,可引起受体自身磷酸化,并激活有丝分裂原活化蛋白激酶(MAPK),从而诱导内皮细胞增生。研究表明,茶氨酸可通过抑制内皮细胞增殖及内皮细胞管腔形成,并诱导内皮细胞调亡抑制肿瘤血管生成,从而进一步抑制肿瘤细胞的生长及侵袭转移[12]。研究报道,茶氨酸可通过下调EGFR、VEGFR1和VEGFR2表达水平,从而阻断VEGF-VEGFR1/VEGFR2、EGF-EGFR信号转导通路,并抑制EGFR及VEGFR的磷酸化从而减少肿瘤血管生成,从而抑制肿瘤的生长及侵袭转移[8,13]。
4 调节肿瘤免疫
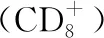
5 增强抗癌药物的活性
茶氨酸对某些抗肿瘤药物具有生物调节作用,不仅可增强抗肿瘤药物的疗效,还在缓解抗肿瘤药物不良反应上也有一定的效果,这在癌症化学疗法的发展中起到重要作用。茶氨酸是谷氨酸盐的衍生物,而在肿瘤细胞中谷氨酸盐的代谢异常活跃,因此茶氨酸的这种生物调节作用可能是与茶氨酸能够抑制谷氨酸转运蛋白,使肿瘤细胞内谷氨酸浓度水平降低及导致细胞内谷胱甘肽(GSH)和GS-X结合物水平下降,从而可以减少抗肿瘤药物的外排,以及减少药物诱导的氧化损伤相关的不良反应相关[24-25]。Tsuchiya等[26]通过接受S-1辅助化疗的患者在服用S-1前7 d开始口服胱氨酸700 mg和茶氨酸280 mg,并持续5周,发现S-1辅助化疗实验组的不良反应如腹泻明显少于对照组,且S-1辅助化疗的持续时间和完成率与对照组相比均显著更长。Sadzuka等[27]研究发现,将茶氨酸分别与顺铂和伊立替康(CPT-11)联合应用发现,联合应用后不仅可减少肿瘤体积,还可显著增加顺铂在肿瘤中的浓度,增强了顺铂或CPT-11的抗肿瘤活性。胡安拉等[28]将茶氨酸与阿霉素(doxorubicin,DOX)联合应用发现茶氨酸不仅可直接抑制胃腺癌细胞MGC803的生长增殖并且,还能促进其凋亡,同时还观察导茶氨酸还可使在肿瘤细胞内DOX滞留,进而提高了肿瘤细胞对DOX的化疗敏感性。接受卡培他滨的辅助化疗通常会引起不良事件(AE),例如腹泻、口腔炎、厌食症和手足综合征(HFS)等,Hamaguchi等[29]发现通过将茶氨酸与胱氨酸联合用于接受卡培他滨的辅助化疗的患者后发现,用胱氨酸/茶氨酸治疗组可降低腹泻、HFS不良反应发生率。
6 展 望
国内外多项实验研究表明,茶氨酸作为一种独特的生物活性调节剂,不仅可以介导肿瘤细胞的凋亡、减少肿瘤新生血管生成等多方面抑制肿瘤的生长和侵袭转移,还可能具有调节及增强肿瘤患者的免疫力的功效,此外,茶氨酸还可竞争性抑制肿瘤细胞对谷氨酸盐的吸收,增强抗肿瘤药物的活性。因此茶氨酸的多种药用价值在防治肿瘤方面具有广阔的应用前景,值得我们继续进一步的探讨和研究。

