肺上皮样血管内皮瘤并发慢性阻塞性肺疾病1 例报告及文献复习
黄 静, 丁 明, 朱晓莉, 陈平圣, 韩淑华
(1. 东南大学附属中大医院呼吸与危重症医学科 东南大学医学院,江苏 南京 210009;2. 东南大学医学院病理与病理生理学系,江苏 南京 210009)
上 皮 样 血 管 内 皮 瘤 (epithelioid hemangioendothelioma,EHE)是一种极其罕见的肉瘤,由于缺少特征性的临床表现和影像学特点而容易被误诊,目前对于该病的研究报道仅限于病例报告,包括少数回顾性描述性病例。EHE 患者常并发其他疾病,尤其并发一些慢性病和常见病,往往会掩盖病情,延误诊治。东南大学附属中大医院呼吸与危重症医学科收治了1 例肺上皮样血管内皮瘤(pulmonary epithelioid hemangioendothelioma,PEHE) 患者,该患者因并发慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD),掩盖了疾病的进展过程,现总结其临床表现、影像学和病理学特征及诊治过程,结合文献复习报道如下。
1 临床资料
1.1 一般资料患者,男性,74 岁,因反复胸闷、气喘半年,加重半月,于2019 年10 月29 日入住东南大学附属中大医院心血管科。患者半年前出现胸闷和气喘,活动后或情绪激动时症状加重,伴轻度胸痛,咳嗽或深呼吸后加重,休息后症状可稍缓解,未重视及诊治。半月前,患者症状加重,伴咳嗽,咳少量白痰,无发热。病程中,患者精神状态一般,食欲稍下降,大小便正常,近2 个月体质量下降约2 kg。既往史:血压升高1 月余,收缩压最高159 mmHg,舒张压最高95 mmHg,未服药治疗;有“腔隙性脑梗死”病史;15 年前及7 年前曾有“肺结核”病史,未规范治疗。吸烟20 余年,平均每天20 支,已戒20 年,偶有饮酒。体格检查:患者体温36.0 ℃,脉搏71 min-1,呼吸18 min-1,血压115/69 mmHg,神志清,全身浅表淋巴结未触及肿大,口唇无紫绀,颈软,气管居中,桶状胸。叩诊两肺过清音,两肺呼吸音减低,未闻及干湿性啰音。心脏相对浊音界无增大,心率71 min-1,心律齐,各瓣膜区未闻及病理性杂音。腹平软,无压痛及反跳痛,肝脾肋下未及,肠鸣音正常。双下肢无水肿。
1.2 检测指标血常规、脑钠肽、肾功能、电解质和肌钙蛋白Ⅰ未见明显异常。超敏C 反应蛋白6.36 mg·L-1,促甲状腺激素5.94 mIU·L-1。肝功能:总蛋白59.3 g·L-1,白蛋白35.1 g·L-1。病毒八项:乙肝核心抗体(+),梅毒螺旋体特异抗体(+),梅毒快速血浆反应素(RPR)阴性,梅毒螺旋体抗体(TPPA)(+)。纤溶功能:纤维蛋白原5.42 g·L-1。 肺 功 能: 第1 秒 用 力 呼 气 容 积(forced expiratory volume in 1 second,FEV1) 占预计值58%,FEV1/用力肺活量(forced vital capacity,FVC)56.9%,提示中重度混合性通气功能障碍,弥散功能中度下降。
1.3 影像学检查胸部CT 平扫(图1):两肺多发大小不等结节,上叶钙化结节及条索灶;两肺有间质性改变和慢性支气管炎及肺气肿改变,伴肺大泡形成;纵隔及两肺门多发钙化淋巴结;动脉粥样硬化;双侧胸膜局限性增厚。头胸腹盆CT 增强示:两肺多发大小不等结节,疑似右下叶肺癌伴肺内多发转移或其他肿瘤肺转移;两肺上叶钙化结节及条索灶,间质性改变,慢性支气管炎和肺气肿改变,伴肺大泡形成;纵隔及两肺门多发钙化淋巴结;动脉粥样硬化;双侧胸膜局限性增厚;右膈角处脂肪密度影,考虑膈疝;肝脏右后叶包膜下液性病灶伴钙化;肝内钙化灶;脾脏钙化灶;右肾多发囊肿;前列腺增大;脑内散在缺血腔梗灶;脑萎缩。
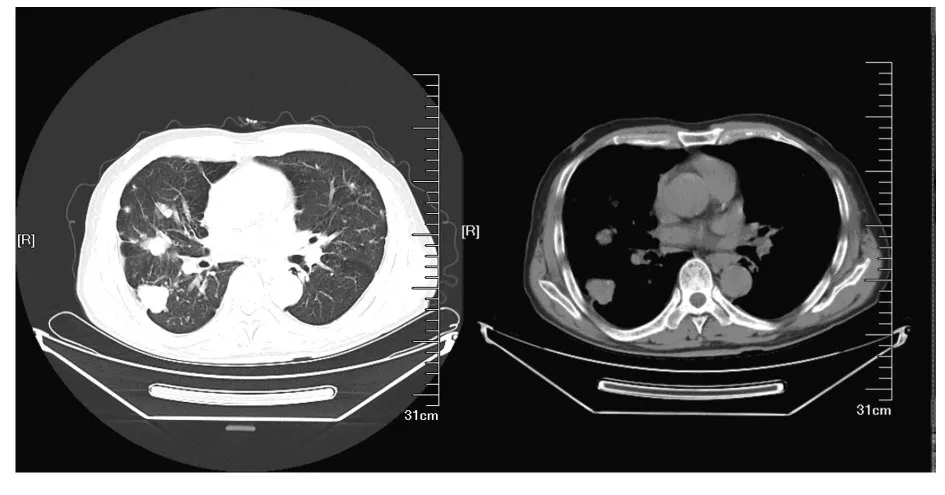
图1 PEHE 并发COPD 患者首次入院时胸部CT 影像表现Fig. 1 Imaging findings of CT of patient with PEHE complicated with COPD at first hospitalization
1.4 气管镜检查患者转入东南大学附属中大医院呼吸与危重症医学科后于2019 年11 月4 日行经支气管镜径向超声探查(图2),于右肺下叶前基底段行探及低回声区,于此处取活检。病理检查结果:可见异型细胞巢,结合临床和免疫标记符合EHE。免疫组织化学染色:Fli-1 (+),ERG(+),CD163(-),TFE3(-),TTF1(-),CD31 (+),CD34 (+),Ki67 (约5%+),Pan CK(-),EMA(-)。见图3。
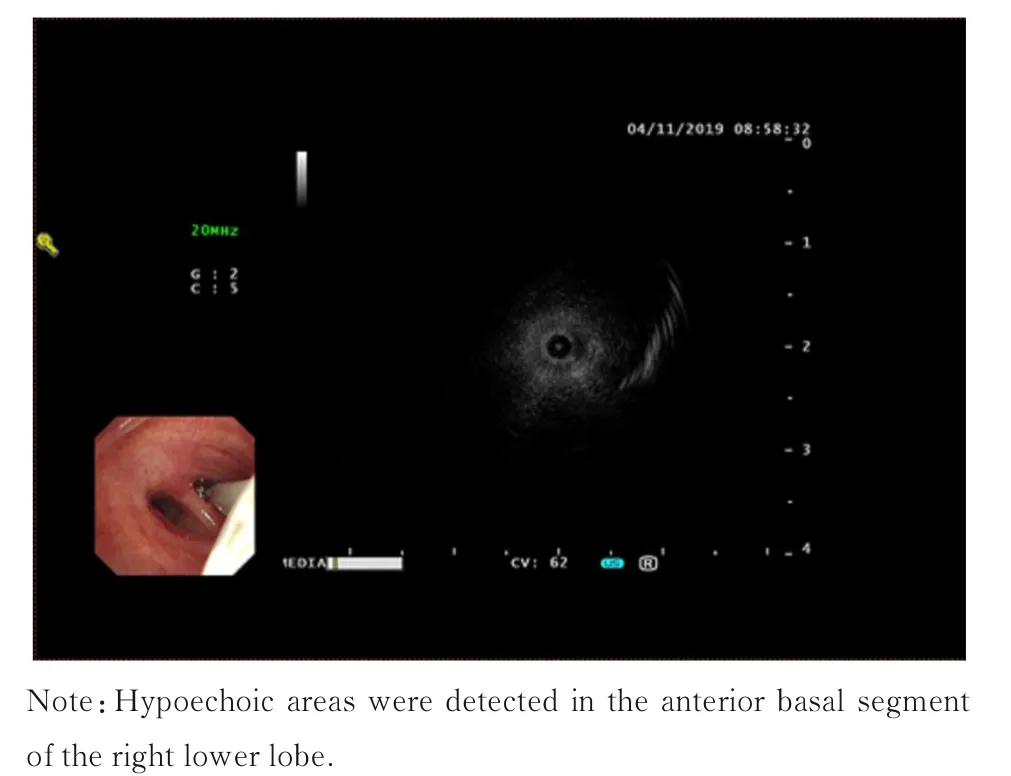
图2 PEHE 并发COPD 患者经支气管镜径向超声图像Fig. 2 Image of radial endobronchial ultrasound of patient with PEHE complicated with COPD
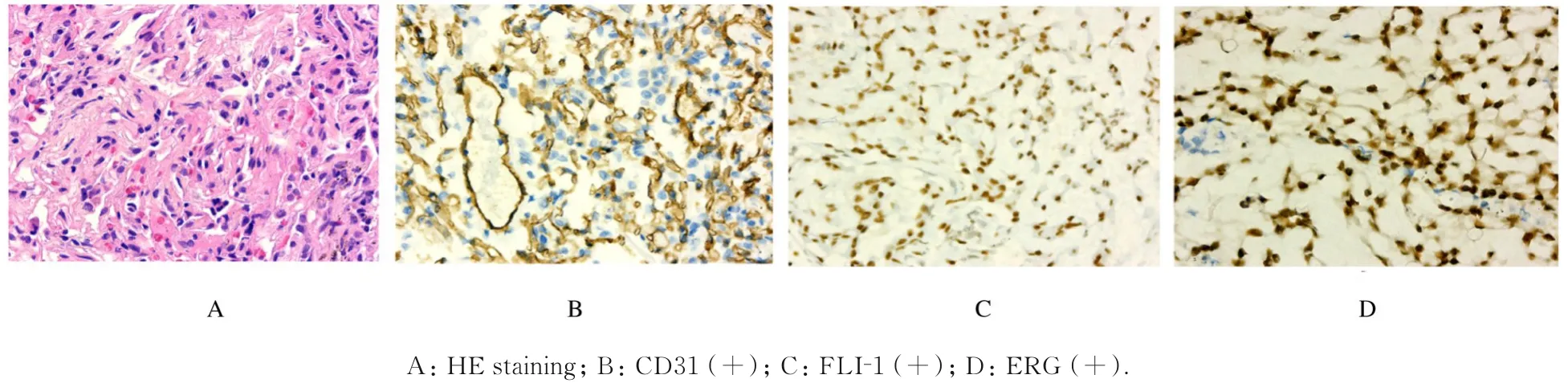
图3 PEHE 并发COPD 患者肺组织病理形态表现及免疫组织化学染色结果(×400)Fig.3 Pathomorphology and immunohistochemistry staining results of lung tissue of patient with PEHE complicated with COPD (×400)
1.5 临床诊断和首次治疗根据患者病史、查体、肺功能检查和气管镜病理结果,诊断为COPD 和PEHE。追问患者既往病史,家属补充并提供出院记录:5 年前患者曾因咳嗽、咳痰、痰中带血到当地医院就诊,查胸部CT 提示两肺结核可能性大,并发支气管扩张和肺气肿,伴肺大泡形成。结核菌感染T 细胞斑点试验(T-SPOT)有反应,痰集菌未找到抗酸杆菌。抗结核抗体阴性。肿瘤标志物未见明显异常。抗感染、止咳治疗后症状明显好转。转至上级医院行CT 引导下经皮肺穿刺。HE 染色:大片退变组织,可见少量纤维黏液样组织及条索样细胞;免疫组织化学染色:CD31 (+),CD34(),Ki67 (<5%+),CK7 (-),Pan CK(-),TTF1(-),ERG(+);结合HE 切片,诊断为PEHE。考虑该例患者肿瘤生物学低度恶性,未给予治疗,患者也未定期复诊。与5 年前外院CT 检查结果对比,本次CT 检查示肺部结节增多。由于患者高龄,存在结构性肺病,肺功能已明显下降,而PEHE 为惰性病程,治疗上未联合化疗,于2019 年11 月9 日给予恩度治疗,期间给予多索茶碱静滴、异丙托溴铵和沙丁胺醇雾化吸入扩张气道,患者胸闷和气喘症状明显好转,出院继续给予噻托溴铵喷雾剂治疗COPD。
1.6 后续治疗患者出院后自行停用噻托溴铵,胸闷和气喘症状再发。2019 年12 月2 日再次入院时患者咳嗽、咳痰和气喘症状明显加重已1 周,考虑COPD 急性加重,给予多索茶碱静滴、布地奈德和异丙托溴铵雾化吸入等对症治疗,患者自觉症状改善,次日行恩度治疗后出院,并嘱患者规律使用噻托溴铵喷雾剂。随后患者未能按时来院复诊。2020 年2 月4 日患者再次因胸闷、气喘明显加重入院,并伴有明显乏力,全身多处骨关节疼痛,以右肩关节为主。实验室检查:总蛋白59.7 g·L-1,白蛋 白 30.2 g·L-1,白 球 比 1.02,前 白 蛋 白0.08 g·L-1。胸腹盆CT 增强提示两肺渗出样改变新发,肝脏右后叶包膜下病灶,考虑转移灶可能性大(图4A)。胸椎+右肩关节MR 平扫:胸椎椎体、附件、棘突多发结节灶,右肱骨近端占位性病变,考虑转移灶可能性大(图4B)。患者病情进展,一般情况较差,改用安罗替尼(12 mg)口服抗肿瘤,同时给予止痛、解痉、平喘、化痰及营养支持等治疗,患者气喘和疼痛症状有所好转,1 周后出院。此后患者口服安罗替尼2 周后停药,至外院接受中药治疗(具体不详),未再继续口服安罗替尼。此时患者处于卧床状态,咳嗽加重、咳白痰,痰液不易咳出,胸闷、气喘加重,精神、食纳差,体质量继续下降,消瘦明显,于2020 年3 月11 日再次入院。查动脉血气分析:pH 值7.494,氧分压58.7 mmHg,氧合指数280 mmHg;血生化:钠133.6 mmol·L-1,氯97.5 mmol·L-1,钙2.02 mmol·L-1,总 蛋 白54.1 g·L-1,白 蛋 白26.8 g·L-1,前 白 蛋 白 0.10 g·L-1,血 沉116 mm·h-1,超敏C 反应蛋白89.4 mg·L-1。痰细菌培养阴性。痰真菌培养示白假丝酵母菌。与2020 年2 月5 日胸部CT 片比较,两肺渗出、左肺下叶实变和左侧胸腔积液新发(图4C)。先后给予头孢噻利和头孢地嗪抗感染,氟康唑抗真菌,辅以化痰、平喘、止痛及营养支持等治疗。由于患者处于疾病终末期,家属商议后将患者转回当地医院给予对症治疗,1 周后患者死亡。
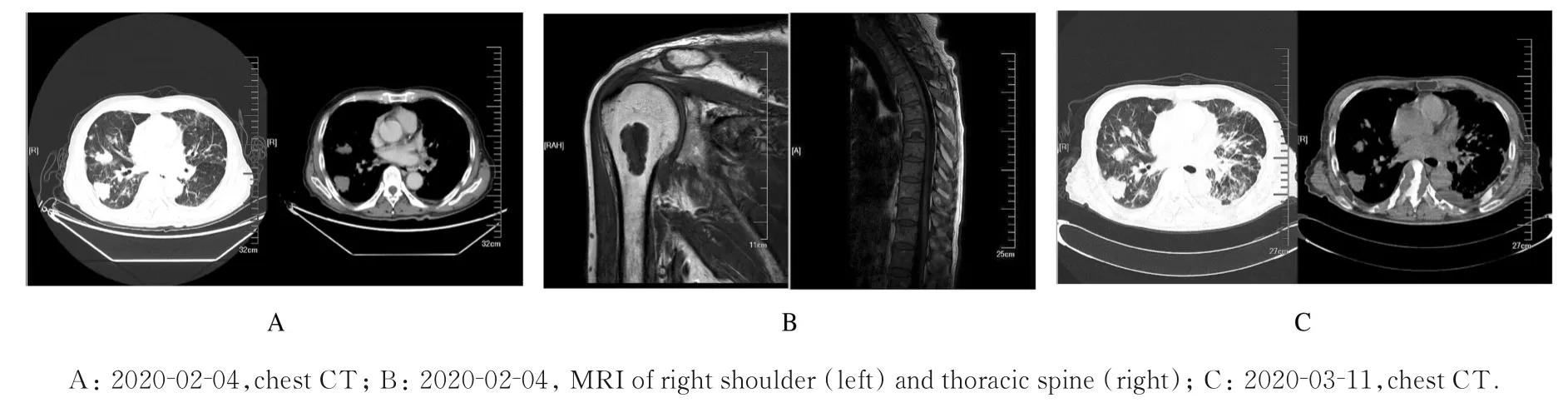
图4 PEHE 并发COPD 患者治疗过程中影像学表现Fig.4 Imaging findings of patient with PEHE complicated with COPD during treatment process
2 讨 论
1975 年DAIL 等[1]首 次 报 道 了1 例PEHE 患者,由于该病和血管肉瘤之间有重叠特征,在1982 年被命名为“上皮样血管内皮瘤”。EHE 由血管内皮细胞或前内皮细胞发展而来,发病率为10/10 万,可在所有年龄段中发生,但成人多于儿童,女性高于男性[2]。EHE 可能发生在包括软组织、肺、肝和骨骼的任何身体部位。根据既往报道,约30%的病例表现为PEHE[3]。
由于PEHE 临床症状不典型,多数患者是在胸部影像检查时偶然发现的,少数患者也会出现胸痛、胸腔积液或咯血,以及疼痛、厌食和体质量减轻等非特异性症状[4-5]。本例患者5 年前因胸闷和气喘症状查胸部CT 发现两肺病灶。PEHE 在胸部CT 上可以表现为双侧肺野血管周围结节,与小叶间隔增厚有关的网状和结节状模糊影及磨玻璃影,弥漫性浸润性胸膜增厚[6]。而影像学的上述表现需要与肺结核、肺癌伴肺内转移及肺转移癌等疾病相鉴别。本例患者以经皮肺穿刺确诊,当时给予对症治疗后呼吸系统症状明显好转,因此未针对PEHE进行治疗,此后症状无加重,患者也未能定期复查影像学检查。5 年后患者因出现胸闷、气喘和体质量减轻症状,首诊于东南大学附属中大医院心血管科,因患者既往吸烟史、胸部CT 提示两肺气肿伴肺大泡,结合肺功能检查FEV1/FVC<70%,诊断为COPD,该病例临床表现可以解释患者胸闷、气喘症状及体征改变,因此给予支气管扩张剂等对症治疗,并且在治疗过程中患者临床症状曾有所改善,上述情况可能也掩盖了PEHE 快速进展的过程。
PEHE 确诊主要依靠病理学诊断。以往经气管镜肺活检阳性率较低,获取病理的方式以手术及经皮肺穿刺活检为主,该例患者5 年前采取的方式即是经皮肺穿刺活检。但相较于径向超声引导下的经气管镜肺活检,经皮肺穿刺活检的气胸及咯血发生率较高[7],考虑本例患者肺功能下降,为减少有创检查的并发症,选择了经支气管镜径向超声探查并肺活检,所取标本足够完成常规病理及免疫组织化学染色。EHE 组织切片HE 染色光镜下典型表现为由排列成巢、索状的上皮样内皮细胞组成,胞浆轻度嗜酸性,细胞质丰富,一些细胞含有明显的胞质内液泡,偶尔会挤压细胞核[8]。细胞核呈现多形性,可有核内包涵体、胞质内空泡和基质改变[9]。EHE 形态学上有时难与上皮样血管肉瘤和其他上皮样肿瘤等区分,但免疫组织化学染色可以表达不同标记物。EHE 表达典型的内皮标记物,包括CD31、CD34、Fli-1 和ERG 等[10],其 中CD34 相对敏感,但特异性较差,而CD31 和Fli-1 组合用于鉴 定EHE 特 异 性 更 好[11]。该 例 患 者2 次 相 隔5 年的肺部病灶病理切片免疫组织化学染色结果与上述标记符合,因此诊断明确。 嵌合WWTR1-CAMTA1 和YAP1-TFE3 融合蛋白可驱动EHE 肿瘤的增殖[12],在一些与上皮样血管瘤和上皮样血管肉瘤等不易鉴别的情况下,还可以进行WWTR1-CAMTA1 融合蛋白检测及荧光原位杂交TFE3 基因重排的检测[10,13]。
EHE 较罕见,关于其最佳治疗策略没有大量临床研究可以遵循,如果病变局限可切除,则建议尽可能手术治疗[14]。在无症状的弥漫性病变患者中,定期随访有时则是一种合理的策略,也有文献曾报道了部分EHE 患者肿瘤自行消退[15]。一项荟萃分析[14]显示:不考虑治疗方式,EHE 患者1、 3 和5 年 生 存 率 分 别 为83.4%、 55.8% 和41.1%。进展期EHE 的治疗则有抗血管生成药物、细胞毒性药物化疗和免疫调节剂治疗等。由于典型的PEHE 为多灶性表现,因此很少有PEHE 患者能够接受外科手术治疗。一些病例采取单独或联合使用抗肿瘤血管生成剂及化疗,使用药物包括卡铂、紫杉醇联合贝伐单抗[16-17],卡铂、紫杉醇联合恩度[18],卡铂和依托泊苷[17,19],阿霉素、达卡巴嗪和异环磷酰胺[17],接受治疗的患者中有病情稳定者,也有疾病进展者。研究[20]显示:有患者使用贝伐单抗单药一线治疗PEHE 维持了长达11 个月病情稳定,以沙利度胺二线治疗可维持6 个月病情稳定。一些PEHE 患者过度表达血管内皮生长因子受体2(vascular endothelial growth factor receptor 2,VEGFR2),靶向该受体的药物可能有潜在疗效,如阿帕替尼[21]和帕唑帕尼[22]。本例患者高龄,并发COPD,肺功能下降,治疗方法的选择需考虑患者的生存获益情况,因此未选择联合化疗的方案,在同时治疗COPD 的基础上,先后接受了恩度和安罗替尼单药治疗。恩度作用机制是通过抑制形成血管的内皮细胞迁移来达到抑制肿瘤新生血管的生成;而安罗替尼是一种新型小分子多靶点酪氨酸激酶抑制剂,能有效抑制VEGFR、血小板衍生生长因子受体(platelet-derived growth factor receptor,PDGFR)、成纤维细胞生长因子受体(fibroblast growth factor receptors,FGFR)和c-Kit 等,具有抗肿瘤血管生成和抑制肿瘤生长的作用。两者均为抗肿瘤血管生成药物,但在该患者并未能获益,病情快速进展,可能还有其他机制参与肿瘤发生发展。目前也有研究[23]显示:PEHE 中Yes 相关蛋白(Yes-associated protein,YAP)/含PDZ 结合序列的转录共激活子(transcriptional coactivator with PDZ-binding motif,TAZ)可诱导高亲和力亮氨酸转运蛋白的表达,增加对亮氨酸的摄取,亮氨酸是雷帕霉素靶蛋白复合物1 (mammalian target of rapamycin complex 1,mTORC1)的激活物,可导致细胞增殖,因此雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)抑制剂西罗莫司对于晚期EHE 患者显示出较好的疗效[24]。而程序性死亡受体配体1(programmed death ligand 1,PD-L1)抑制剂和特异性靶向药物研究也在进行中。
EHE 整体呈惰性病程,但又具有广泛转移的侵袭性,临床病程可以多年或在几个月内出现死亡,总 死 亡 率 为15%~45%[3]。20%~40% 的EHE 患者存在转移[25],而有症状或有转移的患者预后差[26]。51%的PEHE 患者存在转移,最常见转移部位是肝脏、胸膜和淋巴结,而骨转移往往是临 床 上 最 严 重 的[3]。一 项 回 顾 性 研 究[25]统 计了49 例EHE 患者,5 年总生存率为81%;在另一报道[9]中,52 例患者3 年生存率在无胸膜受累时为46%,但如果累及胸膜和/或伴有胸腔积液,则生存率为16%。本例患者5 年前已确诊PEHE,未行全身评估是否存在转移,采取了随诊策略,符合疾病惰性病程;在出现症状后给予干预,但患者病情快速进展,发生肝脏及骨转移,最后死亡,与既往报道的PEHE 病程一致。而本例患者并发COPD是否在疾病进展中起促进作用,由于缺乏相关报道及研究资料,还需进一步探讨。
综上所述,PEHE 为临床罕见疾病,发病率低,临床表现及影像学检查无特异性,确诊需要依据病理学检查结果。由于该病病程可呈慢性过程,有症状或有转移的患者预后较差,如并发基础肺部疾病,则更易被临床忽视。治疗方面,除手术治疗外,目前无最佳方案可推荐,常用方案包括抗血管生成药物、细胞毒性药物化疗和免疫调节剂治疗等,而PEHE 患者基础肺疾病的存在,影响了治疗药物的选择。

