人源单核细胞增生李斯特菌的基因组进化及耐药性分析
姚 广, 陆玉颖, 张庆华, 朱海霞, 陈益伟, 孙 东, 庄 振, 张 峰, 刘 鼎, 宋 治
(中南大学湘雅三医院神经内科,湖南 长沙 410008)
单 核 细 胞 增 生 李 斯 特 菌 (Listeria monocytogenes,LM)是一种广泛存在于土壤和饲料中的革兰阳性杆菌,被列为20 世纪90 年代四大食源性疾病致病菌之一。LM 主要通过粪-口途径感染,还可通过眼及破损皮肤和黏膜进入人体而造成感染[1]。细菌侵入血液后,可通过破坏的血脑屏障导致中枢神经系统感染,引起脑膜炎、脑膜脑炎、脑脓肿或脑积水形成[2-4]。菱脑炎(脑干脑炎)是LM 脑炎的一种特殊形式,主要影响脑干和小脑,是老年人细菌性脑膜脑炎的第三大常见病因,仅次于肺炎链球菌和脑膜炎奈瑟菌。全球每年人类感染LM 的发病率为(0.2~7.4)/1 000 000,死亡率达20%~70%。目前,LM 感染已成为世界范围内一个重要的公共卫生问题[5],国内具体的发病情况和致死率还未有明确报道。本研究通过探讨1 例脑膜炎患者病情迅速进展、治疗失败的原因,阐明LM的基因组特征、功能及耐药机制,为临床提高该病早期诊断率和进行有效治疗提供参考和依据。
1 资料与方法
1.1 临床资料患者,男性,51 岁。因发热、头痛7 d,加重伴意识障碍2 d,于2017 年8 月9 日入中南大学湘雅三医院神经内科。既往体健。入院时格拉斯哥昏迷指数(GCS)评分11/15(E3V3M5)。脑脊液细胞学检查可见胞内革兰阴性杆菌。入院后予以经验性美罗培南+万古霉素+大剂量青霉素治疗,症状仍进行性加重,入院后第3 天GCS 评分降至6/15(E1V2M3),第5 天突发呼吸骤停、双瞳散大,予以急诊侧脑室穿刺后仍抢救无效,最终死亡。
1.2 细菌分离培养取患者脑脊液2 mL,3 000 r·min-1离心沉淀15 min,用移液枪取管底沉淀液放入预先配制的10 mL 无菌李斯增菌肉汤(LB)中,并置于30℃生化培养箱中培养24 h,然后用接种环将LB 增菌液划线接种于血琼脂培养基,置于37℃生化培养箱中培养24 h。从血琼脂平板上挑取菌落进一步行革兰染色镜检和基质辅助激光解吸/电离飞行时间质谱(MALDI-FOF-MS)鉴定。菌落革兰染色:可见成簇的革兰阳性杆菌,经飞行时间质谱鉴定为LM,药敏实验报告对氨苄西林、青霉素和复方新诺明敏感。见图1。
1.3 菌株基因组提取和全基因测序从该例患者脑脊液中分离得到菌株,常规QIAGEN 试剂盒提取全基因组DNA,安捷伦2100 片段分析系统定量后,按美国illumina 公司基因组测序流程构建基因组文库,质控后通过Illumina HiSeq 3000 系统进行细菌De novo 测序,对原始数据进行生物信息学分析处理。
1.4 基因组拼接及基因组注释从原始数据中过滤出低质量数据,进行初始组装,并通过SOAPdenovo2 获得连续序列。SSPACE 获得整段序列,并定位组装评估基因组质量。比较从美国国家生物技术信息中心 (National Center for Biotechnology Information,NCBI) 数据库下载的该物种蛋白质序列信息和BLAST 预测蛋白质编码基因。用tRNAScan-SE 软件鉴定转运核糖核酸(transfer RNA,tRNA) 特征,用RNAmmer 软件鉴定核糖体RNA。利用基因本体(gene ontology,GO) 数据库和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG) 数据库对预测基因数据进行功能聚类分析。
1.5 基因组分析与系统进化分析以国际标准LM EDG-e 菌株(NC-u003210.1)为参考基因组,利用BLAST 软件比较法对38 个菌株和样品的基因组进行进化分析,用最大似然值构建系统发生树。
1.6 耐药基因分析在菌株的基因组上定位了4 个耐药基因,包括lmo1250(抗生素耐药蛋白基因)、lmo2355 (多药耐药蛋白基因)、lmo1712(多药耐药蛋白基因)和lmo0839(四环素耐药蛋白基因),以细菌基因组序列为基础,通过单核苷酸多态性(single nucleotide polymorphism,SNP)定位和分析,并通过数据库分析该菌株发生的耐药性突变。
2 结 果
2.1 临床检查结果磁共振成像液体衰减反转恢复 序 列 (fuild attenuated inversion recovery,FLAIR)(图1A 和B)显示:患者延髓和中脑有高信号病灶(黑色箭头),双侧侧脑室和第三脑室体积增大,室管膜明显强化,考虑感染继发脑积水并间质性脑水肿(白色箭头)。瑞氏-吉姆萨染色的脑脊液细胞学检查结果显示:嗜中性粒细胞比例明显升高,激活的单核细胞中可见多条胞内杆菌(黑色箭头,图1C)。细菌培养可见灰白色、中等大小和半透明的圆形凸起的LM 菌落(图1D)。将培养的LM 菌落涂片进行革兰染色,显示为革兰阳性杆菌(图1E)。
2.2 LM 基因组的组装对培养菌株的基因组进行全长测序,该菌株基因组大小约3 008 507 bp,GC 含量为38.06%,共有31 个scaffolds,命名为XY1803。对基因组质量进行评估后,错率为0.01% (374 bp)(表1)。 利 用tRNAScan-SE、RNAmmer 和GeneMark 软件对组装的基因组进行基因预测,发现了3 001 个蛋白质编码序列(coding sequences,CDSs),平均长度为300 个氨基酸。3 001 个编码蛋白序列中有252 种编码序列,3 种 核糖体RNA (ribosomal RNA,rRNA)和45 种tRNA。
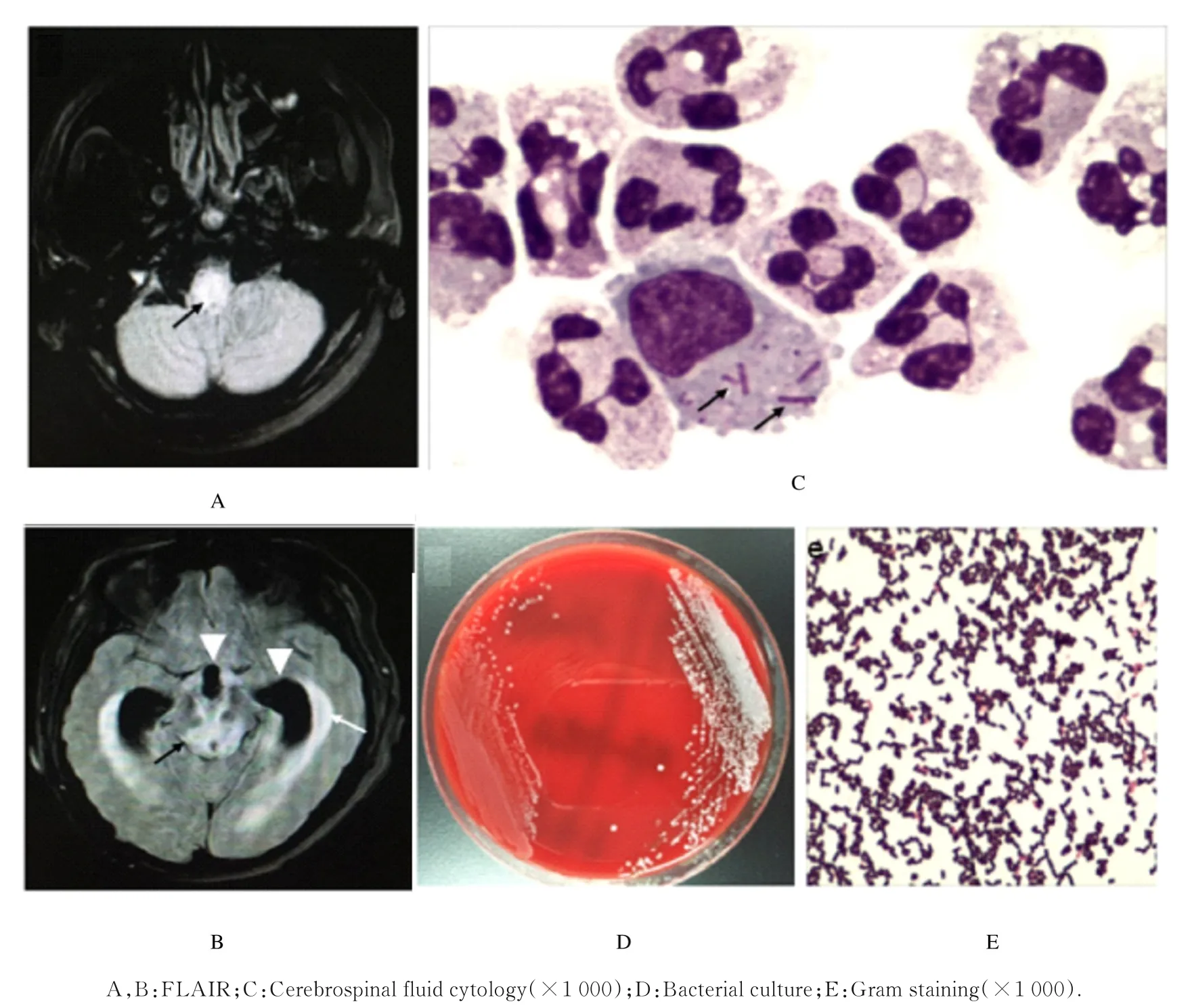
图1 LM 脑膜炎患者的影像学资料及实验室检查结果Fig.1 Imaging and laboratory findings of patient with LM meningitis
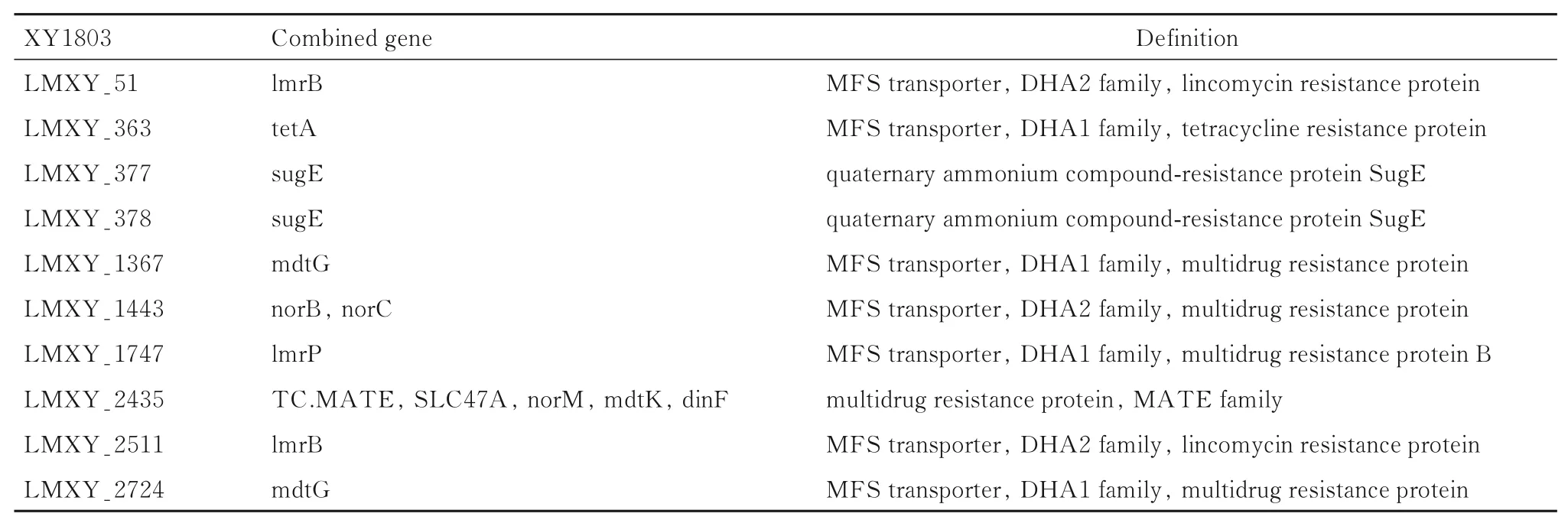
表1 细菌基因组测序结果与数据库中耐药基因注释的比较Tab. 1 Comparison of sequencing results of bacterial genome and drug-resistance gene annotation in database
2.3 基因注释与分析将预测的3 001 个基因与公共数据库进行比较,并通过KEGG 数据库聚类分析,结果表明:与LM 基因组一致率为88%,将基因 序 列 分 别 与 SWISS-PROT、 TREMBL、PFAM、NR 和KOG 库进行比对,取相似度≥30%、e 值≤1e-5 的注释,合并得到的所有注释详细信息。基因的功能类别包括信息储存与处理、细胞周期与信号传递和细胞能量代谢等(图2)。
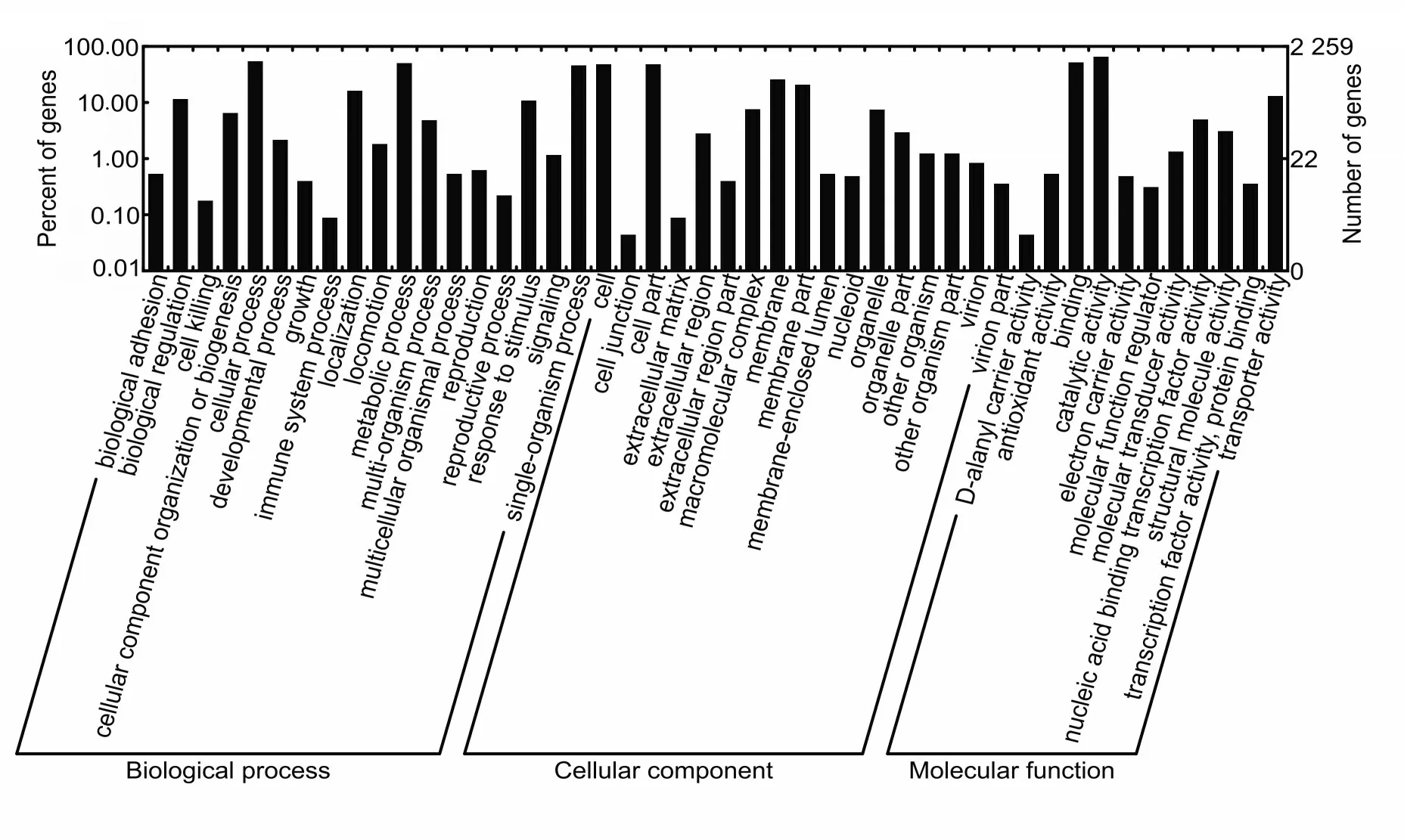
图2 GO 聚类结果Fig.2 Results of GO classification
2.4 基因组学和系统进化分析继续对培养菌株进行基因组学分析,以国际标准菌株EDG-e 为参考,从NCBI 数据库中获得了38 个具有代表性的LM 基因组。系统进化分析表明:数据库中经典人源LM 标准株EGD-e 和Finland1998 均位于进化谱系Ⅰ中,而EDG-e 属于实验室菌株1/2a 血清型;Finland1998 菌株为血清型3a,起源于芬兰相关疫情;本研究分离的菌株XY1803 与从美国食品加工环境中分离的FSL N1-017 菌株(血清型4b,谱系Ⅱ)和从美国散发的患者中分离的SLCC2540(血清型3b,谱系Ⅱ)基因组进化结构相似(图3),但基因组序列的一致性也小于88%,约有3 000 bp的基因组序列不一致,认为是系谱Ⅱ中一个新的分型。
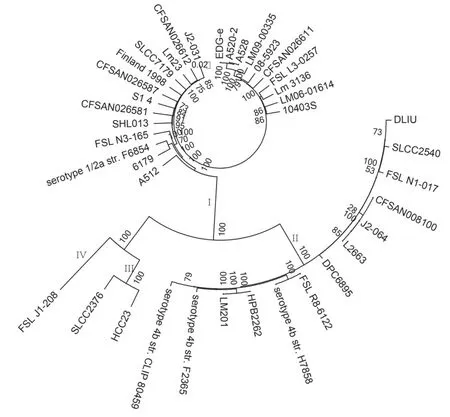
图3 LM 进化图Fig.3 Evolution of LM
2.5 细菌的耐药性分析通过对菌株XY1803 基因组3 001 个注释基因分析,发现了已有报道的耐药 基 因,包 括 mdtG、 norB、 norC、 lmrP、TC. MATE、 SLC47A、 norM、 mdtK、 dinF、lmrB、mdtG、tetA 和sugE,见表1。在KEGG 聚类分析中,耐药基因主要参与转运蛋白活性、质膜和膜的组成部分。细菌基因组中的4 个耐药基因与EDG-e 基因组进行配对,分别为XY1803-51、XY1803-770、XY1803-2796和XY1803-1997(图4)。4 个基因长度约1 000 bp,SNP 均小于90%,匹配率 大 于92%。XY1803_51 比 对lmo0519,SNP 为25; XY1803_2796 比 对 lmo1712,SNP 为 53;XY1803_770 比 对lmo1250,SNP 为82;XY1803_1997 比对lmo2355,SNP 为89。
3 讨 论
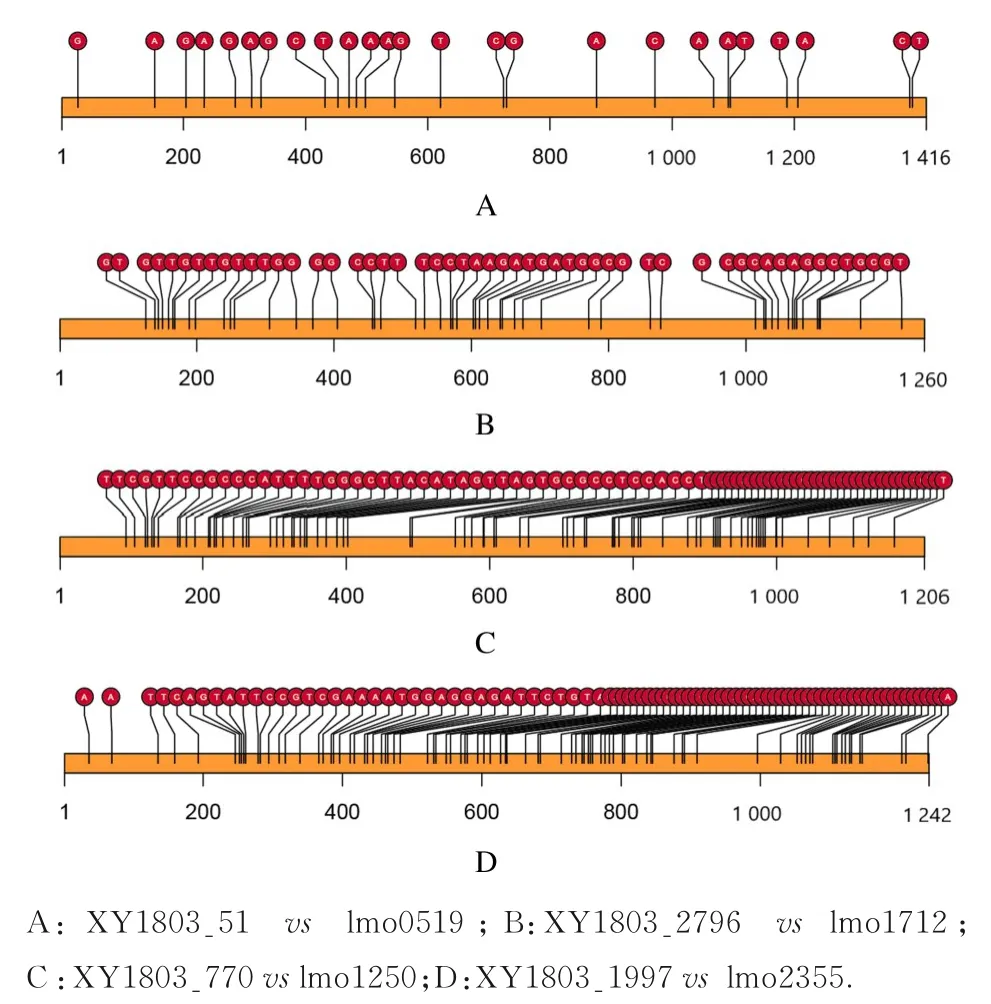
图4 耐药基因的突变位点图Fig.4 Location map of resistance gene mutation
LM 感染被认为是最严重的细菌食源性感染之一,一旦累及中枢神经系统,在合理抗感染治疗的基础上其死亡率仍高达30%[6]。因此,在临床上快速鉴定出菌株类型,结合药敏结果选择敏感的抗生素进行及早治疗是救治成功的关键。然而,对于中枢神经系统LM 感染,脑脊液培养和血培养呈阳性的患者不足50%[7]。培养时间长、阳性率低和药敏实验的不确定性是导致中枢神经系统LM 感染患者死亡率和致残率高的重要原因。通过新一代的测序技术,可以准确、快速(3 d 内)明确病原体类型,并通过准确分析和注释细菌的基因组[8-11]完成菌株分型和耐药性分析,从而使及早制定针对性的敏感抗生素治疗方案成为可能。
根据细菌基因组的系统进化分析,LM 可分为Ⅰ、Ⅱ、Ⅲ和Ⅳ4 个谱系。谱系Ⅰ菌株通常从人类临床病例中分离出来,其中多数为血清型4b,是LM 感染暴发的主要原因。谱系Ⅱ菌株通常是从食物和环境中分离出来的,血清型以1/2a 为主,主要引起反刍动物感染,极少导致人类致病[12-13]。本研究对该例脑膜炎患者脑脊液中培养的LM 菌株XY1803 进行全基因组测序,结果显示:该菌株属于Ⅱ谱系,与SLCC2540 菌的亲缘关系更为密切。SLCC2540 菌株已有少量报道能够导致李斯特菌感染性疾病,本研究结果表明:牧产品食物源性的LM 也具有强烈的人疾病感染性,不能单纯依靠血清型分析判断致病性,需要进行全基因组测序进行病原微生物溯源。
同时,本文作者通过对细菌基因组进行注释 发 现 MDTG、 NORB、 NORC、 LMRP、TC.MATE、SLC47A、NORM、MDTK、DINF、LMRB、MDTG、TETA 和SUGE 等与耐药性相关的基因;EggNOG 分类分析结果显示:上述基因与[P] ENOG410XNN3 耐药转运体emrb-qaca 亚家族、[G]糖转运和代谢和[P]ENOG410XSK2多药耐药蛋白mdtH 等细菌耐药机制有关联。在相关基因的KEGG 聚类注释中,上述耐药基因与K18926 菌株的ermb、mdth 及DHA2 基因家族、膜锌组分和转运体活性有关,分别属于主要协同转运蛋白超家族(major facilitator superfamily,MFS)转运体、DHA1 家族和多药耐药蛋白[14-15]。MFS是主要的二级膜转运蛋白超家族,与细胞内外的物质交换和能量代谢有密切关联。上述耐药相关基因的发现对于临床抗感染药物的选择具有重要的指导意义。
此外,本研究还预测出与耐药基因相匹配的基因变异,是量化LM 耐药程度的一个重要指标。细菌基因组中的4 个耐药基因SNPs 均小于90%,匹配率大于92%,本文作者认为该菌株具有中度耐药性,并未发生大范围的耐药性基因突变。LM 的胞内特性使其难以有效治疗。青霉素、阿莫西林和氨苄西林等能够与LM 细胞膜上青霉素结合蛋白(penicillin-binding protein,PBP) 中的青霉素结合蛋白3(penicillin-binding protein-3,PBP-3) 高亲和力结合,被细胞吸收后储存在胞质中,从而导致细胞死亡,是临床一线用药[16]。复方新诺明、万古霉素、亚胺培南、美罗培南、庆大霉素和哌拉西林等虽有不同程度耐药性报道,但也均可作为临床选择用药[16-18]。国内外多项研究[16-19]表明:LM 对四环素、头孢他啶、头孢呋辛和头孢曲松高度耐药,与LM 细胞膜上PBP 相关结合位点有关。本研究分离得到的XY1803 菌株,在lmo1250(抗生素耐药蛋白基因)存在25 个耐药相关突变,变异度相对较小,故对头孢类抗生素耐药;但在lmo2355(多药耐药蛋白基因)、lmo1712(多药耐药蛋白基因)和lmo0839(四环素耐药蛋白基因)存在较多突变,可以改变细菌耐药蛋白的编码,影响耐药蛋白的结构,故对四环素等其他抗生素耐药性较低,与临床药敏实验和实际用药结果相符合。
LM 感染最常见的中枢神经系统表现是脑膜脑炎(70%~97%),菱脑炎少见,大多数成人呈亚急性病程[20]。本例患者感染源于经口摄入病菌(饮用过期牛奶),在不存在任何易感因素(妊娠、糖皮质激素治疗、免疫功能受损和年龄等)的情况下,迅速累及中脑和延髓导致呼吸衰竭和脑疝形成,呈现快速进展的暴发性病程,临床较为罕见。本文作者通过细菌基因组测序分析认为:该菌株可能为新发LM,与以往人源性LM 同源性较低(小于88%),存在大量未知序列;细菌具有相对较强的感染性和侵袭性,并有超过300 个蛋白功能未知。该例患者即使在早期已使用足量、敏感的抗生素仍治疗无效死亡,提示传统的细菌培养和药敏实验只能粗略鉴定细菌种类和大致耐药性,无法对菌株的基因组变异和耐药性进行全面分析。通过病原体高通量测序的数据比对,可大大提高临床医师对感染细菌的全面了解,为感染性疾病的早期诊断和治疗方案的制定提供客观依据,同时加强了对临床诊疗的预判性。快速诊断和治疗LM 疾病,引入一体化生物信息细菌基因组分析系统和基因组快速测序技术是未来临床势在必行的趋势[9,21],本研究为此类疾病的诊断、治疗及耐药性分析提供了重要的参考依据。

