EDC 对牙本质即刻及老化微拉伸粘接强度的影响
沙 青, 李 贺, 张 红, 程博群, 王 莹, 闫琳琳, 邹馨颖, 张志民
(吉林大学口腔医院牙体牙髓科,吉林 长春 130021)
随着口腔微创理念的发展,树脂粘接修复技术已得到广泛应用,其能较好地恢复患牙的美观和功能,在牙体硬组织缺损修复中发挥重要作用。树脂牙本质粘接修复中,由于过多水分残留导致粘接树脂渗透不全和聚合不全,并且弱酸性环境激活内源性基质金属蛋白酶(matrix metalloproteinases,MMPs),使胶原和树脂发生降解,粘接修复失败。为了提高牙本质粘接强度,研究者提出了多种方法和策略。汪文厅等[1]用含15%10-甲基丙烯酰氧癸基磷酸酯和1%苯扎氯铵的新型底涂剂处理牙本质,提高了自酸蚀粘接剂和通用型粘接剂的短期和长期粘接强度;有学者采用Er,Cr∶YSGG 激光预处理[2]或在粘接剂中加入聚氨酯[3],也有部分学者用乙二胺四乙酸预处理[4],但采用胶原交联剂预处理是最常用的方法。朱辞名等[5]研究发现:用蓝光核黄素预处理能增强树脂牙本质粘接耐久性,减缓其老化过程。1-(3-二甲基氨基丙基)-3-乙 基 碳 二 亚 胺 [1-ethyl-3 (3-dimethylaminopropyl) carbodiimide,EDC] 为 一种常见的化学交联剂,不仅能够促进胶原交联[6],而且能够抑制MMPs 活性[7]。目前研究[8-10]显示:EDC 作为预处理剂不仅能够促进脱矿牙本质胶原交联,使极限拉伸强度、弹性模量、抗酶解能力和热变性温度提高,而且能够抑制或灭活牙本质内源性MMPs,从而减少纳米渗漏,提高树脂牙本质粘接耐久性。研究[11-13]显示:用0.3 mol·L-1EDC 预处理脱矿根管牙本质60 s 不影响纤维桩即刻粘接强度,可明显降低MMPs 活性并改善混合层的弹性模量和老化1 年的粘接强度。本研究将EDC 直接添加到通用型粘接剂Single Bond Universal 中,从细胞毒性、微拉伸粘接强度和断裂模式3 个方面探讨EDC 对通用型粘接剂粘接性能的影响,以期为粘接剂的临床应用提供参考依据。
1 材料与方法
1.1 主要材料和仪器
EDC(上海源叶生物科技有限公司),胎牛血清(以色列BI 公司),DMEM 培养基和0.25%胰酶(美国Hyclone 公司),CCK-8 试剂盒(日本株式会社同仁化学研究所),通用型粘接剂Single Bond Universal 和Z350 树 脂(美 国3M 公 司)。SYJ-150A 型低速切割机和游标卡尺(沈阳科晶自动化设备有限公司),光固化机(美国登士柏公司),AG-XPLUS 万能试验机(日本岛津公司),体式显微镜(日本Olympus 公司),5%CO2恒温培养箱(美国Thermo Fisher Scientific 公司),超净工作台(苏州苏洁医疗器械有限公司),酶标仪(美国BioTek 公司)。
1.2 细胞毒性检测
1.2.1 实验性粘接剂的制备 将EDC 添加到通用型粘接剂Single Bond Universal 中配制成分别含0.1、0.2 和0.3 mol·L-1EDC 的实验性粘接剂,用搅拌机混合均匀后,4℃避光条件下保存备用。
1.2.2 粘接剂浸提液的制备 依据粘接剂使用说明,取60 μL 粘接剂使用聚四氟乙烯模具光照固化80 s 制备1.5 cm×2.0 cm 粘接剂膜,紫外线照射4 h,正反各2 h,以浸提液量与试样表面积比为2.5 mL·cm-2加入10%胎牛血清的DMEM 培养液,置于37℃、5% CO2培养箱中培养24 h,0.22 μm微滤器过滤,4℃保存备用。
1.2.3 CCK-8 法检测 取第3 代呈对数生长期的L-929 成纤维细胞(吉林大学基础医学院提供),调整细胞密度为3×104mL-1,加入96 孔细胞培养板中,每孔100 μL,置于37 ℃、5%CO2培养箱中24 h,待细胞贴壁后,分为阴性对照组及0、0.1、0.2 和0.3 mol·L-1EDC 组,弃去原液,分别加入含10% 胎牛血清的DMEM 培养液及含0、0.1、0.2 和0.3 mol·L-1EDC 的 实 验 性 粘 接 剂 浸 提 液100 μL,每组5 孔,并设置空白对照组(10%胎牛血清的DMEM 培养液),置于37℃、5% CO2培养箱中,分别于24、48 和72 h 随机取出一块96 孔细胞培养板,每孔加入10 μL CCK-8 溶液,在37℃、5%CO2培养箱中孵育1.5 h,采用酶标仪于波长450 nm 处测定其吸光度(A)值,并计算各组细胞相对增殖率(relative growth rate,RGR),RGR=(实验组A 值-空白对照组A 值) / (阴性对照组A 值-空白对照组A 值) ×100%。按照《美国药典》,根据RGR 采用5 分制法进行细胞毒性分级(CTS):0 级,RGR≥100%;1 级,RGR 为75%~99%;2 级,RGR 为50%~74%;3 级,RGR 为25%~49%; 4 级,RGR 为1%~24%; 5 级,RGR<1%;0 和1 级为合格,2 级应该结合细胞形态综合评价,3~5 级为不合格。
1.3 微拉伸粘接强度测试
在吉林大学口腔医院颌面外科收集新鲜拔除的无龋、无牙体缺损和发育正常的第三磨牙28 颗,去除牙石及软组织,保存于4℃、0.5%氯胺T 溶液中备用,每周换液1 次,1 个月内用完。
1.3.1 即刻微拉伸试件的制备和即刻微拉伸粘接强度测试 在水冷却下用低速切割机垂直于牙体长轴去除牙齿面釉质,体式显微镜下观察暴露浅层牙本质,流水下用600 目水砂纸打磨牙本质表面1 min,将16 颗牙随机分为4 组,分别为对照组及0.1、0.2 和0.3 mol·L-1EDC 组,每组4 颗。在牙本质表面涂布粘接剂60 s,轻吹10 s,光照固化20 s,然后分层堆塑Z350 光固化复合树脂,每层1 mm 光照固化20 s,最后形成4 mm 厚树脂,置于37℃去离子水中储存24 h,用低速切割机沿与粘接界面垂直的方向进行切割,制备1 mm×1 mm×8 mm 长条形试件。
在体式显微镜观察,每组选取15 个无裂纹的完整试件,将试件用水草胶粘接于夹具上,用万能材料试验机测试微拉伸粘接强度,加载速率为1.0 mm·min-1,记录试件断裂载荷(N) 最大值,用游标卡尺测量并计算每个试件实际粘接面积(mm2),计算微拉伸粘接强度。微拉伸粘接强度(MPa)=断裂载荷(N)/粘接面积。
1.3.2 老化微拉伸试件的制备和老化微拉伸粘接强度测试 根据即刻微拉伸粘接强度结果,将12 颗牙随机分为对照组及0.1 和0.2 mol·L-1EDC组,每组4 颗,进行冷热循环实验,牙齿处理及树脂堆塑见“1.3.1”。将堆塑完成的牙齿在37℃去离子水中保存24 h 后进行冷热循环老化,冷热循环采用55℃和5℃,往复循环5 000 次,每次在高温或低温中停留30 s,间隔时间2~3 s。冷热循环结束后用低速切割机制备微拉伸试件,每组选取15 个无裂纹的完整试件,并进行微拉伸粘接强度测试,方法见“1.3.1”。
1.4 断裂模式观察
收集微拉伸粘接强度测试完成后所有试件牙本质断端,在体式显微镜下观察断裂部位确定断裂模式。断裂模式分为3 种:①界面破坏,断裂发生于粘接剂与牙本质界面或粘接剂与复合树脂界面,包括粘接剂内聚破坏;②混合破坏,部分为界面破坏,部分为牙本质或树脂破坏;③内聚破坏,断裂发生于复合树脂内或牙本质内。
1.5 统计学分析
采用GraphPad Prism 5 统计软件进行统计学分析。各组细胞RGR 和各组试件微拉伸粘接强度均符合正态分布,以表示,多组间样本均数比较采用单因素方差分析,组间样本均数两两比较采用Tukey 检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 各组细胞RGR 和毒性分级不同时间点各组粘接剂浸提液与细胞共培养后的RGR 和毒性分级见表1。与阴性对照组比较,不同浓度粘接剂浸提液组随着共培养时间延长,各组细胞RGR 下降,细胞毒性增加,但组间比较差异均无统计学意义(P>0.05)。相同时间点,随着EDC 浓度增加,各组细胞RGR 逐渐下降,细胞毒性增加,但差异也无统计学意义(P>0.05)。不同时间点不同浓度粘接剂浸提液细胞毒性均较轻,均为1 级,合格。
2.2 各组试件微拉伸粘接强度即刻微拉伸粘接强度测试中,与对照组比较,0.1 mol·L-1EDC 组试件粘接强度提高28.33%,0.2和0.3 mol·L-1EDC组试件粘接强度分别降低13.68%和39.60%。与对照组比较,0.1和0.3 mol·L-1EDC组试件粘接强度差异有统计学意义(P<0.05);与0.1 mol·L-1EDC组比较,0.2 和0.3 mol·L-1EDC 组试件粘接强度差异均有统计学意义(P<0.05);与0.2 mol·L-1EDC组比较,0.3 mol·L-1EDC 组试件粘接强度差异有统计学意义(P<0.05)。
表1 不同时间点各组细胞RGRTab.1 RGR of cells in various groups
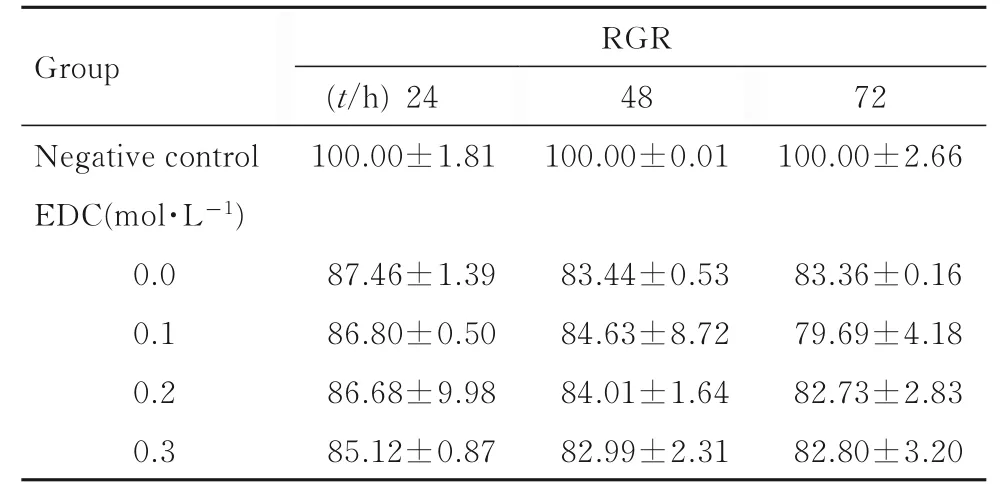
表1 不同时间点各组细胞RGRTab.1 RGR of cells in various groups
Group Negative control EDC(mol·L-1)0.0 0.1 0.2 0.3 RGR(t/h) 24 100.00±1.81 48 100.00±0.01 72 100.00±2.66 87.46±1.39 86.80±0.50 86.68±9.98 85.12±0.87 83.44±0.53 84.63±8.72 84.01±1.64 82.99±2.31 83.36±0.16 79.69±4.18 82.73±2.83 82.80±3.20
老化微拉伸粘接强度测试中,与对照组比较,0.1 mol·L-1EDC 组 试 件 粘 接 强 度 提 高66.43%,0.2 mol·L-1EDC 组 试 件 粘 接 强 度 降 低24.29%。与对照组比较,0.1 和0.2 mol·L-1EDC 组试件粘接强度差异均有统计学意义(P<0.05); 与0.1 mol·L-1EDC 组比较,0.2 mol·L-1EDC 组试件粘接强度差异有统计学意义(P<0.05)。
与即刻微拉伸粘接强度比较,老化微拉伸粘接强度测试中各组试件粘接强度均下降,对照组和0.2 mol·L-1EDC 组试件粘接强度差异均有统计学意义(P<0.05)。见表2。
表2 各组试件即刻和老化微拉伸粘接强度Tab. 2 Immediate and aging micro-tensile bonding strengths of specimens in various groups
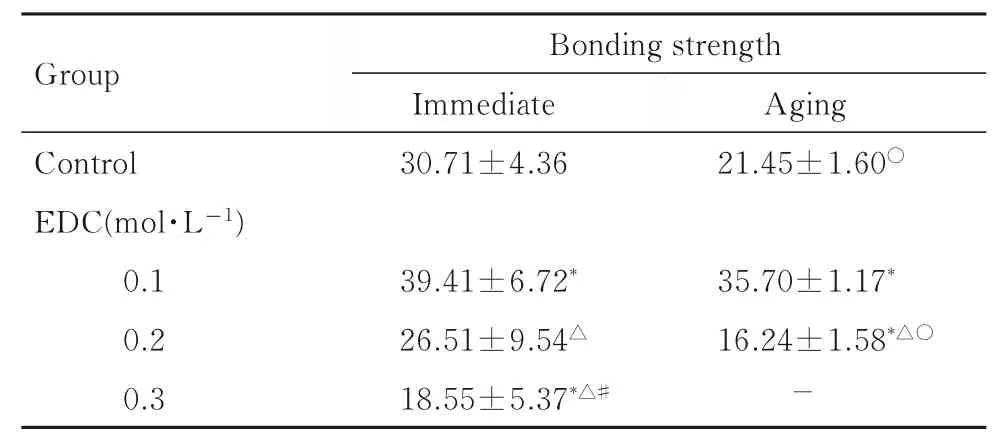
表2 各组试件即刻和老化微拉伸粘接强度Tab. 2 Immediate and aging micro-tensile bonding strengths of specimens in various groups
*P<0.05 compared with control group;△P<0.05 compared with 0.1 mol·L-1EDC group;#P<0.05 compared with 0.2 mol·L-1 EDC group;○P<0.05 compared with immediate group.“-”:No data.
Group Control EDC(mol·L-1)0.1 0.2 0.3 Bonding strength Immediate 30.71±4.36 Aging 21.45±1.60○39.41±6.72*26.51±9.54△18.55±5.37*△#35.70±1.17*16.24±1.58*△○—
2.3 各组试件断裂模式在即刻断裂模式中,对照组、0.2 和0.3 mol·L-1EDC 组试件均以界面破坏为主,0.3 mol·L-1EDC 组几乎全部为界面破坏,0.1 mol·L-1EDC 组试件以混合破坏为主。在老化断裂模式中,对照组试件以界面破坏为主,0.1 mol·L-1EDC 组试件以混合破坏为主,但界面破坏百分率增加,0.2 mol·L-1EDC 组试件几乎全部为界面破坏。见表3 和4。

表3 各组试件即刻断裂模式Tab. 3 Immediate fracture mode of specimens in various groups [n=15,n(η/%)]

表4 各组试件老化断裂模式Tab.4 Aging fracture mode of specimens in various groups
3 讨 论
在牙本质粘接中,由于粘接树脂渗透不全,导致胶原纤维裸露,并且为了增加粘接剂渗透性,亲水性单体所占的比例增加,高浓度的亲水性单体使挥发性溶剂蒸气压降低,影响水分蒸发,残留水分影响单体聚合,聚合不全的树脂又容易发生水解,使胶原纤维进一步裸露,裸露的胶原纤维易受水、酶、细菌、温度和应力等因素的作用发生降解,最终导致树脂粘接修复的失败。自酸蚀粘接系统中的弱酸性单体形成的局部弱酸环境可激活酶原形式的MMPs,活化的MMPs 能够降解混合层的胶原纤维进而导致粘接修复失败[14]。研究[15]显示:交联剂不仅能诱导胶原纤维发生分子间或者分子内的交联反应,而且能够使MMPs 催化位点内的氨基酸之间产生多个交联,不可逆地改变催化结构域的空间构象,防止其与Ⅰ型胶原的识别和结合,从而提高粘接的耐久性。ALONSO 等[16]研究发现:用0.5 mol·L-1EDC、5%原花青素和5%戊二醛预处理脱矿根管牙本质60 s,与对照组比较,纤维桩颈1/3 粘接耐久性提高,并且抑制了蛋白水解活性。
交联剂分为天然交联剂和人工合成交联剂,碳二亚胺作为一种人工合成交联剂,由于其具有交联效果明显、生物相容性较好[17]、价格低廉和方便易得等优点,被广泛应用。EDC 为一种液态的碳二亚胺,在国外研究中常用0.3 mol·L-1EDC 水溶液预处理脱矿牙本质30 或60 s,以提高牙本质粘接强度。
本实验采用CCK-8 法测定加入含不同浓度EDC 的粘接剂浸提液后各组细胞RGR,虽然随着共培养时间或EDC 添加量增加毒性有所增强,但差异均无统计学意义,细胞RGR 均在75%以上,细胞毒性分级为1 级,均为合格,符合生物材料使用标准。生物材料应用于人体时必须有较好的生物相容性,根据以上细胞毒性结果,本研究中制备的实验性粘接剂可以进行后续实验。
评价粘接强度的测试方法主要有微拉伸、微剪切、拉伸和剪切,其中微拉伸测试方法以较小的粘接面积使应力分布均匀且断裂模式主要发生在粘接界面,能够更加真实地反映粘接效果,为最常用的牙本质粘接强度测试方法[18]。本实验采用微拉伸粘接强度测试评价粘接系统性能,在即刻微拉伸粘接强度测试中,与对照组比较,0.3 mol·L-1EDC组试件粘接强度明显降低,可能由于加入EDC 较多影响粘接剂光固化,也有可能是EDC 与粘接剂中酸性功能单体的羧酸基团发生反应使酸性减弱,牙本质脱矿深度减小,树脂渗透不足,混合层微机械固位作用减弱所致;0.1 mol·L-1EDC 组试件粘接强度明显升高,可能由于牙本质胶原在EDC 作用下交联程度增加,机械性能增强,从而粘接性能有所改善。研究[19]显示:与对照组和80%乙醇预处理组比较,0.01~0.50 mol·L-1EDC 预处理组脱矿牙本质胶原交联度和热变性温度明显升高。
模拟老化的方法有多种,目前常用的有水存老化、冷热循环老化、化学试剂浸泡和应力加载等方法[20],本实验采用冷热循环法模拟了人体口腔环境变化。国外研究[21-24]显示:用0.3 mol·L-1EDC溶液预处理脱矿的牙本质60 s,不影响即刻微拉伸粘接强度,可提高人工唾液中老化6 个月或1 年的微拉伸粘接强度,并且抑制了MMPs 活性。本研究结果显示:与即刻微拉伸粘接强度比较,冷热循环老化后各组试件粘接强度均下降,且与对照组比较,0.1 mol·L-1EDC 组试件粘接强度明显提高,0.2 mol·L-1EDC 组试件粘接强度明显降低。分析其原因:0.1 mol·L-1EDC 可能通过促进牙本质胶原使即刻粘接强度提高,同时冷热循环过程中使酶降解作用也减弱,从而使冷热循坏后试件粘接强度的 升 高 更 加 明 显;0.2 mol·L-1EDC 组 可 能 加 入EDC 较多影响粘接剂固化,试件粘接完成时即存在粘接薄弱区域,即刻粘接强度下降,经过冷热循环后,粘接剂及胶原更易发生水解和酶解,从而明显降低了冷热循环后粘接强度。
断裂模式主要分为界面破坏、混合破坏和内聚破坏(树脂和牙本质)[25],当发生界面破坏时,粘接强度取决于粘接力的大小;当发生混合破坏时,三者内聚力基本相等;当发生内聚破坏时,内聚力小于粘接力。发生界面破坏时最为理想,最能反映粘接剂的粘接强度大小。本研究中,即刻微拉伸粘接强度测试中,对照组及0.2 和0.3 mol·L-1EDC组试件均以界面断裂为主,其中0.3 mol·L-1EDC组试件几乎全部为界面断裂,而0.1 mol·L-1EDC组试件则以混合断裂为主,可能是由于0.1 mol·L-1EDC 使 试 件 粘 接 强 度 提 高 而0.2 和0.3 mol·L-1EDC 使试件粘接强度降低。当粘接力小于内聚力时,以界面断裂为主,当粘接力进一步提高时,粘接力和内聚力基本一致时,以混合断裂为主,断裂模式与粘接强度结果相一致,0.1 mol·L-1EDC 组混合断裂百分率大于对照组及0.2 和0.3 mol·L-1EDC 组。冷热循环老化后各组试件主要断裂模式并未发生明显变化,但由于粘接强度下降,因此界面断裂所占比例有所增加。
综上所述,将EDC 添加到通用型粘接剂Single Bond Universal 中 配 制 成 含 0.1~0.3 mol·L-1EDC的实验性粘接剂,均无明显细胞毒性;含0.1 mol·L-1EDC 的实验性粘接剂通过提高脱矿牙本质胶原交联程度和抑制MMPs 活性,不仅不影响即刻粘接强度,从而提高了即刻及老化微拉伸强度,并延长了树脂粘接修复的使用寿命。

