氯化两面针碱通过JAK2/STAT3 信号通路对胶质瘤细胞上皮-间质转化的抑制作用
贾茗博, 孙 莹, 王 莹, 宋燕珂, 赵丽艳
(吉林大学第二医院检验科,吉林 长春130041)
胶质瘤是最常见的原发性中枢神经系统肿瘤。尽管近年来采取外科切除、术后放疗和化疗等综合性治疗手段,但由于胶质瘤的高度侵袭性生长,患者术后肿瘤极易复发,预后较差,而上皮-间质转化(epithelial-mesenchymal transition,EMT) 被认为是胶质瘤细胞侵袭性生长的重要机制之一[1-2]。因此,探索靶向干预胶质瘤细胞EMT 是当前胶质瘤治疗的重要策略。 氯化两面针碱(nitidine chloride,NC)是一种天然植物活性生物碱,主要来源于芸香科植物两面针的根,具有镇痛、抗炎、抗疟疾、抗真菌和抗血管生成等多种生物活性[3]。研究[4-5]显示:NC 可以通过调控多种信号通路在人类恶性肿瘤中发挥作用,其中对两面神激酶2/信号转导及转录活化因子3 (Janus kinase signal transducers 2/signal transducer and activator of transcription 3,JAK2/STAT3) 信号通路的抑制作用比较突出。JAK2/STAT3 信号通路在恶性肿瘤的进展中起重要作用。NC 在多种肿瘤中均有抑制肿瘤细胞增殖和细胞发生EMT 的作用,但其对胶质瘤细胞EMT 的抑制作用及其机制目前尚未阐明。本研究探讨NC 对人胶质瘤细胞EMT 过程的抑制作用及其可能的信号机制,为胶质瘤的临床治疗提供新的线索。
1 材料与方法
1.1 细胞、主要试剂和仪器人胶质瘤U87 和LN18 细胞(美国ATCC 细胞库)。NC (美国Apexbio 公 司),转 化 生 长 因 子β1 (transforming growth factor-β1,TGF-β1)(美 国Peprotech 公司),DMEM 培养基(美国Gibco 公司),胎牛血清(fetal bovine serum,FBS)(以色列Bioind 公司),二甲基亚砜(DMSO)、青霉素和链霉素(美国Sigma 公司),E-钙黏蛋白、N-钙黏蛋白、波形蛋白、β-连环蛋白和转录因子Snail、Slug、Twist1 以及STAT3、磷酸化STAT3(p-STAT3)、JAK2、磷酸化JAK2(p-JAK2)一抗(美国Cell Signaling Technology 公司),CCK-8 试剂盒(日本Dojindo 公司)。Transwell 小室(美国Corning 公司),细胞超净工作台和细胞恒温培养箱(美国Thermo 公司),电泳仪和转膜仪(北京龙方科技公司),酶标仪(美国Bio-Rad 公司),倒置显微镜(日本Olympus公司)。
1.2 细胞培养人胶质瘤U87 和LN18 细胞采用添加10% FBS、青霉素(100 U·mL-1)和链霉素(100 mg·L-1) 的DMEM 培 养 基,在37 ℃、5%CO2培养箱中培养。每2 d 更换1 次培养基,当细胞达80%~90%融合时采用胰酶-EDTA 消化液消化,取对数生长期细胞用于实验。
1.3 CCK-8 法检测细胞存活率准备好实验所需试剂,向96 孔细胞培养板里加200 μL 培养基,调整细胞密度,保证每孔约8 000 个细胞,待细胞贴壁后,向胶质瘤U87 和LN18 细胞加入NC,使每孔NC 浓度分别为2.5、5.0、7.5、10.0、12.5、15.0、17.5 和20.0 μmol·L-1,对照组加入等体积的培养基,放入培养箱。次日取出96 孔细胞培养板,每孔加入CCK-8 试剂20 μL,放入培养箱,继续培养0.5 h。用酶标仪在波长450 nm 处测定每个孔的吸光度(A)值,细胞存活率=处理组A 值/对照组A 值×100%。
1.4 细胞分组U87 细胞分为对照组(不做处理)、EMT 组(加入10 μg·L-1TGF-β1 诱导胶质瘤U87 和LN18 细胞EMT)和不同浓度NC 组(分别采用2.5、5.0、7.5 和10.0 μmol·L-1NC 处理)。在采用STAT3 抑制剂WP1066 阻断JAK2/STAT3通路实验中,将U87 细胞分为对照组(不做处理)、EMT 组(加 入10 μ g·L-1TGF-β1 诱 导 胶 质 瘤细胞EMT) 和EMT+WP1066 处理组(加入10 μ g·L-1TGF-β1 和8 μmol·L-1WP1066)。
1.5 划痕愈合实验检测细胞迁移率U87 细胞以每孔1.5×105个细胞的密度接种于6 孔细胞培养板,在37℃、5% CO2培养箱中培养24 h。用1 mL的枪尖划出3 条横线,再划出3 条垂直线。用PBS缓冲液洗去细胞碎片后换成无血清培养基,细胞分组及处理见“1.4”,每孔中随机选出3 个视野,拍摄0 h 划痕照片。继续培养,于48 h 拍照记录,测量不同时间划痕宽度,计算细胞迁移率表示细胞迁移能力。细胞迁移率=(0 h 划痕宽度-48 h 划痕宽度)/0 h 划痕宽度×100%。实验重复3 次。
1.6 Transwell 侵袭实验检测细胞侵袭率将实验所需枪尖和离心管放在冰盒中预冷处理,稀释Matrigel 基质胶至工作浓度,每个Transwell 小室加60 μL,室温放置8 h,固化培养基。接种细胞前水化基底膜。U87 细胞以5×104个/孔的密度接种到小室内,每孔加200 μL 无血清培养基,细胞分组及处理见“1.4”。聚甲醛固定,30 min 后用0.1%结晶紫染色15 min,PBS 缓冲液清洗染料,晾干。每个样本随机选取5 个视野,显微镜拍照记录实验结果。计数每个视野的穿膜细胞数,以细胞侵袭率表示细胞的侵袭能力。细胞侵袭率=实验组穿膜细胞数/对照组穿膜细胞数×100%。
1.7 Western blotting 法检测各组细胞中EMT 相关蛋白和JAK2/STAT3 通路相关蛋白表达水平U87 细胞分组及处理见“1.4”,收集细胞提取蛋白。每孔30 μg 蛋白样品上样,SDS-PAGE 凝胶电泳分离。将蛋白转到PVDF 膜上,5%脱脂奶粉封闭2 h,PBS 缓冲液漂洗,加入相应一抗稀释液4 ℃孵育过夜。隔天加入对应的二抗,室温孵育2 h,取出后再次漂洗,配制ECL 显色液,避光待用。将PVDF 膜置于凝胶成像分析仪中采集图像加以分析,实验重复3 次。利用Image J 软件对蛋白条带灰度值进行分析,以目的蛋白条带灰度值/内参蛋白条带灰度值比值表示目的蛋白表达水平。
1.8 统计学分析采用GraphPad Prism 7.0 统计软件进行统计学分析。各组细胞迁移率、细胞侵袭率以及细胞中各种相关蛋白表达水平均以表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用LSD-t检验,实验重复3 次。以P<0.05 为差异有统计学意义。
2 结 果
2.1 各组胶质瘤U87 和LN18 细胞存活率不同浓度NC 处理U87 和LN18 细胞后各组细胞存活率均明显降低,且随着浓度的增加,其细胞存活率逐渐降低,见图1。NC 处理U87 和LN18 细胞24 和48 h 后细胞存活率均明显降低,处理48 h 后细胞存活率变化更明显,此时的半数抑制浓度(IC50)为5.0~7.5 μmol·L-1。NC 浓度小于2.5 μmol·L-1时对细胞存活率无明显影响,24 和48 h 时细胞存活率均在80%以上。因此,在后续实验中选择2.5、5.0、7.5 和10.0 μmol·L-1NC 为作用浓度,作用时间为48 h。NC 对U87 和LN18 细胞的抑制程度基本相同,故选择U87 作为实验细胞。
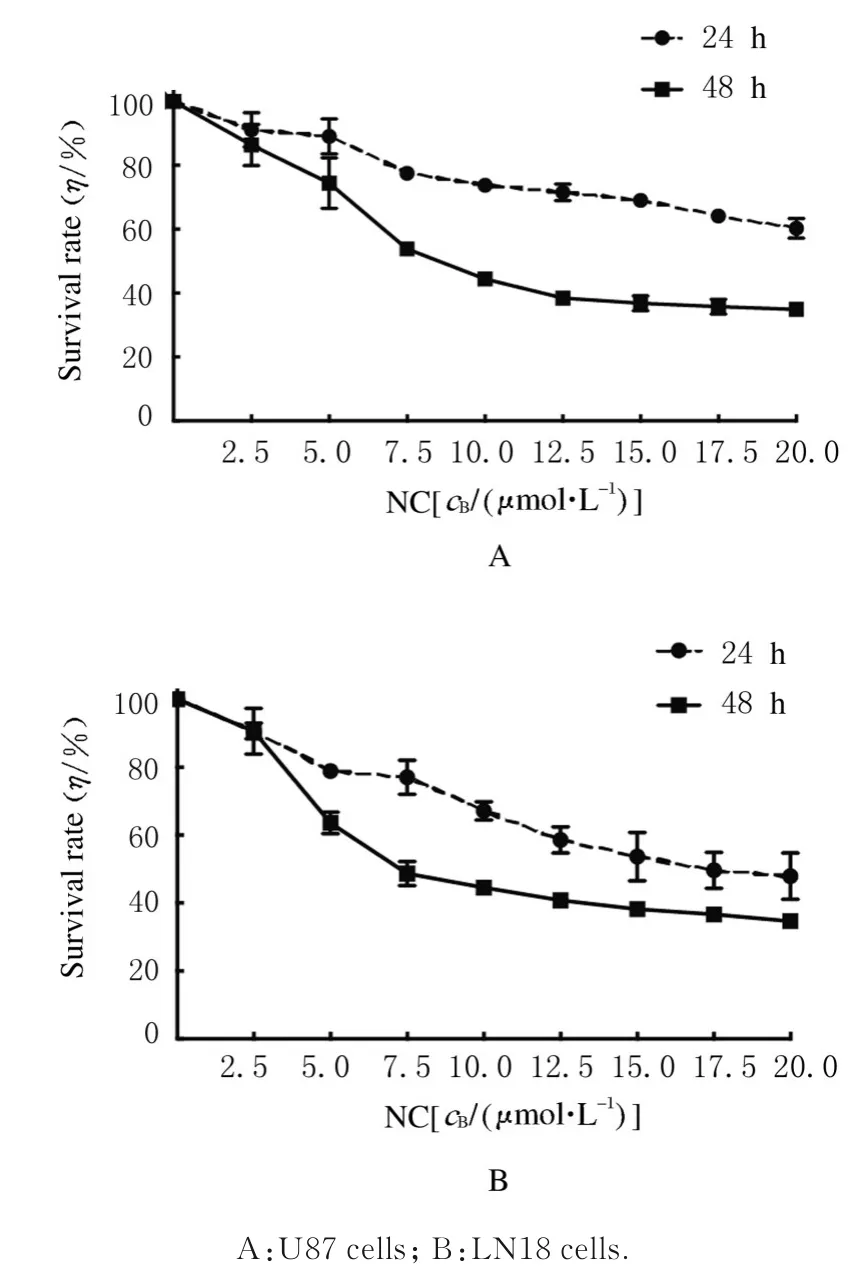
图1 不同浓度NC 处理后各组胶质瘤U87 和LN18 细胞存活率Fig.1 Survival rates of glioma U87 and LN18 cell in various groups after treated with different concentrations of NC
2.2 各组胶质瘤U87 细胞迁移率与对照组比较,EMT 组U87 细胞划痕距离明显缩小,细胞迁移率明显增加(P<0.01)。与EMT 组比较,不同浓度NC组细胞迁移率明显降低(P<0.01)。见表1和图2。
表1 各组胶质瘤U87 细胞迁移率和侵袭率Tab.1 Migration rates and invasion rates of glioma U87 cells in various groups (n=3,,η/%)

表1 各组胶质瘤U87 细胞迁移率和侵袭率Tab.1 Migration rates and invasion rates of glioma U87 cells in various groups (n=3,,η/%)
*P<0.01 vs control group ;△P<0.01 vs EMT group.
Group Control EMT NC(μmol·L-1)2.5 5.0 7.5 10.0 Migration rate 53.384±0.993 71.588±1.005*Invasion rate 100.000±0.000 150.594±7.209*86.002±7.534△72.584±8.697△30.461±2.387△9.419±1.381△19.951±2.086△18.122±1.505△12.722±1.528△13.265±0.617△
2.3 各组胶质瘤U87 细胞侵袭率与对照组比较,EMT 组细胞侵袭率明显升高(P<0.01);与EMT 组比较,不同浓度NC 组细胞侵袭率明显降低(P<0.01),且呈浓度依赖性。见表1 和图3。
2.4 各组胶质瘤U87 细胞中EMT 相关蛋白表达水平与对照组比较,EMT 组细胞中的上皮标志物E-钙黏蛋白表达水平明显降低(P<0.01),而间质标志物N-钙黏蛋白、波形蛋白和β-连环蛋白及诱导EMT 的转录因子Snail 和Twist1 蛋白表达水平明显升高(P<0.05 或P<0.01);与EMT 组比较,7.5 和10.0 μmol·L-1NC 组细胞中E-钙黏蛋白明显升高(P<0.05 或P<0.01),N-钙黏蛋白表达水平明显降低(P<0.01),5.0、7.5 和10.0 μmol·L-1NC 组细胞中β-连环蛋白、波形蛋白及2.5、5.0、7.5 和10.0 μmol·L-1NC 组细胞中转录因子Slug、Snail 和Twist1 蛋白表达水平明显降低(P<0.01),NC 对诱导EMT 后的胶质瘤U87细胞中EMT 相关蛋白的抑制作用程度呈浓度依赖性。见图4 和表2。
2.5 各组胶质瘤U87 细胞中JAK2/STAT3 信号通路相关蛋白表达水平与对照组比较,EMT 组细胞中JAK2 和p-JAK2 蛋白表达水平差异无统计学意义(P>0.05),STAT3 和p-STAT3 蛋白表达水平明显降低(P<0.05);与EMT 组比较,5.0、7.5 和10 μmol·L-1NC 组细胞中JAK2、p-JAK2 蛋白表达水平明显降低(P<0.01),2.5、 5.0、7.5 和10 μ mol·L-1NC 组 细 胞 中STAT3 和p-STAT3 蛋白表达水平明显降低(P<0.01),且呈浓度依赖性。见图5 和表3。

图2 各组胶质瘤U87 细胞划痕愈合实验结果(×200)Fig.2 Results of scratch assay of glioma U87 cells in various groups (×200)
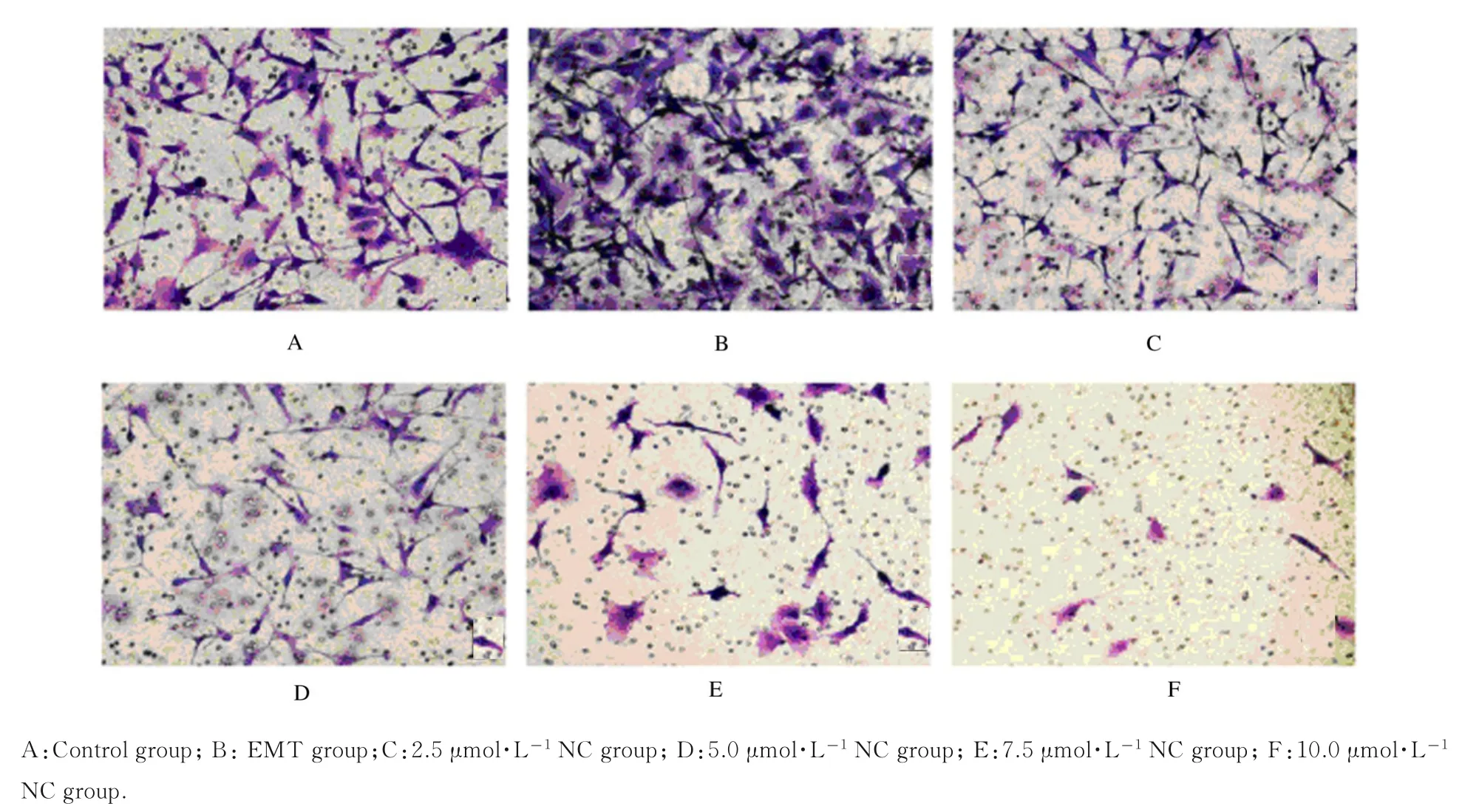
图3 各组胶质瘤U87 细胞Transwell 侵袭实验结果(×200)Fig.3 Results of Transwell invasion test of glioma U87 cells in various groups(×200)
2.6 STAT3 抑制剂WP1066 阻断JAK2/STAT3通路实验中各组胶质瘤U87 细胞中EMT 相关蛋白表达水平与对照组比较,EMT 组细胞中E-钙黏蛋白表达水平明显降低(P<0.01),N-钙黏蛋白、波形蛋白、β-连环蛋白及转录因子Twist1、Slug 和Snail 蛋白表达水平明显升高(P<0.01);与EMT组比较,EMT+WP1066 组细胞中E-钙黏蛋白表达水平明显升高(P<0.01),N-钙黏蛋白、波形蛋白、β-连环蛋白及转录因子Slug、Snail 和Twist1 蛋白表达水平明显降低(P<0.01),提示阻断JAK2/STAT3 信号通路可以抑制胶质瘤EMT。见图6 和表4。
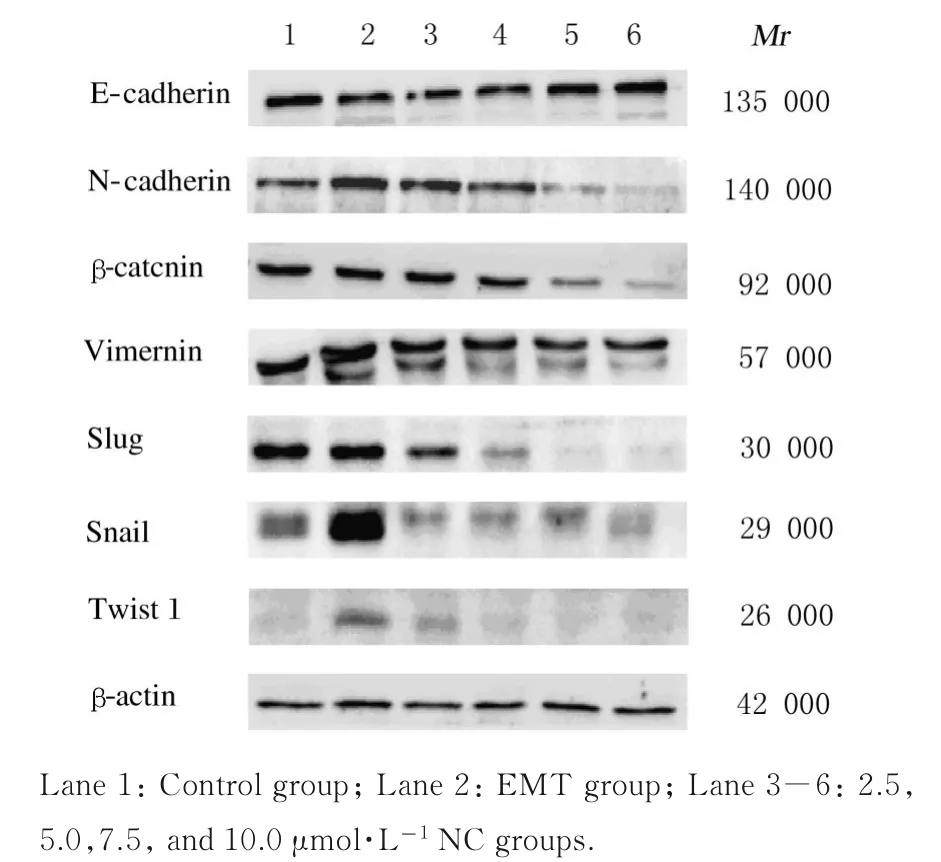
图4 各组胶质瘤U87 细胞中EMT 相关蛋白表达电泳图Fig.4 Electrophoregram of expressions of EMTrelated proteins in glioma U87 cells in various groups
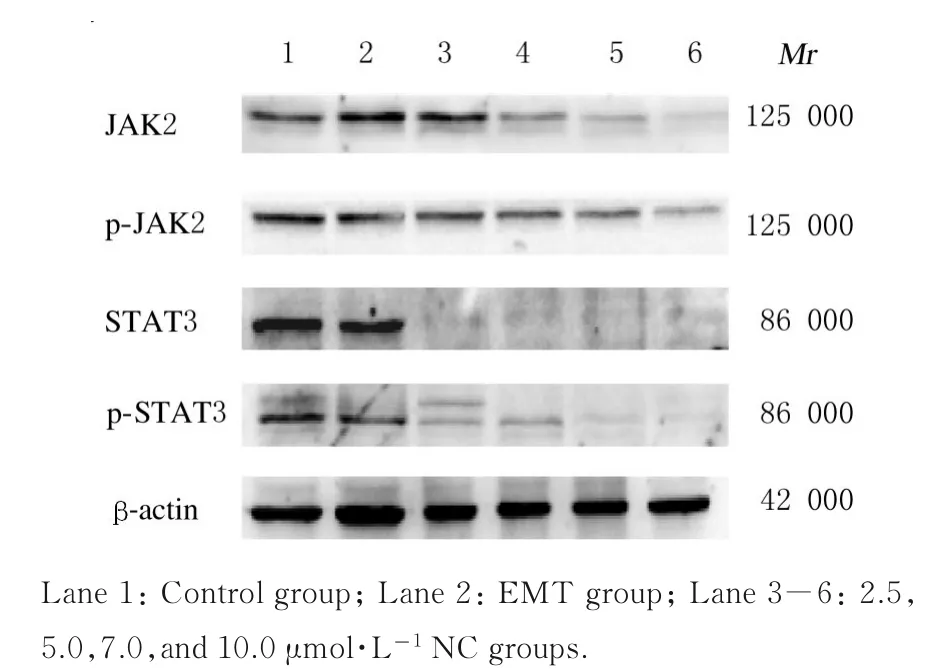
图5 各组胶质瘤U87 细胞中JAK2、p-JAK2、STAT3和p-STAT3 蛋白表达电泳图Fig.5 Electrophoregram of expressions of JAK2,p-JAK2, STAT3 and p-STAT3 proteins in glioma U87 cells in various groups
表2 各组胶质瘤U87 细胞中EMT 相关蛋白表达水平Tab.2 Expression levels of EMT-related proteins in glioma U87 cells in various groups (n=3,)
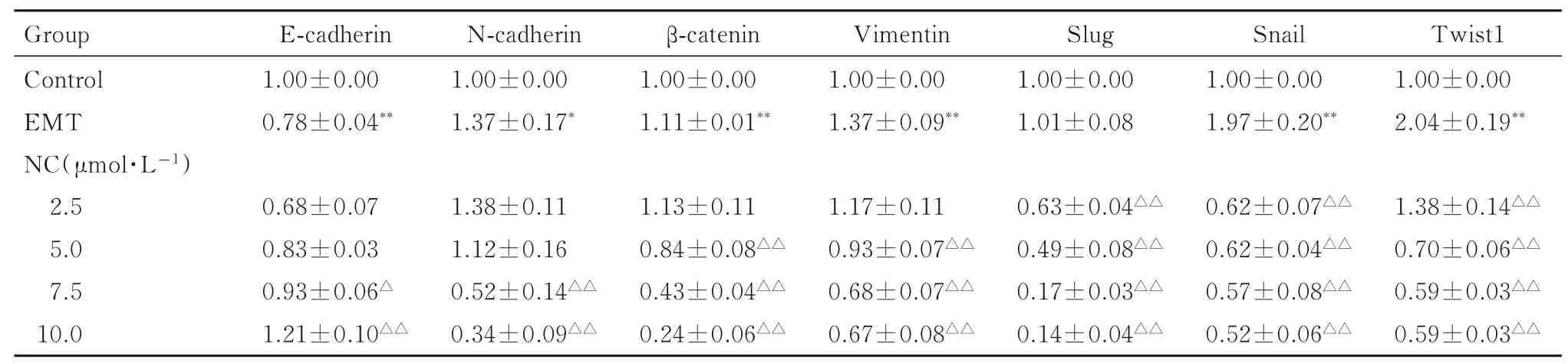
表2 各组胶质瘤U87 细胞中EMT 相关蛋白表达水平Tab.2 Expression levels of EMT-related proteins in glioma U87 cells in various groups (n=3,)
*P<0.05,**P<0.01 vs control group;△P<0.05,△△P<0.01 vs EMT group.
Group Control EMT NC(μmol·L-1)2.5 5.0 7.5 10.0 E-cadherin 1.00±0.00 0.78±0.04**N-cadherin 1.00±0.00 1.37±0.17*β-catenin 1.00±0.00 1.11±0.01**Vimentin 1.00±0.00 1.37±0.09**Slug 1.00±0.00 1.01±0.08 Snail 1.00±0.00 1.97±0.20**Twist1 1.00±0.00 2.04±0.19**1.38±0.14△△0.70±0.06△△0.59±0.03△△0.59±0.03△△0.68±0.07 0.83±0.03 0.93±0.06△1.21±0.10△△1.38±0.11 1.12±0.16 0.52±0.14△△0.34±0.09△△1.13±0.11 0.84±0.08△△0.43±0.04△△0.24±0.06△△1.17±0.11 0.93±0.07△△0.68±0.07△△0.67±0.08△△0.63±0.04△△0.49±0.08△△0.17±0.03△△0.14±0.04△△0.62±0.07△△0.62±0.04△△0.57±0.08△△0.52±0.06△△
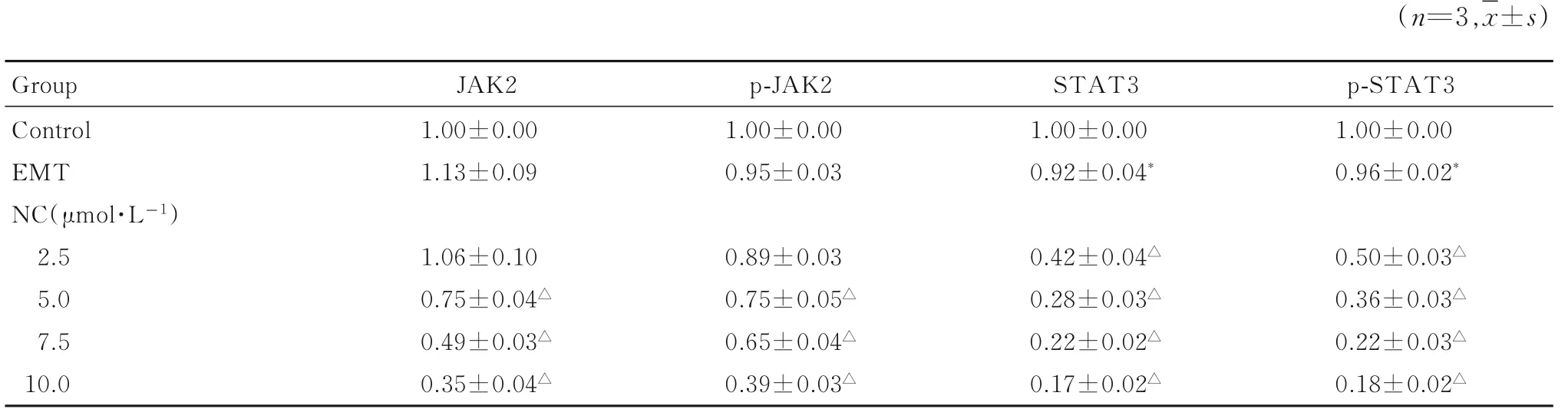
表3 各组胶质瘤U87 细胞中JAK2、p-JAK2、STAT3 和p-STAT3 蛋白表达水平Tab.3 Expression levels of JAK2, p-JAK2, STAT3 and p-STAT3 proteins in glioma U87 cells in various groups
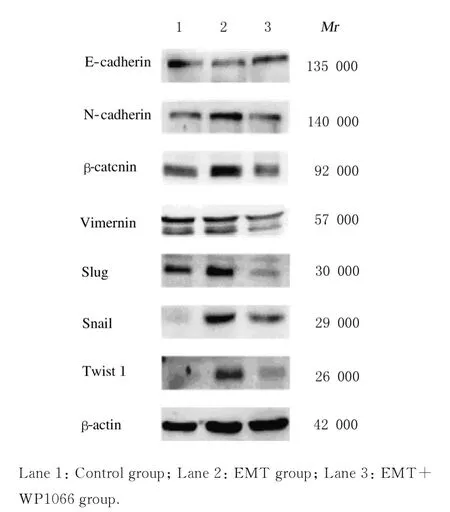
图6 WP1066 处理后各组胶质瘤U87 细胞中EMT 相关蛋白表达电泳图Fig.6 Electrophorgram of expressions of EMT-related proteins in glioma U87 cells after treated with WP1066
3 讨 论
已有研究[6-9]证明:NC 对肝癌、前列腺癌、卵巢癌和食管癌等多种肿瘤均有抑制作用。本研究首先检测了NC 对胶质瘤细胞增殖活性的影响,结果显示:NC 在体外可明显降低胶质瘤U87 和LN18 细胞存活率,且呈浓度依赖性。
胶质瘤的重要特征是高度侵袭性生长,从而使肿瘤不断生长并侵犯周围的正常脑组织,造成胶质瘤手术治疗难以彻底切除和易复发性[10]。最近的研究[11-12]表明:胶质瘤的高度侵袭性生长可能与细胞的EMT 过程有关,遏制胶质瘤细胞的EMT有望成为治愈肿瘤的有效手段。EMT 是一个复杂的生物过程,通过此过程,上皮细胞失去极性和细胞黏附,获得间质细胞的运动性和侵袭性,与肿瘤的进展、侵袭及转移有关[13]。同时,EMT 与肿瘤的复发和化疗耐药性有密切关联[14-15]。EMT 的最主要特征是上皮标志物E-钙黏蛋白表达下调,间质标志物N-钙黏蛋白、波形蛋白和β-连环蛋白以及 转 录 因 子Snail、Slug 和Twist1 表 达 上 调[13]。EMT 的调控涉及很多因素,包括转化生长因子、表皮生长因子、成纤维细胞生长因子、Wnt 信号通路和Notch 信号通路等[13]。研究[16-17]表明:NC 可以通过调控不同的信号通路抑制多种肿瘤的EMT过程。但NC 对胶质瘤细胞EMT 的抑制作用及其机制目前尚未阐明。本研究结果表明:在胶质瘤细胞EMT 时,NC 以浓度依赖的方式增加上皮标志物E-钙黏蛋白的表达,并降低间质标志物N-钙黏蛋白、波形蛋白和β-连环蛋白以及转录因子Slug、Snail 和Twist1 的表达;通过划痕愈合实验和Transwell 侵袭实验,证明NC 能有效抑制胶质瘤细胞的迁移和侵袭,揭示了NC 的抗转移活性。说明NC 能够抑制胶质瘤细胞的EMT 及其引起的细胞迁移和侵袭能力增强,从而延缓胶质瘤的进展。
JAK2/STAT3 信号通路参与细胞内许多重要的生物学过程,包括细胞增殖、迁移和侵袭以及免疫调节[5,18]。JAK2 激活会导致STAT3 的磷酸化,STAT3 与EMT 相关标志物的关系密切。在乳腺癌中,STAT3/Twist 通路参与CD146 介导的E-钙黏蛋白表达的抑制[19]。在大肠癌中,STAT3 的过表达可明显降低E-钙黏蛋白的表达并增加N-钙黏蛋白和波形蛋白的表达,STAT3 可能直接介导EMT 进程[20]。研究[21]表明:JAK2/STAT3 信号通路在肿瘤EMT 过程中发挥重要作用,上调JAK2/STAT3 通路活性可调控细胞的EMT 过程,在宫颈癌的转移和侵袭中起关键作用。在口腔鳞状细胞癌中,CC 趋化因子配体21(CCL21)/CC 趋化因子受体7 (CCR7) 轴可通过激活JAK2/STAT3 信 号 通 路 调 节EMT 进 程[22]。癌 相 关 成 纤维细胞可以通过JAK2/STAT3 信号通路分泌IL-6并促进TGF-β 介导的EMT,从而促进卵巢癌细胞的增殖和侵袭[23]。NC 可 影 响JAK2/STAT3 信 号通路,在胃癌中,NC 可以通过抑制STAT3 DNA结合活性和JAK2/STAT3 信号通路进而抑制肿瘤的血管生成和肿瘤生长[24]。
表4 WP1066 处理后各组胶质瘤U87 细胞中EMT 相关蛋白表达水平Tab.4 Expression levels of EMT-related proteins in glioma U87 cells in various groups after treated with WP1066(n=3,)
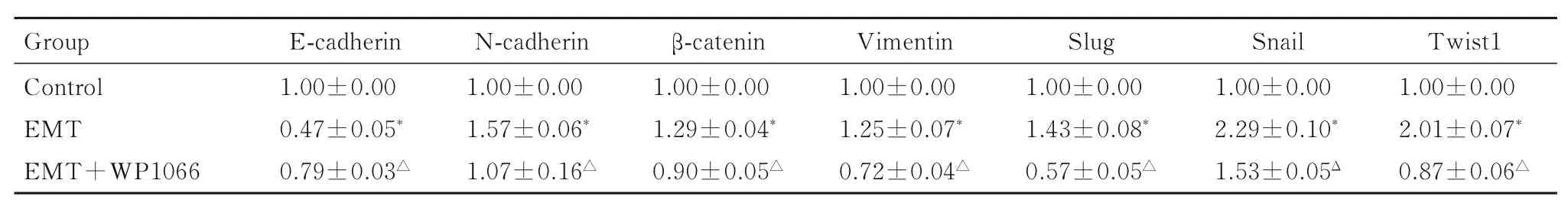
表4 WP1066 处理后各组胶质瘤U87 细胞中EMT 相关蛋白表达水平Tab.4 Expression levels of EMT-related proteins in glioma U87 cells in various groups after treated with WP1066(n=3,)
*P<0.01 vs control group;△P<0.01 vs EMT group.
Group Control EMT EMT+WP1066 Twist1 1.00±0.00 2.01±0.07*0.87±0.06△E-cadherin 1.00±0.00 0.47±0.05*0.79±0.03△N-cadherin 1.00±0.00 1.57±0.06*1.07±0.16△β-catenin 1.00±0.00 1.29±0.04*0.90±0.05△Vimentin 1.00±0.00 1.25±0.07*0.72±0.04△Slug 1.00±0.00 1.43±0.08*0.57±0.05△Snail 1.00±0.00 2.29±0.10*1.53±0.05Δ
为了进一步阐明NC 抑制胶质瘤细胞EMT 的机制,本研究通过Western blotting 法检测了胶质瘤细胞中JAK2/STAT3 通路蛋白表达水平,结果显示:采用NC 处理后,JAK2、p-JAK2、STAT3 和p-STAT3 蛋白表达水平降低,且呈浓度依赖性。为了确认JAK2/STAT3 信号通路参与NC 抑制的胶质瘤细胞EMT,应用STAT3 抑制剂WP1066 抑制STAT3 活性来阻断JAK2/STAT3 信号通路,结果表明:阻断JAK2/STAT3 信号通路可明显逆转EMT 诱导的重要标志物E-钙黏蛋白、N-钙黏蛋白、波形蛋白和β-连环蛋白以及转录因子Slug、Snail 和Twist1 的表达。本研究结果进一步证明:JAK2/STAT3 信号通路对于EMT 是必不可少的,而NC 抑制胶质瘤细胞EMT 的作用可能是通过影响JAK2/STAT3 信号通路实现的。
综上所述,NC 通过JAK2/STAT3 信号通路抑制胶质瘤细胞的EMT 过程,并减弱细胞的迁移和侵袭能力。但将NC 应用于胶质瘤的临床治疗还需进行更多和更深入的研究。

