ProGRP、NSE、CEA、CYFRA21-1、SCC单独及联合检测在肺癌鉴别诊断中的价值 *
王茜,夏睿,董惠霞,严虹
(南京医科大学附属脑科医院胸科院区检验科,南京210029)
检测肺癌相关的血清肿瘤标志物被认为是肺癌早发现、早治疗的高效、经济的手段之一[1]。研究表明,胃泌素释放肽前体(pro-gastrin-releasing peptide,ProGRP)与神经元特异性烯醇化酶(neuron-specific enolase,NSE)联合检测用于小细胞肺癌(small-cell lung cancer,SCLC)与非小细胞肺癌(non-small-cell lung cancer,NSCLC)鉴别诊断[2]。与NSE相比,ProGRP对SCLC患者的诊断敏感性和特异性更高(ProGRP和NSE的cut-off值分别为66 ng/L和18 μg/L时,敏感性分别为86.5%和78.8%,特异性分别为96.5%和86.3%)[3]。癌胚抗原(carcinoembryonic antigen,CEA)、血清细胞角蛋白19片段(cytokeratin-19-fragment,CYFRA21-1)和鳞状上皮细胞癌抗原(squamous cell carcinoma antigen,SCC)在非小细胞肺癌患者血清中的表达水平明显升高,三者联合检测的敏感性和特异性分别为86.46%和88.42%,优于各单项检测[4]。由于目前的单项肿瘤标志物的诊断敏感性和特异性无法满足临床要求,临床上更倾向于多种肿瘤标志物联合检测,以提高肺癌诊断的敏感性和特异性。中华医学会肺癌临床诊疗指南(2019版)[5]将ProGRP、NSE、CEA、CYFRA21-1、SCC等推荐为常用的肺癌标志物。故本研究选择指南推荐的5种肿瘤标志物,分别检测肺癌患者和肺良性疾病患者血清中上述5种肿瘤标志物的表达水平,并分析该5种肿瘤标志物单独及联合检测在肺癌鉴别诊断中的价值。
1 材料与方法
1.1研究对象 选取2016年12月至2018年5月于南京医科大学附属脑科医院呼吸科就诊的肺癌患者237例,男191例,女46例,年龄24~90岁,中位年龄64岁,均按照中华医学会肺癌临床诊疗指南(2019版)[5]及病理组织学明确诊断。其中SCLC患者106例,NSCLC患者131例。排除标准:(1)病历资料不完整者;(2)无明确的病理组织学、细胞学诊断,或合并其他系统肿瘤、有其他系统肿瘤史或有其他系统肿瘤转移所致肺癌患者;(3)肝、肾功能严重异常或患有血液系统疾病患者。选取同期住院的肺部良性疾病患者(benign lung disease,BLD)95例为肺良性疾病组,男61例,女32例,年龄24~87岁,中位年龄68岁,主要包括慢性阻塞性肺炎45例,支气管扩张25例,肺炎12例,支气管炎8例,支气管哮喘3例,矽肺2例。
1.2仪器与试剂 血清ProGRP、NSE、CEA、CYFRA21-1检测试剂盒及Cobas E601电化学发光全自动免疫分析仪均购自美国Roche公司,血清SCC检测试剂盒及MAGLUMI 1000全自动化学发光免疫分析仪均购自深圳新产业生物医学工程公司。
1.3标本采集 患者在入院后次日清晨空腹状态下使用非抗凝真空采血管采集静脉血5 mL,2 894×g离心5 min,分离血清,置于-20 ℃保存。
1.4血清学指标检测 血清ProGRP、NSE、CEA、CYFRA21-1检测采用电化学发光法,按照ProGRP、NSE、CEA、CYFRA21-1检测试剂盒及Cobas E601电化学发光全自动免疫分析仪说明书检测。ProGRP参考范围:28.3~65.7 pg/mL,NSE参考范围:0~20 ng/mL,CEA参考范围:0~8 ng/mL,CYFRA21-1参考范围:0~3.3 ng/mL。血清SCC检测采用化学发光法,按照SCC检测试剂盒及MAGLUMI 1000全自动化学发光免疫分析仪说明书检测。SCC参考范围:0~2.5 ng/mL。
1.5统计学分析 采用SPSS 24.0统计软件进行分析。对数据进行正态性和方差齐性分析,计量资料不符合正态分布,以中位数(四分位数)[M(P25,P75)]表示,2组间比较采用Mann-WhitneyU检验。采用Logistic回归和ROC曲线分析5种肿瘤标志物单项及联合检测对肺癌与肺良性疾病鉴别诊断的价值。以P<0.05为差异具有统计学意义。
2 结果
2.12组患者5种血清肿瘤标志物检测结果比较 除SCC外,肺癌组血清ProGRP、NSE、CEA和CYFRA21-1的表达水平均显著高于肺良性疾病组,差异有统计学意义(P<0.05),见表1。
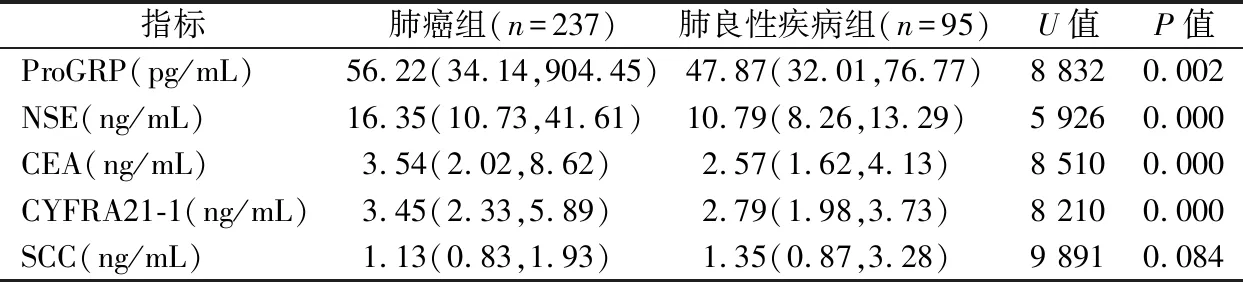
表1 2组患者5种血清肿瘤标志物检测结果比较[M(P25,P75)]
2.2ROC曲线评估5种肿瘤标志物在肺癌与肺良性疾病鉴别诊断中的价值 以肺癌患者作为疾病组,肺良性疾病患者作为对照组,绘制ROC曲线并评估5种肿瘤标志物单独及联合检测对肺癌鉴别诊断价值。血清ProGRP、NSE、CEA、CYFRA21-1及SCC的ROC曲线下面积(AUCROC)分别为0.608(95%CI:0.547~0.668)、0.737(95%CI:0.683~0.791)、0.622(95%CI:0.56~0.684)、0.635(95%CI:0.573~0.697)和0.439(95%CI:0.369~0.509)。5种血清肿瘤标志物联合检测鉴别肺癌的AUCROC为0.779(95%CI:0.727~0.831)。见图1。
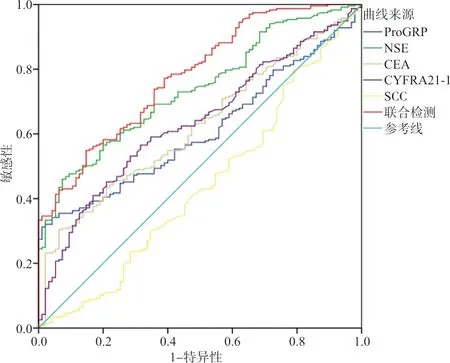
图1 ProGRP、NSE、CEA、CYFRA21-1、SCC单独及联合检测对肺癌鉴别诊断的ROC曲线
2.35种指标联合检测的二元Logistic回归分析 通过二元Logistic回归分析5种肿瘤标志物与诊断肺癌的相关程度,结果见表2。得到Logistic回归模型为ln[p/(1-p)]=0.02×CEA+0.024×SCC-0.02×ProGRP-0.048×NSE-0.055×CYFRA21-1-0.376。

表2 5种肿瘤标志物的Logistic回归分析
经上述Logistic回归模型计算出每个样本的P值,得到的预测概率的AUCROC为0.779(95%CI:0.727~0.831),cut-off值为70.9%。根据各标志物的cut-off值分析各指标单独与联合检测的敏感性与特异性等指标,结果显示ProGRP检测的特异性最高(98.9%),SCC检测的敏感性最高(94.9%),而联合检测的准确性最高。见表3。
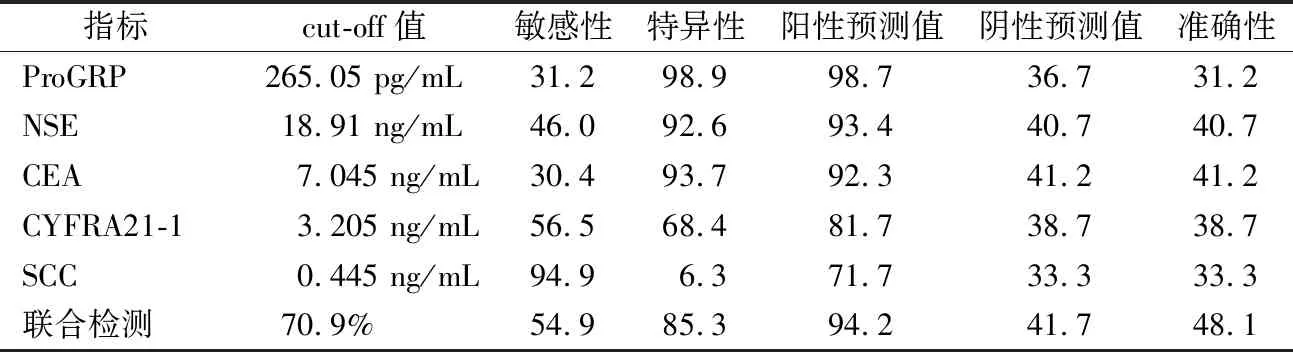
表3 5种肿瘤标志物对肺癌与肺良性疾病鉴别诊断效能(%)
3 讨论
既往研究发现肺癌患者血清ProGRP、NSE、CEA、CYFRA21-1、SCC水平升高,且明显高于肺良性疾病患者,说明单项检测对肺癌的鉴别诊断有一定的临床价值[6]。本研究中肺癌组血清ProGRP、NSE、CEA、CYFRA21-1的表达水平升高且明显高于肺良性疾病组,差异具有统计学意义(P<0.05),但血清SCC水平在肺癌与肺良性疾病间的差异无统计学意义(P>0.05)。分析原因可能为本研究与其他纳入的研究对象不完全相同,不同分类的肺良性疾病患者血清SCC水平存在一定的差异,升高最明显的是肺炎患者,其血清SCC水平为3.7(1.42~4.23) ng/mL[7]。本研究纳入的肺良性疾病组(95例)中慢性阻塞性肺炎和肺炎患者占60%(慢性阻塞性肺炎45例,肺炎12例),当肺部的气管和支气管发生感染产生炎症反应时,支气管鳞状上皮细胞应激后会释放大量SCC,从而使血清SCC水平升高。
本研究进一步分析5种肿瘤标志物鉴别诊断肺癌的效能,结果发现,ProGRP、NSE、CEA、CYFRA21-1的特异性均在60%以上,而敏感性则较低,SCC敏感性达94.9%,但特异性则不高。说明单项肿瘤标志物不能完全代表肿瘤的特征,临床上对肺癌仅依靠单项肿瘤标志物的变化进行诊断的价值有限,仍需密切结合临床症状及其他辅助检查结果,否则会造成部分患者的漏诊。本研究进一步证实,联合检测的准确性最高,敏感性(54.9%)和特异性(85.3%)也处于较高水平,与既往研究结果基本类似[9]。本研究中5种肿瘤标志物联合检测的AUCROC为0.779,均高于各单项肿瘤指标,表明多种肿瘤标志物联合检测可以做到相互补充,避免肺癌的漏诊和误诊。
本研究存在一定的局限性:纳入的研究对象例数偏少;缺少健康人群作为对照组,未分析5种血清肿瘤标志物在健康人群中诊断肺癌的价值。此外,本研究仅分析了5种血清肿瘤标志物对肺癌与良性疾病鉴别诊断的价值,未能进一步对肺癌的不同病理类型进行鉴别诊断以及对不同分期进行预后评估。综上所述,5种肿瘤标志物单独检测在肺癌鉴别诊断的敏感性与特异性各有所长。但联合检测可以更好地兼顾两者,对肺癌的鉴别诊断则更具临床意义。

