miR-145、miR-146a在慢性阻塞性肺疾病合并冠心病患者血清中的表达及临床意义
赵盼盼,侯梦一
(重庆两江新区第一人民医院医学检验科,重庆 401120)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)在中老年人群中的发病率及病死率居高不下。由于肺功能水平降低、炎症及氧化应激反应增加等因素影响,COPD患者发生心血管疾病的风险明显增加[1],其中以COPD并发冠心病(coronary artery heart disease,CHD)较为常见。探究COPD并发CHD进展过程中相关因子,对改善患者预后具有重要意义。研究表明,miR-145、miR-146a在COPD患者血清中的表达水平明显降低,且与患者病情严重程度、炎症反应增加有关[2-3]。此外,miR-145被证实可通过靶向调控血管平滑肌细胞,参与胸主动脉夹层发病[4]。而miR-146a作为炎症的负调控因子,其表达下调可通过影响中性粒细胞胞外陷阱生成,影响房颤患者不良心血管事件的发生[5]。因此,本研究通过检测COPD合并CHD患者血清miR-145、miR-146a的表达水平,分析二者在COPD合并CHD发生、发展中的作用及意义。
1 资料与方法
1.1研究对象 收集2014年12月至2019年12月于重庆两江新区第一人民医院就诊的COPD稳定期患者96例,男性54例,女性42例,年龄(65.94±12.86)岁,其中以COPD稳定期合并CHD患者38例作为COPD+CHD组,男性23例,女性15例,年龄(66.27±13.05)岁;以COPD稳定期未合并CHD患者58例作为COPD组,男性31例,女性27例,年龄(65.78±13.24)岁。纳入标准:(1)根据《COPD诊治指南》[6]及WHO中冠心病诊断标准[7],经冠脉造影检查确诊为COPD或COPD合并CHD;(2)临床资料完整;(3)能够积极配合检查。排除标准:(1)合并其他呼吸系统疾病;(2)合并患有糖尿病、脑血管疾病、肾病、免疫性疾病者;(3)患有严重精神疾病者;(4)肝肾功能严重不足者。另选取同期体检健康者45例作为健康人对照组,男性25例,女性20例,年龄(64.08±12.15)岁。本研究经重庆两江新区第一人民医院医学伦理委员会审核批准(No.1492802),患者或家属知情同意。
1.2样本采集及一般资料收集 入组患者于入组后第2天清晨空腹采集外周静脉血5 mL(健康人对照组于体检时清晨采集),4 ℃、1 348.7×g离心15 min后分离上清液,置于-80 ℃保存。采集所有入组者性别、年龄、身体质量指数(body mass index,BMI)、吸烟史等一般资料,收集COPD+CHD组患者资料并进行Gensini评分[8]。
1.3主要仪器及试剂 FX-7000心电图仪(北京福田电子医疗仪器公司),XE-2100血细胞计数仪、CA-1500全自动凝血仪(日本希森美康公司),ADVIA 2400全自动生化分析仪、Siemens-Bayer BNP蛋白仪(德国西门子公司),Genesy 40/50紫外分光光度计(美国赛默飞世尔公司),7500实时荧光定量PCR(qRT-PCR)仪(美国应用生物系统公司),Master Screen全自动肺检测功能仪(德国Jager公司),Cobas B血气分析仪(德国Roche公司)。C反应蛋白(CRP)测定试剂盒(德国凯杰公司),纤维蛋白原测定试剂盒(武汉纯度生物科技公司),RNA提取试剂盒(德国Roche公司),反转录试剂盒(德国凯杰公司),qRT-PCR试剂盒(日本宝生物公司)。
1.4血常规及生化指标的检测 采用血细胞计数仪及白细胞分类溶血剂、血红蛋白溶血剂、白细胞分类染色液等试剂检测白细胞计数[参考范围:(4.0~10.0)×109/L]、血小板计数[参考范围:(100~300)×109/L];采用全自动生化分析仪及配套试剂检测高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)(参考范围:0.90~1.90 mmol/L)、低密度脂蛋白胆固醇(low density lipoprotein,LDL-C)(参考范围:0~3.4 mmol/L)、三酰甘油(triglyceride,TG)(参考范围:0.56~1.70 mmol/L)、总胆固醇(total cholesterol,TC)(参考范围:2.80~6.50 mmol/L);采用免疫比浊法,使用BNP蛋白仪及相应试剂检测C反应蛋白(C-reactive protein,CRP)(参考范围:0~5 mg/L);采用冯·克劳斯法(Von Clauss法),使用全自动凝血仪及相应试剂检测纤维蛋白原(参考范围:2~4 g/L)。
1.5qRT-PCR检测血清miR-145、miR-146a表达水平 根据NCBI中miR-145、miR-146a的基因序列(ID:406937和406938),用Primer Premier 5.0软件进行引物设计,并送北京天根生化科技公司进行引物合成。miR-145上游引物序列:5′-CCTAGCTAGGCGTGGCTCCC-3′,下游引物序列:5′-ACAGCCTAGGCTAAGATACA-3′,产物片段大小173 bp,退火温度为60 ℃;miR-146a上游引物序列:5′-GCAGGCTGGCATGGCTGCCA-3′,下游引物序列:5′-TCTGCAGGCTGGCATGGAAT-3′,产物片段大小186 bp,退火温度为60 ℃;U6上游引物序列:5′-AACGTAACGTGCGGCATCGT-3′,下游引物序列:5′-GCTCCTCTAACGTCAAATGT-3′,产物片段大小218 bp,退火温度为60 ℃。
按照RNA提取试剂盒说明书提取RNA,使用Genesy 40/50紫外分光光度计检测其浓度及纯度,取吸光度(A280/260 nm)值为1.8~2.0的样本进行逆转录反应。按照反转录试剂盒说明书将RNA逆转录为cDNA,样本置于-20 ℃保存。qRT-PCR 反应体系为20 μL,包括:SYBR®Primix Ex TaqTM(2×)10 μL,ROX(50×) 0.4 μL,10 μmol/L上、下游引物各2 μL,50 ng/μL cDNA 2 μL,无酶ddH2O 3.6 μL。循环参数:95 ℃ 10 min;95 ℃ 15 s,62 ℃ 40 s,73 ℃ 15 s,共40个循环;在60 ℃时收集荧光信号并使用Bio-Rad CFX manager软件进行熔解曲线分析。实验设3个复孔。以U6为内参基因,采用2-△△Ct法计算miR-145、miR-146a相对表达水平,△△Ct=(实验组Ct目的基因-实验组Ct内参基因)-(健康人对照组Ct目的基因-健康人对照组Ct内参基因)。
1.6肺功能及血气指标检测 使用全自动肺检测功能仪检测受试者肺功能指标一秒量(forced expired volume,FEV1)(参考范围:>4.26 L)、用力肺活量(forced vital capacity,FVC)(参考范围:>4.13 L)及一秒率(forced vital capacity rate of one second,FEV1/FVC)(参考范围:>70%);使用血气分析仪检测受试者血气指标pH(参考范围:7.35~7.45)、动脉血二氧化碳分压(partial pressure of gases from blood gas tension,PaCO2)(参考范围:35~45 mmHg)、血氧分压(partial pressure of oxygen,PaO2)(参考范围:75~100 mmHg)。

2 结果
2.13组一般资料比较结果 健康人对照组、COPD组、COPD+CHD组性别、吸烟比例、年龄、BMI、心率、白细胞计数、血小板计数、HDL-C水平、LDL-C水平比较,差异无统计学意义(P>0.05);COPD组、COPD+CHD组患有高血压比例比较,差异无统计学意义(P>0.05)。健康人对照组、COPD组、COPD+CHD组TG、TC、CRP、纤维蛋白原水平依次升高(P<0.05)。见表1。

表1 3组一般资料比较
2.23组血清miR-145、miR-146a的表达水平比较 健康人对照组、COPD组、COPD+CHD组血清miR-145、miR-146a的表达水平均显著降低(P<0.05),且COPD+CHD组血清miR-145、miR-146a表达水平明显低于COPD组患者(P<0.05)。见表2。
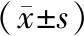
表2 3组血清miR-145、miR-146a表达水平比较
2.33组肺功能、血气指标比较结果 与健康人对照组比较,COPD组、COPD+CHD组肺功能指标FEV1、FEV1/FVC及血气指标pH、PaO2水平均显著降低,血气指标PaCO2水平均显著升高(P<0.05);COPD+CHD组患者肺功能指标FEV1、FEV1%预计值、FEV1/FVC及血气指标pH、PaO2水平明显低于COPD组,血气指标PaCO2水平明显高于COPD组(P<0.05)。见表3。

表3 3组肺功能指标、血气指标比较
2.4血清miR-145、miR-146a表达水平与临床指标相关性分析 COPD+CHD组患者血清miR-145、miR-146a水平分别与CRP水平、纤维蛋白原水平及Gensini评分呈负相关(P<0.05),而与肺功能指标FEV1/FVC、血气指标PaO2水平呈正相关(P<0.05)。见表4。
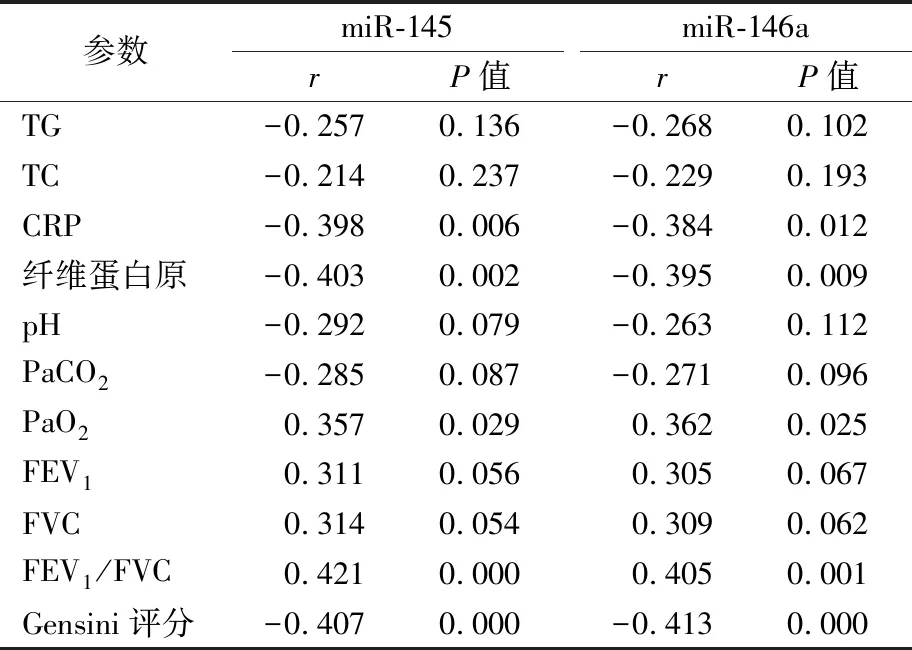
表4 血清miR-145、miR-146a表达水平与临床指标相关性
2.5COPD合并CHD发生危险因素分析 以本研究资料为样本,以COPD合并CHD是否发生为因变量(发生=1,未发生=0),以表2~4中各组差异有统计学意义的指标/因子为自变量,建立Logistic回归模型。结果如表5所示,高CRP水平、低PaO2水平、低FEV1/FVC水平、高Gensini评分、低miR-145水平、低miR-146a水平是影响COPD并发CHD的独立危险因素(P<0.05)。
表5 COPD合并CHD发生危险因素分析
2.6血清miR-145、miR-146a表达水平对COPD患者并发CHD的诊断价值 以COPD合并CHD患者作为疾病组,COPD组患者作为对照组,当cut-off值为0.61时,血清miR-145水平对COPD患者并发CHD诊断的曲线下面积(AUCROC)为0.753(95%CI:0.654~0.835),敏感性和特异性分别为60.89%、84.48%;当cut-off值为0.65时,血清miR-146a水平对COPD患者并发CHD诊断的AUCROC为0.717(95%CI:0.616~0.804),敏感性和特异性分别为63.16%、82.76%。血清miR-145、miR-146a联合诊断COPD合并CHD的AUCROC为0.887(95%CI:0.821~9.520),明显高于miR-145、miR-146a单独诊断(Z/P值分别为2.280/0.023、2.473/0.012),且二者联合诊断的敏感性也为最高(89.47%),但特异性为79.31%,相对二者单独检测时降低。见图1。

图1 血清miR-145、miR-146a表达水平对COPD患者并发CHD的诊断价值的ROC曲线分析
3 讨论
炎症反应和内皮损伤在COPD及CHD发生发展中均起重要作用[4-5]。Dang等[9]在miR-145参与吸烟所致的COPD机制研究中发现,COPD患者肺组织中miR-145表达水平在0~2之间,而未患有COPD者肺组织中miR-145表达水平明显高于COPD患者。本研究中,COPD组血清miR-145表达水平明显低于健康人对照组,与Dang等[9]研究报道的miR-145表达水平相比明显较低,分析原因可能与所选取研究对象不同有关,但也能在一定程度上表明miR-145表达下调可能与COPD发生有关,miR-145下调可能通过靶向调控缺氧诱导的肺动脉平滑肌细胞增殖和迁移,影响气道上皮细胞凋亡和炎症反应增加,参与了COPD进展。急性冠状动脉综合征患者血清中miR-145表达下调预示内皮损伤和炎症反应水平,可作为该疾病潜在的标志物[10]。本研究结果显示,COPD+CHD组血清miR-145表达水平明显低于COPD组患者,提示miR-145可能在调节心肌细胞增殖和心血管疾病进展中发挥重要作用。miR-145低表达可能通过反映血管内皮损伤和炎症反应加重,预示COPD患者并发CHD。
Kivihall等[11]在miR-146与哮喘发病机制关系的研究中指出,哮喘患者支气管灌洗液中miR-146a表达水平低于1,与对照组相比明显降低,且与中性粒细胞计数增加存在相关性(r2=0.149,P=0.035)。本研究结果显示,与健康人对照组相比,COPD组患者血清miR-146a表达水平明显降低,与Kivihall等[11]的结果有所不同但接近一致(均值为0.67 vs 0.36),分析原因可能为所患疾病不同,但miR-146低表达可能预示COPD发生,与中性粒细胞水平异常引起的炎症反应增加有关。此外,本研究结果显示,与COPD组相比,COPD+CHD组血清miR-146a表达水平明显下调,提示血清miR-146水平下调可能与COPD并发CHD有关。
笔者进一步研究发现,COPD+CHD组血清miR-145、miR-146a水平与CRP、纤维蛋白原水平及Gensini评分呈负相关,而与肺功能指标FEV1/FVC、血气指标PaO2水平呈正相关。以上结果提示miR-145、miR-146a下调可能通过靶向调控转化生长因子-β(transforming growth factor-β,TGF-β)、CRP等表达,影响平滑肌细胞增殖、迁移及炎症因子表达,促进肺、血管内皮损伤及炎症反应增加,导致COPD患者肺功能损伤及心肌损伤的加重,从而影响COPD进展及并发CHD[5]。
由于本研究阳性样本量较少,故选取表5中与miR-145、miR-146a水平相关的指标/因子为自变量进行Logistic回归分析。结果发现,低miR-145水平、低miR-146a水平是影响COPD并发CHD的独立危险因素,提示miR-145及miR-146a表达可能作为COPD患者并发CHD的生物学标志物。进一步通过ROC曲线分析可知,血清miR-145、miR-146a联合诊断COPD并发CHD的AUCROC为0.887,明显高于miR-145、miR-146a单独诊断,且二者联合诊断的敏感性也最高,表明二者联合对COPD患者并发CHD的诊断价值较高,临床可通过监测二者水平变化对患者病情及预后进行评估。
综上所述,COPD并发CHD患者血清miR-145及miR-146a表达水平下调,且与患者肺功能、血气指标及Gensini评分变化有关,是COPD患者并发CHD的潜在评估指标。但本研究阳性样本量较少,具体作用机制有待进一步深入研究。

