SNRPA对胃癌细胞增殖、迁移、侵袭及Snail1信号通路的影响
李永刚,郭洁,刘延峰,徐长福,牛智平
(1.咸阳市第一人民医院普外一科,陕西咸阳 712000;2.西安医学院第一附属医院急诊科,西安 710077;3.西安交通大学医学院基础医学院,西安710061;4.安康市人民医院普外科,陕西安康725000)
胃癌是常见的消化道肿瘤疾病之一,手术是胃癌的最主要治疗手段,但患者的预后及生存率相对不佳[1]。因此,探究胃癌发生、发展的相关分子机制,找到胃癌早期诊断的标记分子对于改善患者的预后和治疗十分重要[2]。小核核糖核蛋白多肽A(homo sapiens small nuclear ribonucleoprotein polypeptide A,SNRPA)是一种含有2个RNA结合区和282个氨基酸的蛋白质,其在剪接体的形成和mRNA的剪接过程发挥一定的作用。多项研究[3-6]表明,SNRPA在肝细胞癌中的表达水平明显升高,但其在胃癌患者肿瘤细胞中的表达研究报道少见。本研究旨在探讨SNRPA在胃癌组织及细胞系中的表达水平,并分析SNRPA调控锌指转录因子1(Snail1)对人胃癌细胞系增殖、迁移和侵袭的影响,以期为胃癌患者临床治疗提供依据。
1 材料与方法
1.1细胞系及培养条件 胃癌细胞系AGS、HGC27、SGC7901、BGC823和MGC803购自中国科学院上海细胞库。将上述细胞系置于含10%FBS和青霉素/链霉素的改良Eagle培养基(Modified Eagle)中,并置于饱和湿度、37 ℃、5%CO2的条件下常规培养,通过反复传代培养去除自我更新能力差的细胞,取生长状态良好的细胞用于后续实验。
1.2研究对象 收集2018年1月至12月于咸阳市第一人民医院进行手术治疗的89例胃癌患者的癌组织和癌旁组织(距肿块边缘距离>4 cm,且切缘阴性),男性55 例,女性34 例,年龄为31~88岁,中位年龄63岁。纳入标准:(1)年龄>18岁;(2)术后经病理组织学诊断为原发性胃癌;(3)术前均未行放化疗。排除标准:(1)合并胃肠道溃疡、肠梗阻、出凝血功能障碍以及其他严重全身疾病患者;(2)有家族肿瘤遗传史;(3)既往有腹部手术史;(4)患者临床资料不完整。每例患者采集2份样本,1份立即置入液氮中保存,另1份经4%多聚甲醛固定,4 ℃保存。本研究经咸阳市第一人民医院医学伦理学委员会批准[批准文号:(2018)伦理(会)第(04001)号],患者或家属知情同意。
1.3主要试剂及仪器 Trizol试剂、反转录试剂盒、Power SYBR@Green PCR Master Mix均购自日本TaKaRa公司,SNRPA siRNA、Snail1 siRNA、SNRPA过表达质粒、Snail1过表达质粒及相应阴性对照、EDU试剂盒均购自广州锐博生物科技公司,MEM完全培养基、RPMI-1640培养基购自美国HyClone公司,胎牛血清购自美国Sciencecell公司,CCK-8试剂购自上海碧云天生物公司,兔抗人Snail1多克隆抗体、兔抗人SNRPA多克隆抗体,兔抗人GAPDH多克隆抗体、羊抗兔IgG二抗购自武汉三鹰生物技术公司。NanoDrop 2000微量紫外分光光度计、多功能酶联仪(美国Thermo Fisher Scientific公司),紫外透射反射仪(上海沪粤明科学仪器公司)。
1.4RNA提取、逆转录反应及实时定量PCR(qRT-PCR) 采用在线数据库Gene Expression Profiling Interactive分析(GEPIA)(http://gepia.cancer-pku.cn/index.html)验证Snail1和SNRPA等基因的差异表达[6]。按Trizol试剂说明书提取胃癌组织及上述胃癌细胞系(5×104个)中的总RNA,使用NanoDrop 2000微量紫外分光光度计对RNA进行定量,取吸光度(A260/280 nm)值为1.8~2.0的样本,置于-20 ℃保存。取1 mg RNA,按照逆转录试剂盒说明书将RNA逆转录为 cDNA,取1 μL cDNA进行PCR反应。引物由上海生工公司设计并合成。SNRPA上游引物序列:5′-CAAACCTATGCGTATCCAGT-3′,下游引物序列:5′-GGATTCTCAGAAAGAGGCTG-3′;GAPDH上游引物序列:5′-ACACCCACTCCTCCACCTTT-3′,下游引物序列:5′-TTACTCCTTGGAGGCCATGT-3′;Snail1上游引物序列:5′-AGCCCAAGCAGTAGTACATT-3′,下游引物序列:5′-CATTCACATCCGTCGTTCC-3′。PCR总反应体系为25 μL,包括10 μmol/L上、下游引物各1 μL,10 μmol/L dNTPs 4 μL,10×PCR buffer 1 μL,模板DNA 2 μL,无菌ddH2O补足体积至25 μL。反应参数:95 ℃预变性3 min;95 ℃ 30 s,56 ℃ 30 s,72 ℃ 30 s,共35个循环;72 ℃ 5 min。取2 μL PCR扩增产物,行20 g/L琼脂糖凝胶电泳,并用紫外透射反射仪扫描并拍照。结果以2-△△Ct法表示。实验重复3次,计算平均值。
1.5细胞转染 取对数生长期人胃癌细胞系SGC7901和AGS,接种于6孔细胞培养板中,置于饱和湿度、37 ℃、5%CO2的条件下培养。实验设为NC组(使用非特异性siRNA进行干预)、vector组(使用PBS干预)和si-SNRPA组(使用SNRPA-siRNA进行干预)。每组设3个复孔。每孔中加入2 mL 10%胎牛血清的MEM培养基,接种5×104个上述各组细胞于酞片表面和空孔中,摇匀后,置于5%CO2、37 ℃培养箱进行细胞培养。待细胞融合度达60%时,按照Lipofectamine 3000转染试剂说明书进行转染,转染48 h后收集细胞用于提取总RNA,转染72 h后收集细胞蛋白质用于后续实验。
1.6细胞增殖分析
1.6.1CCK-8细胞增殖试验 取转染后人胃癌细胞系SGC7901和AGS接种于96孔细胞培养板,每孔接种3×103个细胞,每组设5个平行孔,分别于1、2、3、4、5 d后,避光条件下加入CCK-8溶液10 μL;于37 ℃、5%CO2、饱和湿度条件下的细胞培养箱内培养2 h,采用多功能酶联仪检测450 nm波长处的吸光度(A)值,实验重复3次,取平均值。
1.6.2EdU细胞增殖试验 以4×104个/孔的细胞密度将胃癌细胞接种于铺有盖玻片的24孔细胞培养板,细胞贴壁后更换培养基,进行转染或共培养,于观察终点2 h时加入 EdU溶液(终浓度为50 μmol/L),按试剂盒说明书固定细胞、染色及铺片。使用倒置荧光显微镜,观察 Appolo567染色使用550 nm激发光,观察 Hoechst 3342染色使用350 nm激发光,放大倍数为200倍。每孔等分4个象限,每个象限随机拍摄3张不同视野照片并计数,分别计算细胞核(Hoechst)及增殖细胞(Appolo)染色细胞数,细胞增殖率=Appolo/Hoechst×100%,每个复孔Hoechst染色阳性细胞计数大于1 000个。同组设3个复孔,取平均值。
1.7Transwell试验
1.7.1细胞迁移试验 取上述转染48 h后的胃癌细胞系SGC7901和AGS,用无血清培养基洗涤,在Transwell小室的上室接种5×104个(100 μL)细胞,下室加入750 μL含20%胎牛血清的DMEM完全培养基。置于37 ℃、5%CO2条件下培养24 h,棉签拭去上室细胞,4%多聚甲醛固定30 min,0.1%结晶紫染色20 min。PBS洗涤3次,镜下计数5个不重复视野的穿膜细胞数,取平均值。
1.7.2细胞侵袭试验 取上述转染48 h后的胃癌细胞系SGC7901和AGS,用无血清培养基洗涤,在Transwell小室的上室接种5×104个(100 μL)细胞,基质胶包被的Transwell小室的下室加入200 μL细胞悬浮液,同时加入750 μL含20%胎牛血清的DMEM完全培养基,避免下层培养液和小室间产生气泡;细胞置于37 ℃、5%CO2培养箱中培养。24 h后弃去上清液,用冷的无水甲醇室温固定10 min,空气干燥,结晶紫染色10 min,用棉签将上层细胞擦去,PBS冲洗后于显微镜下观察并拍照,计算侵袭细胞数。
1.8western blot 提取上述胃癌组织和5种胃癌细胞系中总蛋白质,采用BCA方法进行蛋白质定量。配制10%SDS-PAGE凝胶,上样并进行电泳及转膜;将PVDF膜浸入50 g/L脱脂奶粉封闭温育1 h, 加入兔抗人Snail多克隆抗体(1∶1 000稀释)及兔抗人多克隆抗体SNRPA(1∶500稀释),4 ℃温育过夜,内参照的PVDF膜浸入50 g/L奶粉封闭液中4 ℃过夜;TBST清洗后,室温温育二抗1 h,内参照的PVDF膜浸入HRP标记的GAPDH(1∶5 000稀释),室温温育1 h;TBST漂洗后,对PVDF膜进行显影,采用化学发光成像仪成像,测定目的条带灰度值,分析蛋白质表达,以GAPDH为内参照计算目的蛋白质相对表达量。
2 结果
2.1SNRPA在胃癌患者组织中的表达 qRT-PCR法检测结果表明,SNRPA在癌组织中的相对表达量为(6.23±2.09),明显高于癌旁组织(3.91±1.64),差异有统计学意义(t=8.239,P<0.001)。此外,进一步对胃癌患者的临床病理参数进行比较,发现SNRPA在胃癌患者中的表达水平与肿瘤组织的大小、病理分期有关,见表1。
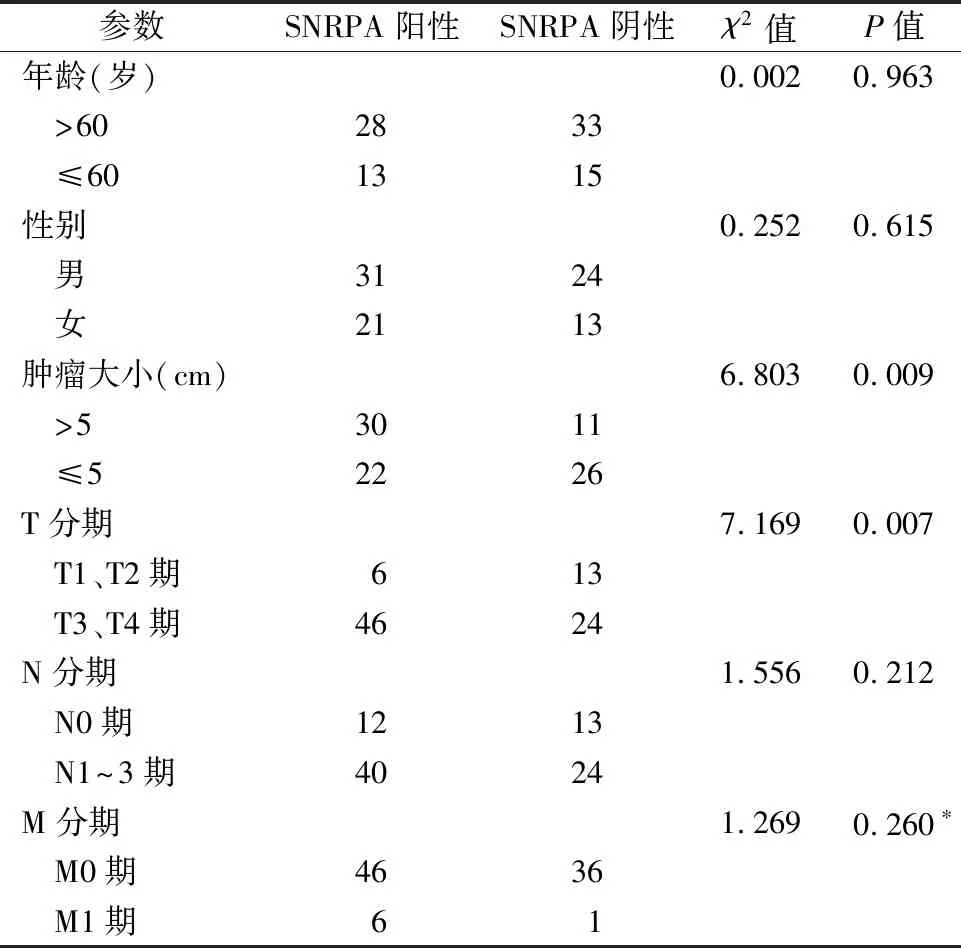
表1 SNRPA表达与胃癌患者临床病理参数的比较(n=89)
2.2SNRPA升高促进胃癌细胞增殖 western blot结果显示,SNRPA在AGS细胞中的表达水平为(0.47±0.10),在HGC27细胞中的表达水平为(0.32±0.08),在BGC823细胞中的表达水平为(0.29±0.07),在MGC803细胞中的表达水平为(0.30±0.09),在SGC7901细胞中的表达水平为(0.23±0.05)。5种细胞中,SNRPA在AGS细胞的表达水平显著高于其他4组(t分别为11.050、13.912、11.921和20.251,P均<0.001),而SNRPA在SGC 7901细胞中的表达水平显著低于其他4组(t分别为9.000、20.251、6.580、6.414,P均<0.001),见图1A。进一步进行细胞转染的结果证实,SNRPA在SNRPA siRNA组的表达水平为(0.19±0.07),显著低于NC组的(0.38±0.12)和SNRPA组(0.47±0.09),差异有统计学意义(t分别为12.902、23.168,P均<0.001),提示SNRPA基因干扰和过表达有效,见图1B。CCK-8和EdU细胞增殖试验结果表明,SNRPA siRNA组EdU阳性率为(0.37±0.06)%,显著低于NC组(0.58±0.09)%,差异有统计学意义(t=18.316,P<0.001),SNRPA组EdU阳性率为(0.62±0.07)%,显著高于vector组(0.29±0.05)%,差异有统计学意义(t=36.190,P<0.001),提示SNRPA对胃癌细胞的增殖有明显的促进作用,见图1C~1F。
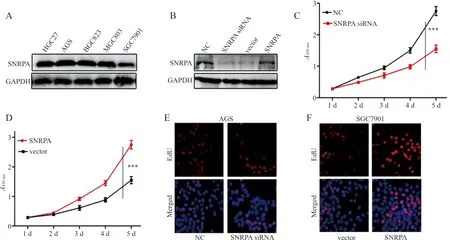
注:A,SNRPA在5种胃癌细胞系中的表达情况;B,SNRPA siRNA和SNRPA过表达质粒的转染和有效性检验;C~D,CCK-8试验检测SNRPA对胃癌细胞增殖,***,P<0.001;E~F,EdU试验检测细胞增殖结果。
2.3SNRPA促进胃癌细胞侵袭和迁移 Transwell细胞迁移试验结果显示,在转染siSNRPA 48 h后,NC组AGS细胞迁移率和侵袭率分别为(98.57±25.04)%和(95.21±30.06)%,显著高于SNRPA siRNA组的(26.75±8.08)%和(24.25±10.32)%,差异均有统计学意义(t分别为25.751、21.063,P均<0.001)。反之,SGC7901在转染SNRPA 质粒48 h后,SNRPA组SGC7901细胞迁移率和侵袭率分别为(385.54±60.39)%和(320.14±45.58)%,显著高于vector组的(105.21±28.86)%和(124.43±38.25)%,差异均有统计学意义(t分别为39.512、31.029,P均<0.001),见图2。

注:A、B分别为NC组和SNRPA siRNA组对AGS细胞迁移率和侵袭率的影响;C、D分别为vector组和SNRPA组对SGC7901细胞迁移率和侵袭率的影响。
2.4western blot和qRT-PCR检测胃癌细胞Snail1的结果 AGS和SGC7901细胞分别转染siSNRPA和SNRPA 质粒48 h后,在AGS细胞中,SNRPA siRNA组和vector组Snail1的表达水平分别为(0.19±0.07)和(0.21±0.09),显著低于NC组的(0.36±0.10),差异均有统计学意义(t分别为13.139、10.518,P均<0.001),见图3。SGC7901在转染SNRPA 质粒48 h后, SNRPA组Snail1mRNA的表达水平为(8.92±1.13),显著高于NC组的(3.76±0.09),差异有统计学意义(t=42.943,P<0.001)。
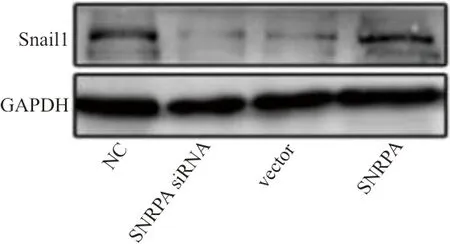
图3 western blot检测分别转染siSNRPA和SNRPA 质粒48 h后的AGS细胞
2.5Snail1对胃癌细胞增殖及迁移能力的影响 CCK8试验及Transwell细胞迁移试验检测Snail1对细胞增殖、迁移和侵袭能力的结果显示,在Snail1 siRNA沉默Snail1表达后,AGS细胞增殖率和迁移率分别为(34.54±10.31)%和(30.69±9.58)%,显著低于NC组的(102.64±25.58)%和(100.05±36.74)%,差异均有统计学意义(t分别为23.295、17.234,P均<0.001),见图4A~D。
2.6敲减Snail1可逆转SNRPA对胃癌细胞增殖能力的影响 结果显示,SNRPA 过表达质粒转染后,SNRPA组SGC7901细胞增殖率为(180.75±34.59)%较vector组的(58.08±20.25)%显著增强,差异有统计学意义(t=28.873,P<0.001)。而与Snail1 siRNA共转染后可以逆转SNRPA过表达质粒对细胞增殖及迁移能力的促进作用(图5A~C)。

注:A,CCK-8试验检测胃癌细胞系AGS的结果;B,AGS细胞的转移与侵袭率,***,P<0.001;C、D,AGS细胞的转移与侵袭的镜下结果。
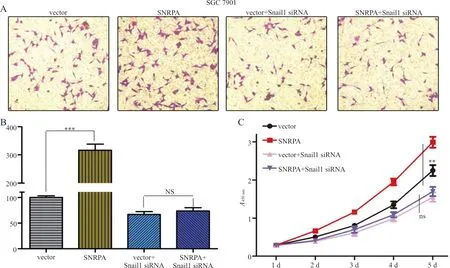
注:A,敲减Snail1后SGC7901细胞的转移与侵袭的结果;B,敲减Snail1后胃癌细胞转移与侵袭细胞数;C,CCK-8试验检测敲减Snail1后不同时点胃癌细胞的结果,**,P<0.01,***,P<0.001;NS,无统计学意义。
3 讨论
以往的研究表明,小核核糖核蛋白复合物(U1snRNP)参与了许多真核细胞的重要活动,如前mRNA剪接和凋亡等[7-8]。然而U1snRNP复合物及其组分在肿瘤发生过程中的作用尚不清楚。本研究结果证实,SNRPA作为U1snRNP复合物的成员,在胃癌的发展过程中发挥重要的作用,并且可能与患者的不良预后相关。
本研究发现SNRPA蛋白在胃癌组织中呈高表达,且与胃癌患者的肿瘤大小、肿瘤分期及预后不良密切相关。笔者进一步通过细胞增殖、侵袭和迁移试验证实,SNRPA通过促进细胞增殖、迁移和侵袭,在胃癌的发生、发展中起到促进作用。
本课题组前期试验通过生物信息学检索以及细胞学水平验证,证实Snail1是SNRPA的潜在靶基因。研究发现,Snail1是锌指转录因子Snail超家族成员,由264个氨基酸组成,通常起转录抑制作用。受PI3K和WNT信号通路控制的Snail1的磷酸化和核定位是Snail1调控的关键[9]。Snail1在上皮间质转化(EMT)的调控中起着关键作用,其与E-cadherin的丢失以及波形蛋白(vimentin)和纤维连接蛋白(fibronectin)的上调密切相关[10]。有学者通过细胞学研究证实,F盒蛋白FBXO31能够降低Snail1蛋白在细胞内的稳定性,导致其加速降解,以此来抑制胃癌细胞的EMT进程以及胃癌细胞的恶性表型[11]。另有研究发现,SNRPA蛋白在肿瘤组织和细胞中异常表达,且与肿瘤的发生、发展密切相关[12]。有学者对SNRPA蛋白在肝癌中的作用及相关机制进行探究,发现SNRPA蛋白不仅在肝癌细胞中的表达水平明显升高,而且促进肿瘤细胞的增殖与转移过程[13]。实际上SNRPA蛋白在不同肿瘤中的表达存在差异性,有学者发现,SNRPA蛋白在消化道肿瘤组织中的表达水平降低,且与肿瘤大小、淋巴结转移和远处转移呈显著相关[14]。同样,本研究发现在胃癌组织中SNRPA蛋白的表达水平明显升高,且SNRPA的过表达明显促进Snail1的表达水平,而SNRPA的敲除抑制Snail1的表达水平。笔者进一步分析发现,Snail1基因敲除抑制了胃癌细胞的增殖、侵袭和迁移,且Snail基因敲除减弱了SNRPA过表达对胃癌细胞增殖、侵袭和迁移能力的影响,以上结果提示Snail1很可能是人胃癌细胞中SNRPA的下游靶点。然而,本研究也存在一定的局限性,例如样本量相对较小且为单中心的研究,此外,未对患者进行长期的随访以分析其生存结果。SNRPA调控胃癌细胞Snail1表达的分子机制还需要进一步的实验证实。
综上所述,SNRPA是胃癌中一个潜在的癌基因,其在肿瘤组织中的表达明显升高,在体外能促进胃癌细胞的增殖、侵袭和迁移能力。本研究不仅为胃癌的发生机制发现了新的内容,同时也为胃癌治疗提供了新的潜在靶点。
——一道江苏高考题的奥秘解读和拓展

