NT-3修饰的施万细胞联合胶原—壳聚糖神经导管对大鼠坐骨神经损伤的修复作用研究
许 蕙,叶 放,于 宁,王艳生 (沈阳医学院附属中心医院手外科,辽宁 沈阳 110024)
周围神经系统(peripheral nervous system,PNS)损伤通常会导致神经痛或肌肉运动功能受损[1-2]。目前,用于修复PNS损伤的外科手术主要有神经断端吻合术、自体神经移植和人工神经导管移植[3]。尽管自体神经移植是首选治疗方案,但由于供体组织可用性有限,且存在丧失神经功能和形成神经瘤的可能,因而限制了其临床应用[4]。自体施万细胞(Schwann cells,SCs)在周围神经再生中起关键作用[5]。植入人工导管后,增殖的施万细胞可以释放营养因子,引导再生轴突穿过病变,但因其无法快速生成足够的细胞,故而其临床应用受到限制。神经营养素3(neurotrophin 3,NT-3)是重要的自分泌因子,可以支持施万细胞存活和分化,并刺激神经突生长和髓鞘形成,有利于受损神经快速修复[6],但以人工神经导管为载体、复合以NT-3修饰的施万细胞是否有利于施万细胞的存活及PNS损伤的有效修复目前尚不清楚。因此,本研究将复合NT-3修饰的施万细胞联合胶原—壳聚糖神经导管作为植入体,研究其对坐骨神经损伤的治疗效果,以期为临床应用提供新思路。
1 材料与方法
1.1 材料
1.1.1 实验动物 SPF级SD大鼠80只,8周龄,体质量(200±10)g,均为雄性,购自上海剑钝生物科技有限公司,动物生产许可证号:SCXK(沪)2019-0027。本研究经我院动物伦理委员会批准,实验遵守3R保护原则。
1.1.2 药品与试剂 Ⅰ型胶原蛋白(C3867)和壳聚糖(448869)购自Sigma公司,DMEM/F12培养基(A4192001)、胎牛血清(10100147)、0.25%胰酶(15050057)和青霉素—链霉素(10 000 U/mL,15140148)购自美国Thermo Fisher Scientific公司,TUNEL凋亡检测试剂盒(C1088)购自上海碧云天公司,DAPI(ab104139)、S100(ab181975)、Sox10兔单克隆抗体(ab155279)、山羊抗兔IgG H&L(Alexa Fluor®488,ab150077)和驴抗兔IgG H&L(Alexa Fluor®647,ab150075)多克隆抗体、Live/Dead试剂盒(ab253384)购自英国Abcam公司。
1.1.3 主要仪器 NeuroExam M 800型肌电图仪购自珠海麦康科技有限公司,FM-200荧光显微镜购自上海普丹光学仪器有限公司,H600型透射电镜购自日本Hitachi公司。
1.2 实验方法
1.2.1 胶原—壳聚糖神经导管制备 参照文献方法[7],按照质量比4∶1称取Ⅰ型胶原蛋白280 mg和壳聚糖70 mg,分别加入5 mL浓度为3 mg/mL的冰醋酸,低温放置24 h后混合2种溶液,冰浴、混匀、抽真空、静置过夜、注模,然后将模具浸入液氮,梯度冷淋后,再于-60 ℃、-13.3 Pa下冻干,裁剪为每段14 mm的神经导管,常温干燥并灭菌保存,密封备用。
1.2.2 施万细胞的培养及鉴定 按照文献方法[8],取新生SD大鼠5只,消毒后暴露坐骨神经,尽量剔除神经外膜组织,剪碎后使用Ⅰ型胶原酶和0.25%胰酶于37 ℃消化20 min,加入DMEM/F12完全培养液(含10%胎牛血清),轻轻吹打,离心6 min(1 500 r/min),收集细胞沉淀,并调整细胞密度为1×104/mL,接种于用多聚赖氨酸包被的培养瓶,在37 ℃、5%CO2培养箱中培养24 h。弃去旧培养液,加入终浓度为2 g/mL的阿糖胞苷DMEM/F12完全培养液,培养3 d,以除去成纤维细胞,待细胞融合率达90%左右,胰酶消化传代。取第3代施万细胞,利用S100和Sox10免疫荧光鉴定施万细胞纯度,其中施万细胞纯度=[S100阳性(绿色荧光)细胞+Sox10阳性(红色荧光)细胞]/DAPI标记细胞数(蓝色荧光)×100%。
1.2.3 施万细胞鉴定和基因修饰 取1.2.2培养的第3代施万细胞,接种于6孔板,培养8 h。将携带NT-3基因、且用RFP标记的腺病毒载体(AdvNT-3)原液(1×109TU/mL)按照病毒滴度值(MOI)3、10、100与培养基稀释后,用于培养上述施万细胞24 h,然后更换为DMEM/F12完全培养基培养48 h,荧光显微镜下观察,确定最佳MOI值。然后按照上述方法用未标记的AdvNT-3慢病毒感染施万细胞,用于后续实验。
1.2.4 动物模型制备[9]及分组 将SD大鼠随机分为5组:对照组(A组),12只;模型组(B组),10只;神经导管单独移植组(C组),11只;未修饰施万细胞+神经导管移植组(D组),20只;NT-3修饰施万细胞+神经导管移植组(E组),22只。给予各组大鼠腹腔注射10%水合氯醛(0.004 mL/g)麻醉,无菌环境手术暴露左侧坐骨神经,切除8 mm神经干制备坐骨神经损伤模型。然后进行以下操作:A组采用自身坐骨神经翻转吻合后缝合;B组采用切除坐骨神经后缝合;C组采用神经导管桥接缝合缺损神经;D组采用未修饰的施万细胞以1×106/mL复合神经导管,桥接缺损神经;E组采用NT-3修饰的施万细胞以1×106/mL复合神经导管,桥接缺损神经。术后每天腹腔注射青霉素50 000 IU/kg,持续3 d。
1.2.5 施万细胞存活率 术后5 d、11 d随机选取D组和E组大鼠各5只,处死后取移植处的复合神经导管,采用Live/Dead染色法检测移植后的施万细胞存活状态。其中绿色和红色荧光分别代表活细胞和死细胞。
1.2.6 坐骨神经功能指数(sciatic functional index,SFI)测定[10]术后1周、4周、7周、10周和13周,将各组大鼠(其中D组和E组,术后1周分别随机选取10只和12只大鼠)后左右足均蘸墨水,由暗箱一侧走至另一侧,分别记录3~4个正常侧和手术侧清晰足迹,并测量足印长度、第1脚趾至第5脚趾距离、第2脚趾至第4脚趾距离,按照Bain公式计算大鼠SFI值,取平均值。
1.2.7 电生理检测 术后13周,将各组剩余的全部大鼠用10%水合氯醛(0.004 mL/g)腹腔麻醉,暴露左侧移植坐骨神经,于梨状肌下缘3 mm神经干处放置刺激电极,同侧外踝关节上10 mm腓肠肌安置接收电极,电极强度1 V,间隙0.25 ms,测定肌肉复合动作电位传导速率和峰峰值。
1.2.8 TUNEL测定 待电生理检测结束后,取各组大鼠移植处组织5 mm,制成常规石蜡切片,根据TUNEL染色说明书操作步骤对组织切片染色,随机抽取5个视野观察神经元细胞凋亡情况。
1.2.9 坐骨神经髓鞘再生情况 取TUNEL测定中大鼠移植处组织,经2.5%戊二醛固定、脱水、包埋、固化后,制成60 nm超薄切片,用柠檬酸和乙酸铀酰染色,然后在透射显微镜下观察轴突超微结构。
1.3 统计学方法

2 结果
2.1 施万细胞鉴定结果
S100阳性施万细胞呈绿色,Sox10阳性施万细胞呈红色;DAPI阳性施万细胞细胞核呈蓝色,施万细胞纯度为95%以上,见图1。
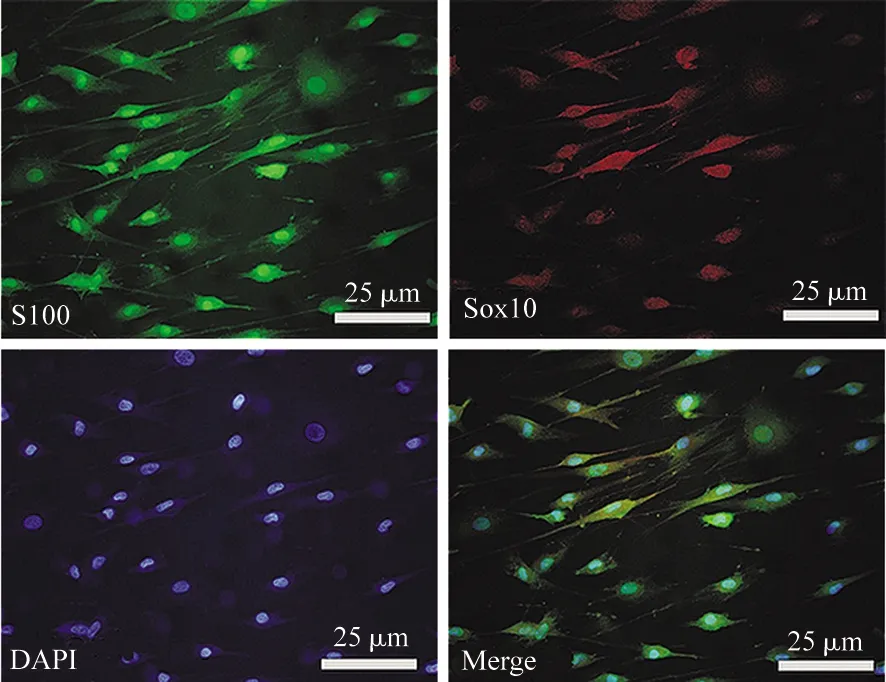
图1 施万细胞鉴定结果
2.2 最佳MOI值确定
MOI值为3、10、100的施万细胞RFP阳性表达依次升高,其中MOI值为100的施万细胞RFP阳性表达最强,表示最佳MOI值为100,红色荧光表示成功感染NT-3慢病毒(图2)。

a:MOI=3;b:MOI=10;c:MOI=100
2.3 施万细胞存活情况
D组术后5 d、11 d施万细胞存活率分别为(95.28±2.31)%和(98.64±2.39)%,E组术后5 d、11 d施万细胞存活率分别为(92.56±1.94)%和(94.74±1.63)%,存活状态均良好,见图3。
2.4 坐骨神经功能指数测定
术后1周,与A组比较,其余各组SFI均明显降低(P<0.05),但其余各组间比较差异无统计学意义(P>0.05);术后4周,与A组比较,其余各组SFI均显著降低(P<0.05),其余各组中E组最高(P<0.05),而B组、C组、D组间无统计学差异(P>0.05);术后7周、10周和13周,与A组相比,其余各组SFI均明显较高(P<0.05),与B组和C组相比,D组和E组SFI均显著较高(P<0.05),且E组高于D组(P<0.05),B组和C组比较无统计学差异(P>0.05),见表1。
2.5 电生理检测
术后13周,与A组相比,其余各组动作电位传导速度显著较低(P<0.05),除E组外其余各组峰峰值显著较低(P<0.05);与B组相比,C组、D组和E组动作电位传导速度和峰峰值依次升高(P<0.05),且E组高于D组(P<0.05),见表2。
2.6 损伤区神经元凋亡情况
术后13周,与A组相比,B组神经元细胞凋亡数量明显较多;与B组相比,C组、D组和E组神经元细胞凋亡数量依次减少,绿色为凋亡神经元细胞,见图4。

图3 D组和E组术后5 d、11 d复合移植导管中施万细胞存活鉴定结果(×100)
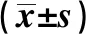
表1 术后不同时间点各组大鼠SFI值比较
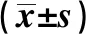
表2 各组大鼠动作电位传导速度和峰峰值比较
2.7 大鼠坐骨神经损伤区再生神经轴突超微结构分析
术后13周,A组神经纤维数量丰富、粗细均匀、髓鞘较厚、排列均匀,且结构清晰;B组神经纤维数量明显较少,且有严重的脱髓鞘变化及轴浆萎缩等异常现象,纤维生长明显状态不良;与B组相比,C组、D组和E组神经纤维结构明显清晰,纤维数量依次增多,脱髓鞘现象得到显著改善,见图5。

图4 术后13周各组大鼠坐骨神经损伤移植段神经元细胞形态学变化情况

图5 术后13周各组移植大鼠中段再生坐骨神经1 μm横截面电镜超微结构
3 讨论
PNS损伤是临床常见的疾病,通常会导致四肢痛觉过敏、与疼痛有关的步态和肿胀等问题,严重影响患者生活质量[11]。当PNS损伤严重到无法进行自主活动时,通常使用患者自身的腓肠神经等自体神经进行移植,但有限的来源给供给造成较大的困难,因此,可匹配或超过自体移植物性能的替代方法是当前临床明显紧缺的,也是临床应用研究的热点。
随着组织工程学的发展,应用于神经缺损的神经导管为神经再生提供了指导和生物学环境,但导管本身对神经修复的作用有限,因此神经修复主要集中在利用细胞疗法或基因修饰优化神经导管。施万细胞是神经胶质细胞,在整个发育过程中与轴突紧密接触,并为周围的神经元提供重要营养支持,而PNS损伤会影响施万细胞功能[12]。NT-3有益于周围神经和施万细胞生长,能够促进轴突再生和相关髓鞘形成[13]。本研究首先从新生SD大鼠中提取施万细胞,经S100/Sox10双荧光标记鉴定施万细胞纯度为95%以上,并采用最佳MOI值100以携带NT-3基因的AdvNT-3修饰施万细胞,然后复合胶原—壳聚糖神经导管植入坐骨神经损伤大鼠,结果显示术后5 d、11 d施万细胞在大鼠体内存活状态良好,表明复合导管可有效保持携带NT-3基因的施万细胞活性,这可能有利于施万细胞发挥促进坐骨神经损伤修复的作用。
季夕萌等[14]研究发现,将载骨髓间充质干细胞双层胶原神经导管桥接于大鼠坐骨神经缺损部位,可有助于大鼠神经功能恢复。将牙髓干细胞复合聚乳酸乙醇酸神经导管移植到糖尿病大鼠坐骨神经,可明显增加其神经传导速度和神经血流[15]。此外,骨髓基质细胞复合聚乳酸聚乙醇酸神经导管能够改善坐骨神经间隙模型大鼠脊髓运动神经元的生长,有助于神经轴突再生和功能恢复[16]。SFI是用于评估大鼠或小鼠周围神经功能恢复情况的可靠参数[17]。损伤后坐骨神经动作电位的振幅与总神经纤维数量及兴奋强度成正比[18]。本研究结果显示,坐骨神经损伤大鼠的SFI、动作电位传导速度和峰峰值降低,神经纤维数量明显减少,且出现轴浆萎缩等现象,同时神经元细胞凋亡数量增多,表明坐骨神经损伤大鼠的神经功能恢复缓慢。神经导管单独移植组坐骨神经损伤大鼠以上指标改善均不明显,给予未修饰施万细胞+神经导管移植后,神经功能恢复效果相对提升,给予NT-3修饰的施万细胞+神经导管移植后,大鼠各项指标改善显著,说明NT-3修饰的施万细胞有利于坐骨神经损伤大鼠髓鞘再生,且改善效果优于未修饰的施万细胞+神经导管移植。Wright等[19]的研究显示,用神经营养蛋白调节细胞行为,可以实现自体嗅鞘细胞移植功能的最佳化。而将施万细胞和嗅鞘细胞共移植能够显著改善脊髓损伤大鼠的运动功能[20],因此推测NT-3修饰的施万细胞联合胶原—壳聚糖神经导管在促进坐骨神经功能恢复方面具有较大潜力。
综上所述,NT-3修饰的施万细胞联合胶原—壳聚糖神经导管能够促进坐骨神经损伤大鼠损伤部位的神经髓鞘再生,保护神经纤维功能,对大鼠坐骨神经损伤具有良好的修复作用,表明该方案在治疗PNS损伤方面具有潜在价值。但PNS损伤可以诱发复杂的病理生理过程和炎症反应,这给治疗组织损伤带来一定困难,因此,NT-3修饰的施万细胞联合胶原—壳聚糖神经导管对PNS损伤的治疗效果仍需深入探讨。

