人脐带间充质干细胞源胞外囊泡促进施万细胞增殖和迁移
张欢妍, 马永宾, 董利阳, 张文哲, 薛菲, 单文琪, 汪雪峰
(1. 江苏大学附属医院中心实验室, 江苏 镇江 212001; 2. 江苏大学附属金坛医院神经病学实验室, 江苏 金坛 213200)
胞外囊泡(extracellular vesicles, EVs)是由细胞膜分离的纳米级膜泡,具有亚细胞结构,负载多种生物活性物质(蛋白质、脂质和RNA )介导细胞间信息通讯[1]。来源于不同细胞的EVs具有多种生物学功能,例如细胞增殖、存活和转化,其在组织工程和再生医学领域已被广泛关注[1]。间充质干细胞(mesenchymal stem cells, MSCs)是一类具有自我更新和多向分化潜能的成体干细胞[2]。研究表明,MSCs源EVs在肝脏[3]、肾脏[4]、中枢神经[5]等组织损伤治疗中具有预防和保护作用。本课题组前期的研究结果也证实,人脐带间充质干细胞(human umbilical cord mesenchymal stem cells,hUCMSCs)源EVs(hUCMSC-EVs)能显著促进大鼠坐骨神经切断性损伤的修复[6],具体机制不明。施万细胞是周围神经的胶质细胞,可为神经轴突提供代谢和营养支持。周围神经损伤后,施万细胞增殖并迁移至损伤部位,吞噬轴突和髓鞘碎片,并形成Büngner带以引导轴突定向再生[7]。提示促进施万细胞增殖和迁移可有助于受损的周围神经修复。基于此,hUCMSC-EVs是否通过影响施万细胞增殖和迁移,进而促进坐骨神经损伤的再生修复,仍然未知。本研究旨在探讨hUCMSC-EVs对施万细胞增殖和迁移的影响,初步阐明其修复机制,从而为周围神经损伤提供新的治疗策略。
1 材料与方法
1.1 材料
hUCMSCs的提取和鉴定参照本课题组前期报道[6];hUCMSCs培养基(美国Cyagen公司);原代施万细胞培养基(上海中乔新舟生物科技有限公司);兔抗人CD9抗体、兔抗人CD63抗体(美国Abcam公司);兔抗大鼠S100抗体、兔抗大鼠GFAP抗体、Alexa Fluor 488标记的山羊抗兔、Cy3标记的山羊抗兔(武汉Servicebio公司);CCK8和BCA蛋白浓度测定试剂盒(碧云天生物技术有限公司);DIO荧光染料(上海Invitrogen 公司);T25 cm2细胞培养瓶、96孔板、12 mm TranswellTM小室(美国Corning公司);胞嘧啶阿糖胞苷(美国Sigma公司);CKX-53荧光显微镜(日本Olympus公司),ICC50正置显微镜(德国Leica公司);Eclipse Ti激光共聚焦显微镜(日本Nikon公司)。
1.2 方法
1.2.1 hUCMSC-EVs提取 hUCMSCs在培养皿中培养融合度约为80%,用PBS洗涤2次(去除残留血清),加入去除EVs的完全培养基继续培养24 h后,收集hUCMSCs培养上清液,300×g离心10 min、2 000×g离心20 min,然后通过0.45 μm滤器过滤去除细胞碎片,收集上清液并以4℃、100 000×g超高速离心90 min;弃上清液留取沉淀(约1 mL),用PBS重悬以去除大分子蛋白络合物,超高速重复离心1次,弃上清液,收集hUCMSC-EVs,用BCA蛋白浓度测试试剂盒检测浓度,EP管分装,-80℃冰箱储存备用。
1.2.2 透射电镜观察hUCMSC-EVs形态特征 取20 μL纯化后的hUCMSC-EVs充分混悬后滴加到直径2 mm的载样铜网上,室温静置1 min,用滤纸吸去铜网边缘液体;磷钨酸溶液(pH 6.8)滴加于铜网上,室温负染5 min;白炽灯烘干后置于电镜样品室,透射电镜下观察hUCMSC-EVs形态及拍照。
1.2.3 蛋白质印迹法检测hUCMSC-EVs分子标志物CD9和CD63的表达 取100 μL纯化后的EVs,加入等体积的蛋白裂解液(RIPA),充分震荡混匀后置于冰上,每10 min重复震荡1次,重复3次后12 000×g离心15 min,取上清液, BCA法测定蛋白质浓度,加入上样缓冲液充分混匀, 95℃煮沸10 min。取100 μg蛋白加至10%聚丙烯酰胺胶中电泳,并转至PVDF膜上,5% BSA室温封闭1 h,分别加入CD9抗体和CD63抗体(1 ∶ 500),4 ℃孵育过夜; 用1×TBST洗膜3次,加入HPR标记的山羊抗兔二抗(1 ∶ 2 000),37 ℃孵育1 h,1×TBST洗膜3次后ECL曝光显影。
1.2.4 施万细胞的提取 取新生3~4 d的SD大鼠,75%乙醇消毒10~15 min,用眼科剪取双侧坐骨神经和臂丛神经,加入D-Hanks缓冲液并剪碎,然后加入0.25%胰蛋白酶和0.3 mg/mL Ⅰ型胶原酶,(D-Hanks ∶ 胰蛋白酶 ∶ Ⅰ型胶原酶=1 ∶ 1 ∶ 1),37℃、5% CO2孵箱内消化30 min(15 min时取出用1 mL加样枪吹打混匀1次)。消化完成后10%胎牛血清终止消化,1 000 r/min离心10 min,弃上清液,接种于6孔板中,培养24 h后换成含5 μg/mL胞嘧啶阿糖胞苷的原代施万细胞培养基继续培养48 h,换成施万细胞培养基培养并传代,用于本实验的施万细胞为P5~P7代。
1.2.5 施万细胞的鉴定 取1×105个施万细胞接种于24孔板中培养24 h,吸弃培养基;4%多聚甲醛固定30 min;PBS洗2次;随后加入0.5% Triton X-10反应10 min;PBS洗2次;5%BSA封闭20 min;加入S100抗体(1 ∶ 200)和GFAP抗体 (1 ∶ 200),4℃孵育过夜;PBS洗3次;加入二抗绿色荧光染料Alexa Fluor 488标记的山羊抗兔(1 ∶ 200)和红色荧光染料Cy3标记的山羊抗兔(1 ∶ 200),37℃孵育1 h;PBS洗3次;随后加入5 μg/mL 4,6-二氨基-2-苯基吲哚 (DAPI)染核10 min;PBS洗2次,在CKX-53荧光显微镜下观察并拍照。
1.2.6 CCK8细胞增殖实验 将施万细胞接种于96孔板(5×103个/孔),每组设置5个复孔,分别加入对照培养液及5、25、50 μg/mL hUCMSC-EVs培养48 h后,每孔加入10 μL CCK-8,充分混匀,在37℃、5% CO2培养箱中孵育2 h,在酶标仪450 nm波长处检测光密度(D)值。
1.2.7 Transwell迁移实验 分别用对照培养液及5、25、50 μg/mL hUCMSC-EVs预处理施万细胞 24 h后,分别计数并取1×105用200 μL无血清培养基重悬后,滴加到Transwell小室中,下室加入800 μL 施万细胞培养基。培养12 h后,用4%多聚甲醛固定30 min;PBS洗3次,结晶紫染色15 min;PBS洗3次,晾干后ICC50显微镜拍照。
1.2.8 激光共聚焦显微镜观察 用DIO绿色荧光染料标记hUCMSC-EVs,37 ℃、5% CO2培养箱中孵育20 min,PBS洗2次;超高速离心并洗涤后与施万细胞37 ℃孵育2 h;PBS洗2次,4%多聚甲醛中固定30 min;PBS洗2次,加入0.5% Triton X-100 10 min;然后用PBS洗2次,5 μg/mL DAPI染核10 min;PBS洗2次,应用Eclipse Ti共聚焦显微镜观察并拍照。
1.3 统计学分析
2 结果
2.1 hUCMSC-EVs的形态及鉴定
透射电镜结果显示,hUCMSC-EVs呈圆形或椭圆形的膜性结构(图1A);hUCMSCs和hUCMSC-EVs亦表达胞外囊泡特异性标志蛋白CD9和CD63(图1B)。提示成功提取hUCMSC-EVs。
2.2 施万细胞形态及鉴定
通过酶消化法贴壁培养并纯化,传代至P5代形态均一,呈梭形;荧光染色结果表明,细胞表达施万细胞特异性表面标志蛋白S-100和GFAP,提示成功提取施万细胞。见图2。

A:透射电镜观察hUCMSC-EVs形态特征(黑色箭头指示为EVs);B:蛋白质印迹检测hUCMSC-EVs标志蛋白CD9、CD63表达
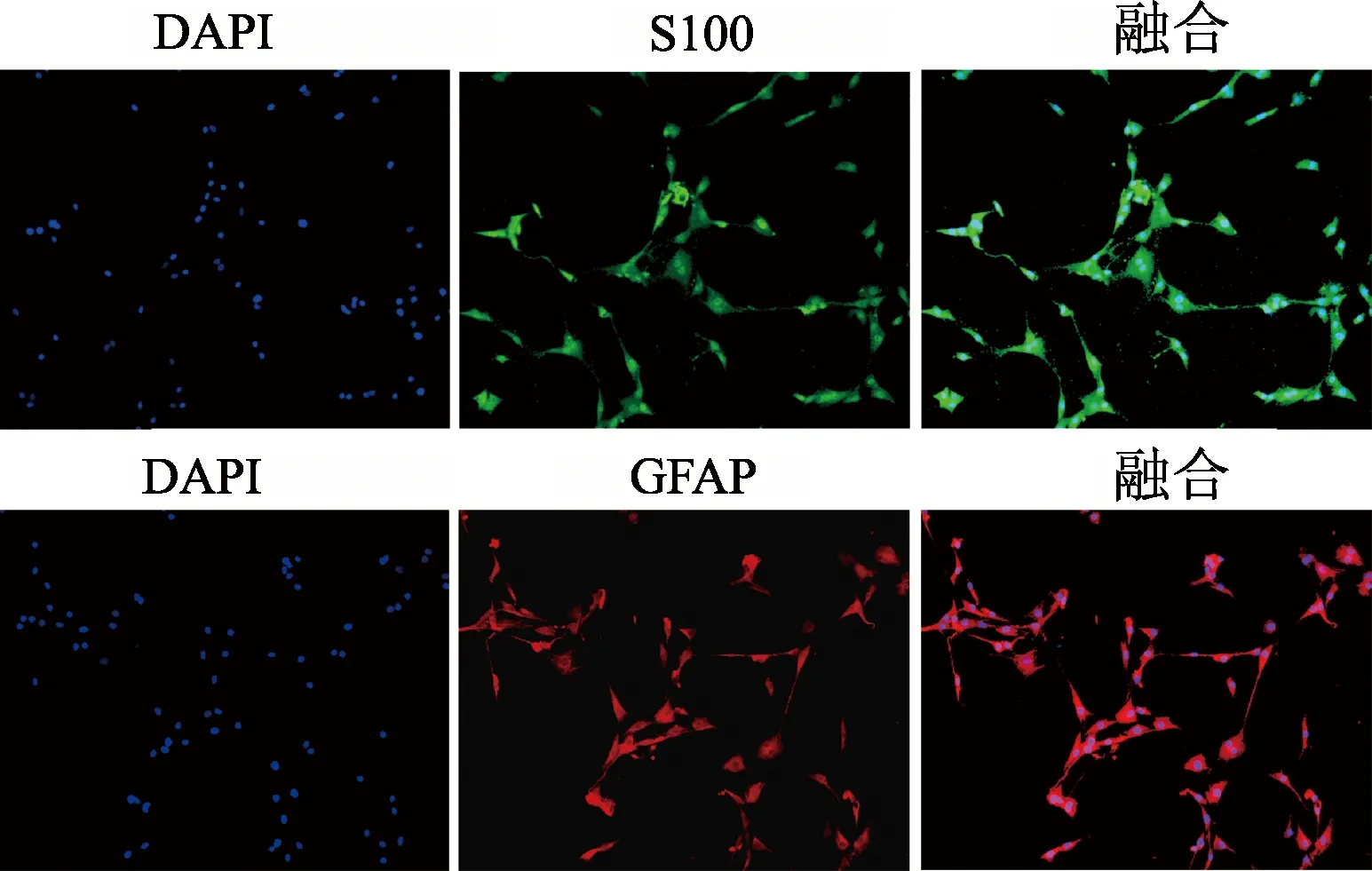
图2 施万细胞特异性表面标志蛋白S100、GFAP表达(100×)
2.3 hUCMSC-EVs促进施万细胞的增殖
CCK8细胞增殖实验结果显示,与对照组相比,hUCMSC-EVs处理后,不同浓度的EVs都可促进施万细胞的增殖(F=40.14,P<0.05);各浓度之间比较发现,随着浓度的升高,施万细胞的增殖能力显著增加(P<0.05或P<0.01)。说明hUCMSC-EVs显著促进施万细胞的增殖且呈浓度依赖。见图3。

a:P<0.05, b:P<0.01,与对照组比较; c:P<0.05,d:P<0.01,与5 μg/mL EVs比较; e:P<0.01,与25 μg/mL EVs比较
2.4 hUCMSC-EVs促进施万细胞的迁移
与对照组比较,hUCMSC-EVs预处理后,施万细胞的迁移能力增强(F=101.6,P<0.01);hUCMSC-EVs各浓度之间比较,施万细胞迁移能力随着浓度的增加也显著增加(P均<0.01)。见图4。
2.5 hUCMSC-EVs可被施万细胞内吞
DIO标记的hUCMSC-EVs与施万细胞共孵育24 h后,共聚焦显微镜观察可见,施万细胞的胞质内出现绿色荧光,而对照组没有绿色荧光。说明hUCMSC-EVs可被施万细胞内吞。见图5。

A:迁移的施万细胞(结晶紫染色×100);B:施万细胞迁移的细胞数量;a:P<0.01,与对照组比较;b:P<0.01,与5 μg/mL EVs比较;c:P<0.01,与25 μg/mL EVs比较

白色箭头指示为DIO标记的EVs
3 讨论
MSCs是源自中胚层和外胚层早期发育的成体干细胞,具有自我更新和多向分化潜能,且来源于多种组织(如骨髓、脐带、脂肪、鼻黏膜等)[8]。然而,在众多来源的MSCs中,hUCMSCs被认为是最有吸引力的一种,具有易于获取、便于体外培养及低免疫原性等优势,其已成为MSCs领域的研究焦点[9-10]。目前,hUCMSCs在多种疾病的治疗和预防中已显示出独特的效果[11]。然而,直接使用hUCMSCs用于治疗仍存在潜在的危险因素,如促瘤[12]和血栓形成[13]。
EVs具有膜性结构,负载蛋白质、脂质和RNA, 能够与受体细胞结合,进而传递内容物引发下游信号激活及细胞间通讯等效应[1]。EVs可由多种细胞分泌,且表达CD9、CD63、CD81等保守蛋白[12-14]。在本研究中,我们采用超高速离心法提取hUCMSCs上清液中的EVs,透射电镜结果显示,EVs呈圆形或椭圆形的膜性结构,且表达EVs特异性分子标志物CD9和CD63。然而,对照组同样表达CD9和CD63,这可能与EVs来源于hUCMSCs细胞膜有关。EVs无细胞核,致瘤可能性极低,也可解决临床给药过程中的栓塞问题,且兼具MSCs表面标志及趋化特性等优势,说明MSC-EVs可作为替代MSCs治疗的新策略。
施万细胞是周围神经系统特有的神经胶质细胞,包绕外周神经轴突形成髓鞘并为神经轴突提供营养支持。周围神经损伤后,施万细胞去分化形成前体细胞并大量增殖和迁移,为轴突的再生提供微环境[7]。因此,基于施万细胞增殖和迁移修复周围神经损伤已成为潜在的治疗靶点。近年来MSC-EVs已成为再生医学的研究热点, 基于MSC-EVs对周围神经损伤修复的相关报道日益增多。Vesna等[15]发现,大鼠脂肪MSCs源EVs显著促进施万细胞的增殖及神经轴突的生长。Rao等[16]发现,人牙龈MSCs源EVs促进背根神经节神经元的生长,且促进施万细胞的增殖。然而,Zhou等[17]研究发现,大鼠骨髓来源的EVs抑制RSC96(永生化的大鼠施万细胞系)的增殖和迁移,这种MSCs对施万细胞增殖和迁移结果的差异可能与MSCs的来源以及施万细胞类型不同有关。本课题组前期研究发现,大鼠尾静脉注射hUCMSC-EVs后,能趋化到坐骨神经受损部位并显著促进施万细胞包绕神经轴突形成髓鞘[6]。然而hUCMSC-EVs是否通过促使施万细胞的增殖和迁移,从而促进坐骨神经修复仍然不明。
本实验提取了大鼠原代施万细胞并应用不同浓度的hUCMSC-EVs处理,结果表明hUCMSC-EVs显著促进了施万细胞的增殖和迁移。研究发现[18],EVs对受体细胞的作用方式有① 与表面受体的结合; ② 传递EVs负载的内容(miRNA、mRNA、蛋白); ③ 通过靶细胞对EVs的内吞。在本研究中,我们通过共聚焦显微镜观察,DIO标记的EVs在施万细胞的胞质中大量聚集,提示EVs被施万细胞内吞,可能启动了施万细胞下游的信号,从而促进施万细胞的增殖和迁移。然而,EVs内吞后如何影响施万细胞增殖和迁移的潜在机制仍然需要进一步探究。
综上所述,hUCMSC-EVs可显著促进施万细胞的增殖和迁移且呈浓度依赖,这种作用机制可能与hUCMSC-EVs被施万细胞内吞有关。

