人神经干细胞微囊泡对谷氨酸诱导PC12细胞损伤的保护作用
余佳红, 童玉, 叶开, 陈天琰, 唐彬, 胡嘉波
(江苏大学医学院, 江苏 镇江 212013)
脑卒中的致病机制非常复杂,其中谷氨酸兴奋性毒性是神经损伤的重要病理机制[1]。谷氨酸是中枢神经系统中最重要的一类神经兴奋性递质[2],可作为哺乳动物中枢神经系统的主要神经递质,在缺血性脑卒中的发生发展中起重要作用[3]。当脑缺氧缺血造成神经细胞损伤后,大量谷氨酸释放至突触间隙,引起谷氨酸受体过度激活,使Ca2+不断内流,发生DNA损伤和细胞凋亡等一系列级联反应,最终导致神经元兴奋性毒性的发生[4-5]。谷氨酸生理浓度不会造成神经元损伤,但是病理情况发生时,谷氨酸过度积累会造成神经元过度兴奋,最终导致其坏死、凋亡[6]。目前治疗脑卒中的方法主要通过切断兴奋性毒性的传递途径来改善卒中恢复[7-8]。微囊泡是由亲本细胞分泌的一种活性物质,直径为100~ 1 000 nm的双层脂质囊泡,具有便于冻存、安全、低免疫原性等优点[9]。然而,人神经干细胞微囊泡(human neural stem cell microvesicles, hNSC-MVs)是否具有神经元保护作用尚不清楚。因此,本实验建立谷氨酸体外损伤模型,研究hNSC-MVs对谷氨酸诱导PC12细胞损伤的保护作用。
1 材料与方法
1.1 材料
大鼠肾上腺髓质嗜铬细胞瘤PC12细胞购于中国科学院细胞库;人神经干细胞由课题组先前研究获得[10];DMEM、DMEM/F12培养液、胎牛血清(美国Gibco公司);非必需氨基酸、B27(加拿大Stemcell Technologies公司);重组人碱性成纤维细胞生长因子、表皮生长因子(美国PeproTech公司);基质胶(美国Corning公司);谷氨酸(国药集团化学试剂有限公司);MTT试剂(美国Amresco公司);0.45 μm PVDF膜(德国Merck Millipore公司);兔抗大鼠Bax、小鼠抗大鼠Bcl-2和兔抗大鼠β-肌动蛋白一抗、山羊抗兔和山羊抗小鼠二抗(英国Abcam公司);BCA试剂盒、RIPA裂解液(上海碧云天生物技术公司);蛋白酶抑制剂PMSF(南京福麦斯公司);牛血清白蛋白(上海源叶公司);细胞膜红色荧光探针(Dil,美国Sigma公司);4′,6-二氨基-2-苯基吲哚(DAPI,美国Thermo Fisher公司)。
CO2细胞培养箱(德国Memmert公司);超净工作台(上海博讯实业有限公司);倒置显微镜(南京永新光学有限公司);超高速低温离心机(美国Beckman Coulter公司);酶标仪(美国Bio-Tek公司);蛋白电泳仪、垂直电泳槽(美国Bio-Rad公司);化学发光成像系统(法国Vilber公司);FV1000激光扫描共聚焦显微镜(日本Olympus公司);纳米颗粒跟踪分析仪(英国NanoSight公司)。
1.2 方法
1.2.1 细胞培养 人胚胎干细胞源神经干细胞由课题组前期研究所得,参考Chen等[10]方法培养。神经干细胞生长于基质胶,并维持在神经干细胞培养基中,即含有1%非必需氨基酸,2% B27、20 μg/L重组人碱性成纤维细胞生长因子和20 μg/L表皮生长因子的DMEM/F12。PC12细胞培养于含10%胎牛血清的DMEM中。
1.2.2 微囊泡的分离及粒径分析 微囊泡分离程序如先前所述进行[11]。首先收集神经干细胞条件培养液,于4 ℃以2 000×g离心30 min,以除去细胞碎片或沉淀杂质;随后于4 ℃以100 000×g离心70 min;弃上清液,用PBS洗涤;同样条件下重复2次之前超速离心步骤,最后弃上清液,用100 μL PBS重悬沉淀,即hNSC-MVs,-80 ℃储存备用。BCA试剂盒检测hNSC-MVs蛋白浓度。将微囊泡注入仪器样品室,用纳米颗粒跟踪分析仪分析hNSC-MVs粒径。每个样品重复3次。
1.2.3 PC12细胞内化hNSC-MVs 将hNSC-MVs在37℃下用Dil标记15 min;PBS洗涤3次;4 ℃以100 000×g离心2 h;将Dil标记的hNSC-MVs(20 mg/L)加入PC12细胞中,孵育24 h;PBS洗涤3次;用DAPI进行核染色;细胞图像通过激光扫描共聚焦显微镜获得。
1.2.4 PC12细胞损伤模型的建立及分组
1.2.4.1 谷氨酸浓度的选择 用含不同浓度的谷氨酸(0、5、10、15、20、25 mmol/L)无血清培养基处理PC12细胞24 h,用MTT分析细胞存活率;其中25 mmol/L谷氨酸处理24 h后细胞存活率降低至50%,选择该浓度建立谷氨酸兴奋性损伤模型进行下一步实验。
1.2.4.2 实验分组 实验分为3组,对照组:DMEM预处理24 h,弃培养液,加入无血清DMEM;谷氨酸组:DMEM预处理24 h,弃培养液,加入含25 mmol/L谷氨酸的无血清DMEM刺激24 h;hNSC-MVs+谷氨酸组:含200 mg/L hNSC-MVs的DMEM预处理24 h,弃培养液,加入含25 mmol/L谷氨酸的无血清DMEM继续培养24 h。
1.2.5 MTT法检测PC12细胞存活率 将PC12细胞以1×104/mL密度接种于96孔板中,于37℃、5%CO2培养箱培养,待细胞贴壁后,用PBS洗3遍;按“1.2.4.2”分组处理;每孔加入20 μL MTT溶液(5 g/L),孵育4 h;弃培养液,每孔加入150 μL二甲基亚砜振荡10 min,使蓝紫色结晶完全溶解;用酶标仪测定490 nm波长处光密度(D)值,并计算细胞存活率。细胞存活率(%)=(实验组D值-空白组D值)/(对照组D值-空白组D值)×100%。
1.2.6 免疫印迹实验检测Bax和Bcl-2蛋白表达 PC12细胞接种于6孔板,按“1.2.4.2”实验分组处理;弃上清液,用预冷PBS洗涤3次;加入100 μL含1 mmol/L PMSF蛋白酶抑制剂的RIPA裂解液,用细胞刮刀充分刮取6孔板中的细胞,将细胞裂解液收集于EP管中,置于冰上裂解1 h;期间每15 min漩涡振荡1次;样本于4℃以12 000×g离心15 min;取上清液,采用BCA试剂盒测定蛋白质含量。取适量蛋白质样品行SDS-PAGE;70 V电泳30 min后调至110 V继续电泳60 min;350 mA湿转90 min至PVDF膜;用含5%脱脂奶粉的TBST孵育1 h;加入一抗于4 ℃孵育过夜,β-肌动蛋白抗体(1 ∶ 5 000)、Bax抗体(1 ∶ 1 000)和Bcl-2抗体(1 ∶ 1 000);TBST洗膜3次,每次15 min;用HRP标记的二抗(1 ∶5 000)室温孵育1 h;TBST洗膜3次,每次15 min;最后对条带进行曝光显影。实验重复3次。
1.3 统计学分析
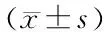
2 结果
2.1 神经干细胞形态和微囊泡粒径分析
倒置显微镜观察结果显示,神经干细胞在基质胶生长,细胞大小均一,集落呈典型的玫瑰花环结构。纳米微粒跟踪分析显示,hNSC-MVs颗粒浓度为7.4×108颗粒/mL,直径为50~1 000 nm,平均为141.7 nm。见图1。
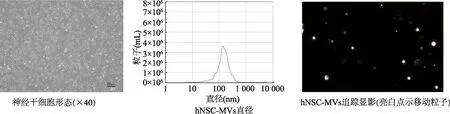
图1 神经干细胞和神经干细胞微囊泡
2.2 PC12细胞内化神经干细胞微囊泡
倒置显微镜观察结果显示,正常PC12细胞呈多边形贴壁生长,有明显的胞体,有类似神经突触的细胞突起结构。PC12细胞与Dil标记的hNSC-MVs孵育24 h后,激光共聚焦显微镜观察结果显示,PC12细胞胞质中能观察到Dil标记的红色荧光,表明PC12细胞能内化hNSC-MVs。见图2。
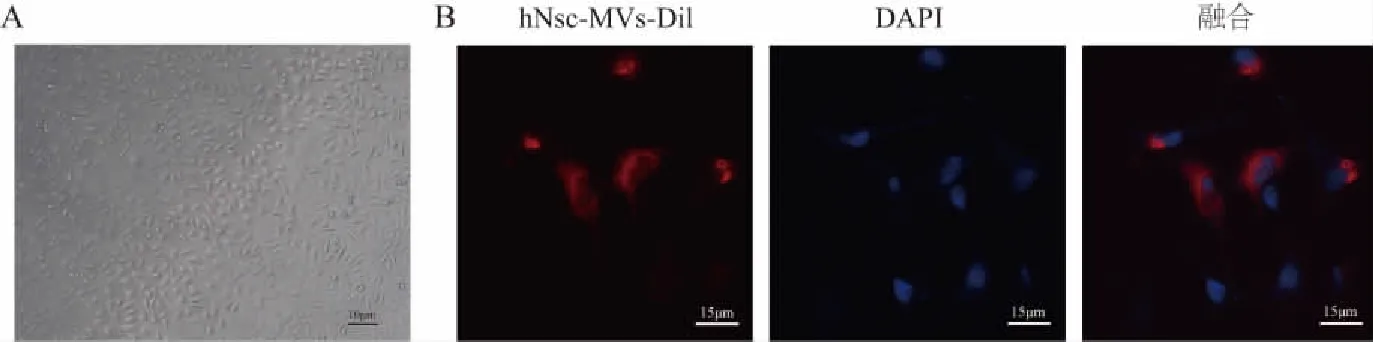
A:PC12细胞形态(×100);B:PC12细胞吞噬Dil标记的hNSC-MVs(×600)
2.3 不同浓度谷氨酸对PC12细胞的损伤作用
MTT检测结果显示,与0 mmol/L组相比,PC12细胞存活率随着谷氨酸浓度增高而降低,呈一定的浓度依赖性。当谷氨酸浓度为25 mmol/L时,PC12细胞存活率为(49.09±6.04)%,显著低于0 mmol/L组(q= 8.467,P<0.01)。因此,选择浓度为25 mmol/L的谷氨酸处理进行后续实验。见图3。
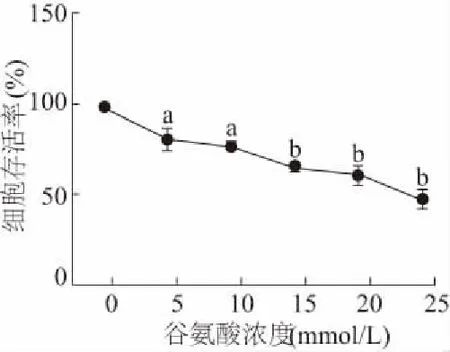
a:P<0.05,b: P<0.01,与0 mmol/L组相比
2.4 微囊泡对谷氨酸损伤PC12细胞存活率的影响
MTT结果显示,与对照组相比,谷氨酸组细胞存活率明显降低(q=22.44,P<0.01),而hNSC-MVs+谷氨酸组细胞存活率较谷氨酸组明显升高(q=12.92,P<0.01),表明hNSC-MVs可明显改善谷氨酸损伤的PC12细胞活性。见图4。
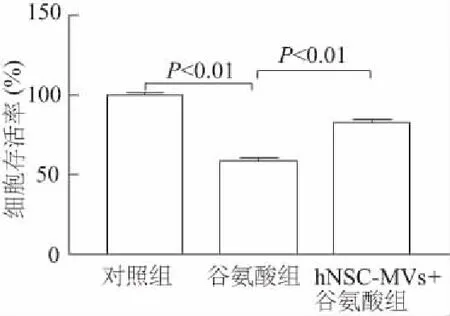
图4 不同组细胞存活率比较
2.5 微囊泡对谷氨酸损伤PC12细胞凋亡的影响
免疫印迹结果显示,与对照组相比,谷氨酸组细胞Bax蛋白表达水平明显升高(q=8.577,P<0.01),Bcl-2表达水平显著降低(q=17.17,P<0.01);与谷氨酸组相比,hNSC-MVs+谷氨酸组细胞Bax表达水平明显降低(q=9.985,P<0.01),Bcl-2表达水平显著增高(q=8.649,P<0.01)。见图5。

图5 不同组细胞Bax和Bcl-2蛋白表达水平比较
3 讨论
PC12细胞是来源于大鼠肾上腺嗜铬细胞瘤克隆的细胞株,在形态、结构和生理功能上都类似于原代神经元细胞,但与原代神经元细胞相比,具有易获取、体外培养简便等优点,因此常用作体外神经元细胞损伤模型的细胞株[12]。谷氨酸诱导PC12细胞损伤模型目前已作为脑缺血缺氧损伤体外研究的常用模型[13-14]。据报道,谷氨酸诱导PC12细胞损伤存在浓度和时间依赖效应,10 μmol/L~40 mmol/L以及5 min~24 h均能对PC12细胞造成不同程度的损伤[15]。文献报道,在体外细胞损伤模型实验中,细胞的抑制率一般维持在50%左右,这样不会因细胞存活率太低或细胞抑制率太低而影响后续实验[16-17]。本实验采用不同浓度的谷氨酸作用PC12细胞24 h,随着谷氨酸浓度增加,PC12细胞抑制作用随之增强,呈浓度依赖性。当谷氨酸浓度为25 mmol/L,作用细胞24 h时,PC12细胞存活率降低至50%左右,故选用25 mmol/L谷氨酸浓度作用24 h来建立细胞损伤模型。
微囊泡是由细胞产生和分泌的双层脂质囊泡,构成细胞间通讯信号分子的主要载体,包括脂质,蛋白质,DNA,mRNA,miRNA,siRNA以及lncRNAs[18]。课题组前期研究结果表明,hNSC-MVs能促进背根神经节神经元轴突生长及坐骨神经横断性损伤修复[10],对心肌细胞也具有抑制其凋亡作用[19],表明hNSC-MVs可能具有强大的保护与修复作用。本研究结果显示,Dil标记的hNSC-MVs能被PC12细胞吞噬,表明微囊泡能进入细胞内部从而发挥功能。此外,与谷氨酸组相比,一定浓度的hNSC-MVs能显著增强谷氨酸损伤的PC12细胞的细胞活性,表明hNSC-MVs对谷氨酸损伤的PC12细胞表现出明显的保护作用。抗凋亡蛋白Bcl-2和促凋亡蛋白Bax是目前已知的最重要的一对凋亡调控蛋白,两者形成二聚体起到调控凋亡的作用,比例失调时则会影响细胞凋亡[20]。本实验发现hNSC-MVs处理可显著提高Bcl-2蛋白表达,同时降低Bax蛋白表达,表明hNSC-MVs可能通过Bcl-2/Bax信号通路对谷氨酸诱导的PC12细胞损伤发挥保护作用。但是PC12细胞不能完全替代原代培养的神经元,需要直接在体外原代神经元和动物模型上做验证,以进一步明确hNSC-MVs的保护作用,具体作用机制有待进一步研究。

