大豆发芽过程中过敏原蛋白和脲酶活性的变化
王梦莉 高美须 姜小燕 彭 湃
(中国农业科学院农产品加工研究所/农业农村部农产品质量安全收贮运管控重点实验室,北京 100193)
豆芽是我国人民喜食的一种传统优质蔬菜,营养丰富并且具有保健功能。东方人食用豆芽已经有两千多年的历史。在欧洲各个国家,豆芽也常作为美食原料和开胃小菜,颇受欢迎。大豆发芽后,在各种内源性蛋白酶的催化作用下,种子内部贮藏的大分子物质可转化为可溶的简单成分,因此,发芽处理有利于豆类中的营养物质被人体吸收利用。此外,发芽能有效改善大豆营养结构,富集功能活性成分,并降低抗营养因子。研究表明,大豆在萌芽过程中,其抗营养因子[1-3],如胰蛋白酶抑制剂、脂肪氧合酶、植酸、胰凝乳蛋白酶和寡糖等的含量降低甚至消失[4],而维生素、植物甾醇、生育酚、异黄酮和γ-氨基丁酸等含量增加[5-7]。
大豆因营养丰富(40%蛋白质和20%脂肪)在食品加工以及饲料行业有着广泛的应用[8]。抗营养因子的存在极大地降低了大豆的营养价值和食用价值,如大豆胰蛋白酶抑制剂和大豆凝集素可降低大豆的营养价值和消化率;大豆过敏会引起胃肠道紊乱、过敏性皮炎甚至休克和死亡[9]。目前,约有0.5%的人群受到大豆过敏的影响[10]。大豆中已鉴定出至少34种过敏原蛋白与IgE结合[5],包括Gly m Bd 30K、β-伴大豆球蛋白以及大豆球蛋白的酸性和碱性链[11-12]。大豆主要致敏蛋白按沉降系数可分为11S、7S和2S 3种,其中大豆球蛋白属于11S组分,β-伴大豆球蛋白、Glym Bd 30K和Glym Bd 28K属于7S组分。
大豆制品分布广泛,完全避免大豆食品的摄入对大豆过敏患者来说不是行之有效的方法,因此需通过一定的食品加工手段消减大豆中的致敏成分。研究发现,发芽是一种降低致敏原的有效方式[13-14]。Wu等[15]研究发现大豆中的主要过敏原在大豆发芽3 d后完全降解;杨慧[16]分别用大豆芽蛋白和大豆蛋白对小鼠进行口服致敏试验,发现发芽大豆灌胃的小鼠组中只有部分小鼠出现了过敏症状。基于此,本研究利用兔抗大豆多克隆抗体和大豆过敏病人血清,运用免疫学方法探究大豆发芽过程中大豆蛋白的抗原性及过敏原性变化,利用脲酶活性变化探究抗营养因子的变化规律,以期为进一步开发营养丰富的大豆低致敏性食品提供理论基础。
1 材料与方法
1.1 材料与试剂
大豆购自中耕沐民有限公司;磷酸二氢钠、磷酸氢二钠、氯化钾、氯化钠,分析纯,购自北京瀚城生物有限公司;磷酸盐缓冲液干粉(phosphate buffered saline,PBS,pH值7.2~7.4)2 L装、Tris-HCl缓冲盐溶液(Tris-HCl buffered saline,TBS,pH值7.2~7.4)、蛋白Marker、30%凝胶储液、辣根过氧化酶(horseradish peroxidase,HRP)标记羊抗兔、HRP标记羊抗人、Bradford蛋白测定试剂盒、二氨基联苯胺(diaminobenzidine,DAB)显色试剂盒,均购自北京索莱宝技术有限公司;抗大豆兔多克隆抗体由农业农村部农产品质量安全收贮运管控重点实验室自制;大豆过敏病人血清来自北京协和医院。
1.2 仪器与设备
TGL-16A高速冷冻离心机,长沙平凡仪器厂;WD-9405B型水平摇床、DYCN-24D型垂直电泳槽、DYCZ-40D转印芯,北京六一仪器厂;I-mark型酶标仪、1575型洗板机,美国BIO-RAD公司;DHG-9140A电热鼓风干燥箱,北京陆西科技有限公司。
1.3 试验方法
1.3.1 大豆发芽条件 参照文献[17-18]的方法,略作改进。挑选成熟饱满的大豆,清水冲泡3遍,25℃黑暗条件下用蒸馏水浸泡3 h,挑选吸水良好、无破损的大豆置于20±1℃培养箱中,黑暗条件下发芽。为防止病菌滋生,每隔24 h用自来水清洗。每隔24 h取样,共取样7次。取样后将样品分为全豆芽、豆芽根部和豆芽顶部,用液氮速冻后于-20℃冰箱保存。
1.3.2 大豆蛋白提取 参照Isabel等[19]的方法,稍作修改。分别取1 g全豆芽、豆芽根部和豆芽顶部样品,加入10 mL PBS(pH值7.4)在液氮中研磨,40℃水浴超声15 min,3 000 r·min-1离心15 min,取蛋白上清于-20℃冰箱冻存。
1.3.3 发芽过程中全株豆芽可溶性蛋白含量和组分测定 参照Bradford蛋白质定量试剂盒的说明书,测定全豆芽提取液中蛋白质浓度。具体方法如下:完全溶解蛋白标准品,将溶解后的蛋白标品溶液分别稀释至 0、0.02、0.04、0.06、0.08、0.12、0.16、0.20 mg·mL-1,于酶标板每孔加入20μL稀释好的蛋白标品溶液,然后加入200μL稀释后的1×G250染色液,室温放置3~5 min后用酶标仪在595 nm波长处测定吸光度值,制作标准曲线。将1.3.2提取的样品溶液稀释30倍,每个样品设置3个重复,测定蛋白含量。
参照许舒婷[20]的方法,采用聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,SDS-PAGE)分析大豆发芽过程中蛋白组分变化,参数如下:分离胶浓度12%、浓缩胶浓度5%、凝胶厚度1 mm。将不同部位的豆芽样品蛋白提取液稀释至1 mg·mL-1,与上样液混合后,沸水煮3 min,待样品冷却后3 000 r·min-1离心3 min用于电泳分析,上样量为15μL,Marker上样量为5μL。设定电泳条件为恒压浓缩胶80 V、分离胶120 V。电泳结束后,进行剥胶、染色、脱色,随后拍照。
1.3.4 发芽过程中大豆蛋白的抗原性测定
1.3.4.1 免疫印迹法 采用免疫印迹法检测大豆发芽过程中大豆过敏IgG结合能力。全豆芽、豆芽根部和豆芽顶部蛋白粗提液通过SDS-PAGE电泳分离后,采用夹心法转膜,恒流96 mA电转移120 min,转移完成后取出NC膜。已转印的NC膜[TBST(Tris-buffered saline and Tween 20)稀释的含5%脱脂奶粉]用室温摇床封闭2 h后,用TBST洗涤5次。加入一抗1∶100稀释的兔抗大豆蛋白血清,室温孵育90 min,用TBS洗涤5次,每次10min。加入二抗HRP标记(1∶1 000稀释的HRP标记羊抗人或羊抗兔)室温孵育1 h,用TBST洗膜5次,每次5 min,再用1×TBS洗涤2次,每次5 min。采用DAB避光显色1 min,用蒸馏水洗涤3次,每次5 min以终止反应。显色之后,及时拍照。
1.3.4.2 间接竞争酶联免疫 间接竞争ELISA测定发芽过程中全豆芽、豆芽根部和豆芽顶部中蛋白的抗原性变化。兔多克隆抗体的制备参照许舒婷[20]的方法。利用棋盘法确定最佳包被浓度及抗体最佳稀释倍数,大豆全蛋白抗原最佳包被浓度为1μg·mL-1,兔抗大豆蛋白多克隆抗体血清1∶10 000稀释。抗原蛋白加入到96孔酶标板于4℃冰箱包被过夜。次日取出,用含0.05%吐温-20的PBS自动洗涤5次。之后每孔加入含5%脱脂奶粉的封闭液,37℃封闭2 h。自动洗板机洗涤5次。然后加入50μL样品蛋白和50μL 1∶10 000稀释的兔抗大豆蛋白血清,空白对照组以PBS替代竞争蛋白参与反应,不加抗原或样品的反应孔为无竞争反应体系,37℃孵育1 h,自动洗涤5次。加入100μL PBST稀释(1∶5 000)的酶标二抗,37℃孵育1 h,洗涤,然后加入邻苯二胺底物显色液于37℃反应15 min,最后加入2 mol·L-1硫酸终止反应,并立即用酶标仪测定450 nm波长处的吸光度值。按照公式计算lgG抑制率:
式中,B为不同发芽时间大豆蛋白的OD值;B0为无竞争蛋白时的OD值。
1.3.5 发芽过程中大豆蛋白的过敏原性测定
1.3.5.1 免疫印迹法 免疫印迹法检测大豆发芽过程中大豆过敏IgE结合能力。方法同1.3.4.1,其中一抗稀释倍数为1∶50,二抗稀释倍数为1∶1 000。
1.3.5.2 间接竞争酶联免疫法 挑选出7份IgE含量>0.35 kU·L-1的大豆过敏患者血清,等体积混合后,形成大豆蛋白过敏患者血清池。阴性血清取自对大豆不过敏的健康患者。其他步骤同1.3.4.2,其中一抗人血清稀释倍数为1∶2 000,二抗稀释倍数1∶5 000,IgE抑制率按照公式(1)计算。
1.3.6 脲酶活性测定 参照GB/T 8622-2006[21]测定。因全脂大豆脲酶活性较高,所以将全豆芽的称样量由标准中的0.1 g调整为0.050 g,反应时间缩短至10 min。
1.3.7 数据分析 每个样品测定3次,数据分析采用Excel 2016软件统计分析,结果以平均值±标准偏差的形式表示。
2 结果与分析
2.1 大豆发芽过程中可溶性蛋白含量和组分的变化
由图1可知,随着发芽时间的延长,大豆芽可溶性蛋白含量(湿基)呈下降趋势;大豆芽可溶性蛋白含量(干基)除第5天有轻微下降外总体呈上升趋势,在发芽第4天达到最高,为种子中的3倍。
由图2可知,在大豆发芽过程中,蛋白组分在发芽第2天后开始发生较明显的变化,大分子量的蛋白组分,如β-伴大豆球蛋白(7S)的α(72 kDa)和α′亚基(76 kDa)及球蛋白的酸性亚基(35~43 kDa)逐渐降解,条带变淡。在α和β亚基之间,大豆球蛋白的酸性亚基与碱性亚基(20-22 kDa)条带之间以及20 kDa附近位置,蛋白条带逐渐增多。在分子量略高于β-伴大豆球蛋白的β亚基位置,出现许多条带,且含量逐渐增加。在球蛋白的酸性亚基和碱性亚基附近新出现的蛋白条带应是贮藏蛋白降解的产物,而非新蛋白的生成。大豆球蛋白的β亚基和大豆球蛋白的碱性亚基变化较小。
由图3可知,与未发芽大豆相比,豆芽顶部在发芽第4天发生了较大的变化,大部分蛋白条带变淡,只有位于β亚基上方的条带加深。大豆球蛋白酸性亚基上方的条带在发芽第4天的豆芽顶部中完全消失。酸性亚基和碱性亚基之间出现了较多弥散的蛋白条带。在豆芽根部中大豆球蛋白的亚基条带和β-伴大豆球蛋白的3个亚基条带均未出现。
由此可知,发芽前3 d豆芽可溶性蛋白(干基)增多(图1)是由于部分蛋白降解,且在发芽过程中β-伴大豆球蛋白的α和α′亚基和球蛋白的酸性亚基优先降解,β亚基变化较小,这些逐渐降解的蛋白都是大豆中的主要贮藏蛋白。
2.2 发芽过程中的抗原性分析
2.2.1 免疫印迹—IgG结合能力分析 由图4可知,随着发芽时间的延长,与IgG结合的蛋白条带逐渐减少,且条带颜色变浅,说明IgG结合能力逐渐降低。相较于未发芽的大豆,发芽第4天开始,在35~48 kDa之间的2个条带逐渐消失,丧失免疫原性。大豆球蛋白的酸性亚基和碱性亚基在发芽过程中的抗原性变化较小。在α和β亚基之间、酸性和碱性亚基之间以及20 kDa附近位置,免疫印迹条带逐渐变粗变淡,这与SDS-PAGE图一致。
由图5可知,Gly m Bd 30K(34 kDa)在豆芽根部占据较大比例,为根部的主要过敏原。该条带在根部中的降解速率较慢,在发芽第7天的豆芽根部中依然存在。虽然SDS-PAGE图显示在豆芽根部未观察到致敏蛋白条带,但豆芽根部仍有免疫印迹条带,具有抗原性。此外,大豆球蛋白的酸性亚基在豆芽顶部中颜色较深,为顶部的主要过敏原。未发芽的大豆和发芽过程中的大豆(包括豆芽顶部和根部)均可与抗大豆兔血清中抗体反应,说明大豆中的蛋白在发芽之后依然具有抗原性。
2.2.2 间接竞争酶联免疫分析 利用免疫印迹检测过敏蛋白与IgG结合的能力时,一些小分子量的蛋白未被检测到,但不能排除这些小分子量的蛋白具有与IgG结合的可能性,因此,本研究同时也采用灵敏性更高、特异性更强的间接竞争酶联免疫来检测发芽后大豆蛋白的致敏性。由图6可知,发芽7 d内全豆芽抗原性总体呈下降趋势,这与免疫印迹的结果相符。与未发芽大豆的IgG抑制率(29.00%)相比,浸泡3 h时全豆芽IgG抑制率降低5.30个百分点;随着发芽时间的延长,IgG抑制率进一步降低,发芽第5天时IgG抑制率降低11.32个百分点。在萌芽初期,经过浸泡吸水膨胀,其种子内源酶被激活,氮代谢加剧,贮藏蛋白质逐渐被蛋白酶降解,这个过程中可能使得某些抗原表位被破坏,IgG结合能力降低。由表1可知,豆芽顶部的IgG抑制率总体呈下降趋势,与未发芽大豆相比,发芽第7天时豆芽顶部的IgG抑制率降低了10.20个百分点;在发芽第4天时,豆芽根部的IgG抑制率降低了22.31个百分点,随后略微升高,但增幅较小。
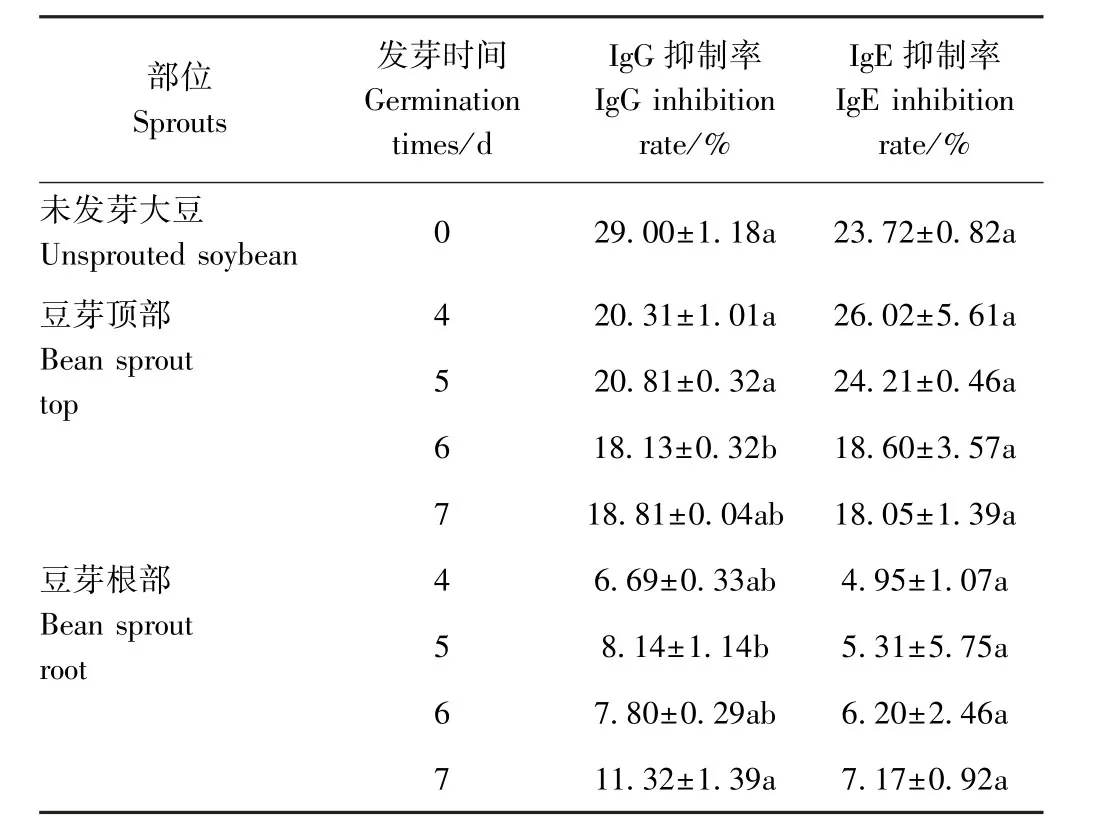
表1 大豆发芽过程中豆芽顶部和根部的抗原性和过敏原性变化Table1 Antigenic and allergenic changes in the top and root of bean sprouts during soybean germination
2.3 发芽过程中的过敏原性分析
2.3.1 免疫印迹—IgE结合能力分析 由图7可知,IgE免疫印迹图与IgG免疫印记图及SDS-PAGE电泳图有所不同,出现更多小条带。在24 kDa及46 kDa附近出现了在电泳图中未显示的新条带,这2个条带的免疫印迹在发芽4 d后逐渐消失。免疫印迹图中最深的条带在Glym Bd 30K,随着发芽时间的延长,该条带先变淡后加深,在发芽第4天后,与IgE结合能力逐渐增强。在大豆发芽过程中大豆球蛋白显示出的IgE结合能力较弱,免疫印迹条带不清晰。发芽期间,大豆中的多条致敏原条带在发芽第4天后逐渐消失,如35~48 kDa之间的2条。由图8可知,在豆芽的顶部中,大豆球蛋白的酸性亚基的IgE结合能力低于碱性亚基的结合能力,且碱性亚基的结合能力逐渐增强。从发芽4~7 d的豆芽根中可以看出,免疫印迹的条带普遍逐渐加深,在发芽第7天时最深,这与表1中的酶联免疫结果一致,即发芽第4天的根部致敏性最低。由图8可知,在根部出现一条高分子量条带100 kDa可以与病人IgE结合,并不能确定是否为脂肪氧化酶。由7图可以看出Gly m Bd 30K有很强的IgE结合能力。结合IgG免疫印迹结果可知,发芽第5天的豆芽致敏性最低。
2.3.2 间接竞争酶联免疫分析 采用间接竞争抑制ELISA检测不同发芽时间的豆芽蛋白的过敏原性,结果如图9所示。发芽期间全豆芽蛋白的致敏性呈先降低后升高,随后下降又有所回升的趋势,整体表现为下降趋势,这与抗原性结果一致。与未发芽大豆的IgE抑制率23.72%相比,发芽第5天时豆芽中的IgE抑制率降低了13.73个百分点。由表1可知,豆芽顶部中的IgE抑制率逐渐降低,与未发芽大豆相比,发芽4 d时芽顶部的IgE抑制率降低了2.29个百分点;发芽4 d时豆芽根部的IgE抑制率降低了18.77个百分点,随后豆芽根部的IgE抑制率逐渐升高。从试验数据来看,豆芽根部在第4天的抑制率降低最多,即IgE结合能力最弱,致敏性最低。发芽使得大豆蛋白的IgE结合能力降低是因为在大豆发芽的过程中,贮藏蛋白发生降解,导致大豆致敏原蛋白的表位抗原被降解或掩埋,因此其与IgE结合能力减弱。综上,全豆芽、豆芽根部、豆芽顶部分别在发芽第5、第4和第5天时,致敏蛋白的过敏原性最低。因此,可以以发芽第5天的豆芽为基础材料,以酶解或其他加工方式降低大豆制品中的过敏原,研发低致敏食品。
2.4 脲酶活性分析
脲酶活性常用来衡量大豆及大豆制品的营养品质。由图10可知,随着大豆发芽时间的延长,全豆芽中脲酶含量呈先大幅度降低后略微升高再小幅度下降的趋势。与未发芽大豆相比,发芽1 d的全豆芽中脲酶含量下降明显,下降了32.63%;发芽第5天时脲酶含量降至最低值(1.26 U·g-1),较未发芽大豆脲酶活性下降了73.13%。
3 讨论
本研究结果表明,全豆芽发芽7 d的过程中,可溶性蛋白(湿基)含量逐渐降低,这与郭元新等[22]的研究结果一致。这主要是因为大豆发芽过程需要大量的营养物质和能量,在种子未进行光合作用之前,这些能量主要来源于种子中贮藏物质的降解和转化,而蛋白质是大豆中贮藏物质的重要组分之一。大豆发芽过程中豆芽含水量不断增加,大豆内源酶活性被激活,氮代谢加剧,贮藏蛋白质逐渐被蛋白酶降解,产生多肽及游离氨基酸。
大豆过敏原蛋白分子量在70~71 kDa之间,其中,大豆球蛋白和β-伴大豆球蛋白是免疫原性最强的人类过敏原蛋白,也是引起幼龄动物出现过敏反应的主要因素[10]。本研究发现在大豆发芽过程中贮藏蛋白β-伴大豆球蛋白的α、α′亚基降解较快,β亚基变化较小。在发芽初期以大分子蛋白的降解为主,随着发芽时间的延长,以小分子蛋白的变化为主。Kim等[23]研究大豆发芽过程也发现β-伴大豆球蛋白的α和α′亚基在发芽96 h内基本消失,而β亚基降解速率最慢。研究还发现β-伴大豆球蛋白比大豆球蛋白更易发生降解,分析蛋白结构发现,大豆球蛋白是分子质量为320~360 kDa的六聚体,是由6个酸性多肽链(A1a、A1b、A2、A3、A4、A5)和5个碱性多肽链(B1a、B1b、B2、B3、B4)构成的2个环状,六角形结构使得其具有一定刚性[12]。β-伴大豆球蛋白由3个亚基组成,更易受到外界的影响而发生聚合和解聚,这可能是大豆球蛋白和β-伴大豆球蛋白降解速率不同的原因。由蛋白的电泳图可知,大豆蛋白和发芽后的大豆蛋白以及豆芽的根部均与抗大豆兔血清IgG产生免疫结合反应,说明大豆蛋白和发芽后的大豆蛋白都具有免疫反应性。然而,使用一维凝胶不能进一步深入了解大豆球蛋白和β-伴大豆球蛋白各亚基的变化,还需要使用二维电泳结合质谱进一步分析。
在大豆萌芽过程中,温度是影响大豆芽长势的关键因素之一。温度高,种子萌发快,根更长。杨慧[16]研究发现,在20℃、25℃和30℃条件下发芽5 d的大豆芽中致敏原的IgG结合能力分别降为58%、47%和50%,豆芽蛋白的IgG结合能力逐渐减弱。本研究中,豆芽在20℃条件下发芽5 d时豆芽根芽长约6 cm,在发芽过程中,全株豆芽的IgE抑制率较未发芽大豆下降了13.73个百分点,IgG抑制率下降了11.32个百分点,表明其过敏原性降低了54%,抗原性下降了44%,全豆芽中的过敏原含量最低;发芽第4天时,豆芽根部的致敏蛋白的免疫反应性下降明显,致敏蛋白过敏原性下降了80%,抗原性下降达到76.92%。考虑到市售豆芽根长约为6 cm,对于大豆过敏的患者来说,可单独食用豆芽根部,以降低过敏反应。
发芽可以改变谷物营养成分的组成,也能降低抗营养因子,提高谷物的营养价值[24]。大豆含有多种抗营养因子,包括热不稳定性抗营养因子(胰蛋白酶抑制因子、大豆凝集素、低聚糖、脲酶)、抗维生素因子以及热稳定性抗营养因子(大豆球蛋白、β-伴大豆球蛋白、异黄酮、单宁、植酸、皂甙)等[25]。脲酶是一种含镍的寡聚酶,能够催化尿素水解释放出氨和二氧化碳,其在植物中分布广泛,尤其在大豆和刀豆中[26-27]。有研究表明,在加热过程中,脲酶和胰蛋白酶抑制因子会因变性而被灭活,且二者活性存在一定的线性关系[28],一般通过测定豆粕中的脲酶活性可间接衡量豆粕中胰蛋白酶抑制因子的活性。另外,国家颁布的有关大豆制品中抗营养因子的检测标准中均以脲酶活性作为大豆制品的抗营养因子指标,用于评判大豆及大豆制品的加工程度和营养品质,因此脲酶活性可以在一定程度上衡量大豆抗营养因子包括致敏原的变化[29]。本研究结果表明,大豆发芽5 d后,其脲酶活性下降到最低,降低了67%,此时豆芽中的抗营养因子含量较低,适宜开发易吸收、低致敏的大豆食品。
4 结论
本研究结果表明,随着大豆发芽时间的延长,豆芽中致敏原的致敏性持续降低,因此发芽是降低大豆致敏原的一种简便高效方法。此外,在20℃条件下发芽,当豆芽长约6 cm时,其致敏蛋白过敏原性、抗原性和脲酶活性均明显降低,豆芽根部中的致敏性较未发芽大豆降低了80%,此时适宜开发低敏营养的大豆食品。

