车前草花叶病毒衣壳蛋白的原核表达和多克隆抗体制备
苏学思,张玉宝,王若愚,王亚军,唐国亮,金卫杰
(1.中国科学院 西北生态环境资源研究院皋兰生态与农业综合试验站,甘肃 兰州730000; 2.中国科学院大学,北京100049)
车前草花叶病毒(Plantagoasiaticamosaicvirus,PlAMV)由Minskaya等[1]于1977年在俄罗斯远东地区的车前草上首次发现,后来被证实是侵染百合的重要病毒之一。PlAMV属于甲型线状病毒科(Alphaflexiviridae)马铃薯X病毒属(Potexvirus)成员,在透射电子显微镜下可观察到丝状的病毒颗粒,其大小约为(490~530)nm × (11~13)nm[2]。该病毒基因组由一条正义单链RNA组成,长度约为6 100 nt,共编码5个开放阅读框(open reading frame,ORF)[3]。ORF1编码RNA依赖的RNA聚合酶(RNA-dependent RNA polymerase,RdRp),主要负责病毒核酸的复制[4]。ORF2、ORF3和ORF4分别编码230、110、121个氨基酸,组成了三基因连锁结构(triple gene block proteins,TGBp),能够帮助病毒在植物细胞间移动,并抑制植物的基因沉默作用[5-6]。ORF5由624个核糖核苷酸组成,编码病毒的衣壳蛋白(capsid protein,CP),该蛋白由207个氨基酸构成,是病毒主要的结构蛋白,和病毒的移动与侵染有关[7]。
2010年荷兰首次报道了PlAMV对百合生长的危害,随后该病毒在美国、日本、意大利和智利等国家的百合上被相继检出[8-13]。PlAMV能通过土壤和机械传播,被侵染的杂草也具有传播该病毒的可能[14]。PlAMV的土壤传播可能与植物根的吸收或渗出有关,但不清楚是否存在传播媒介[8]。此外,PlAMV寄主广泛,能侵染16科的植物,其中,百合、报春花、南天竹、地黄、樱草、紫花堇菜等皆为重要的中药材或花卉作物[9]。受PlAMV侵染的百合,初期症状主要表现为花叶、锈斑、叶片褪绿等,后期表现为严重坏死、生长缓慢、植株矮化等(图1)[14-16]。在荷兰对PlAMV的报道中,该病毒对温室生长的百合具有更加严重的危害,造成切花出现碎色、条纹症状,产量损失达80%[15]。
田间病毒诊断和监测是百合PlAMV的主要防治措施,为控制病毒危害,迫切需要开发快速、特异、灵敏、高效的病毒检测技术。目前国内外检测PlAMV多采用RT-PCR方法[16-17],该方法特异性强,灵敏度高;但是复杂的操作、对技术人员的高要求,以及对昂贵仪器设备的依赖限制了该方法的推广应用。与之相比,ELISA、胶体金免疫层析等血清学检测方法不仅具备高特异性和高灵敏性的特点,而且操作简单,具备快速检测大批量样品的能力,更适于田间百合病毒的调查和监测[18-19]。通过构建目的基因原核表达载体的方法制备抗原,能克服直接纯化病毒颗粒的困难,显著提高抗原的纯度和浓度,利用这种方法制备的抗体具备更好的特异性和效价。据此,本研究以感染PlAMV的百合为材料,克隆PlAMVcp基因的部分序列,进行序列分析。通过构建PlAMVcp基因的原核表达载体,转化EscherichiacoliBL21(DE3)菌株,经IPTG诱导获得了大量纯化的PlAMV CP融合蛋白,并以此为抗原制备特异性良好的多克隆抗体,以期为PlAMV的血清学检测技术开发和致病机理研究提供一定的参考。
1 材料与方法
1.1 材料和试剂
感染百合无症病毒(Lilysymptomlessvirus,LSV)、黄瓜花叶病毒(Cucumbermosaicvirus,CMV)、百合斑驳病毒(Lilymottlevirus,LMoV)和PlAMV的百合样品,以及感染马铃薯X病毒(PotatovirusX,PVX)的马铃薯样品均由本实验室保存。

图1 感染Plantago asiatica mosaic virus的百合Fig.1 Lily infected with Plantago asiatica mosaic virus exhibiting symptoms of rust-brown necrotic strips and spots
植物总RNA提取试剂盒(RNAprep Pure Plant Kit)购自天根生化科技(北京)有限公司;植物蛋白提取试剂盒购自上海贝博生物科技有限公司;质粒微量抽提试剂盒(E.Z.N.A.®Plasmid DNA Mini Kit Ⅰ)购自Omega公司;逆转录试剂盒(PrimeScriptTMRT Reagent Kit)、DNA回收试剂盒(Agarose Gel DNA Fragment Recovery Kit)和克隆载体pMDTM19-T购自宝生物工程(大连)有限公司;Ni-NTA预装重力柱(Ni-NTA Pre-Packed Gravity Column)和NBT/BCIP碱性磷酸酶显色试剂盒(蓝色)购自生工生物工程(上海)股份有限公司;E.coliDH5α、E.coliBL21(DE3)菌株和表达载体pET-28a(+)由本实验室保存。
1.2 引物设计与PlAMV cp序列的克隆
根据NCBI公布的百合PlAMVcp基因序列(GenBank登录号:KX245539),采用Primer Premier 5软件和Oligo 7软件设计如下特异性引物(下划线表示引入的酶切位点BamH Ⅰ和SalⅠ):F:5′-GCGGATCCATGGCACTCAACCAAGCC-3′;R:5′-CTTGTCGACATCGGAGGGGGAGGGGA-3′。引物由生工生物工程(上海)股份有限公司合成。
用植物总RNA提取试剂盒提取总RNA,根据逆转录试剂盒说明合成PlAMV第1链cDNA,再以第1链cDNA为模板,通过RT-PCR扩增PlAMVcp基因。扩增条件为:94 ℃预变性4 min;94 ℃变性30 s,58 ℃退火45 s,72 ℃延伸1 min,循环扩增30次;72 ℃延伸7 min。PCR产物经1.5%琼脂糖凝胶电泳检测,通过DNA回收试剂盒回收目的片段;纯化片段连接T载体,转化E.coliDH5α。提取重组质粒,经PCR和双酶切验证后,阳性质粒送北京擎科新业生物技术有限公司测序,测序证实序列正确后命名为pMD19-T-PlAMV,并借助BLAST、ClustalW和DNAStar软件进行序列比对、分析,以及PlAMV CP蛋白的抗原表位预测。
1.3 原核表达载体的构建
用限制性内切酶BamH Ⅰ和SalⅠ双酶切pMD19-T-PlAMV质粒和pET-28a(+)质粒,经1.5%琼脂糖凝胶电泳检测后通过DNA回收试剂盒纯化目的片段,16 ℃连接。连接产物转化E.coliDH5α,涂布于含有卡那霉素的LB固体培养基,然后挑选单克隆进行PCR验证。阳性菌落扩大培养提取质粒,经限制性内切酶BamH Ⅰ和SalⅠ双酶切、1.5%琼脂糖凝胶电泳检测后,将阳性质粒命名为pET-28a-PlAMV。未经酶切处理的pET-28a-PlAMV质粒作为双酶切鉴定阳性克隆的对照。
1.4 PlAMV CP蛋白的原核表达
取pET-28a-PlAMV质粒转化E.coliBL21(DE3)菌株,挑取单克隆接入含有卡那霉素的LB液体培养基中培养。第2天按照体积比1∶100接种于同样的培养基,37 ℃、220 r·min-1摇床振荡培养。当D600为0.7时,分别加入0、0.5、1.0、1.5 和2.0 mmol·L-1IPTG诱导蛋白表达,诱导4 h后收集菌体进行SDS-PAGE电泳。相同条件诱导未插入目的基因的E.coliBL21(DE3)菌株表达蛋白作为阴性对照。
为获得纯化的PlAMV CP蛋白,按照同样的实验条件,诱导培养1 L菌体。收集菌体后,首先用0.01 mol·L-1PBS溶液悬浮菌体,然后使用超声机破碎至菌液澄清透亮,接着离心后取上清,最后按照Ni-NTA重力柱操作指南纯化目的蛋白。
1.5 PlAMV CP多克隆抗体的制备
用纯化的PlAMV CP蛋白(1 mg·mL-1)作为免疫原免疫新西兰大白兔制备多克隆抗体。具体免疫情况如下:将1 mg纯化蛋白和完全弗氏佐剂(初次免疫)或不完全弗氏佐剂(增强免疫)等量混合均匀,进行皮下多点注射。共进行4次免疫,每次免疫间隔21 d,第4次免疫2周后取全血,分离得到抗血清。间接ELISA测定效价,Protein A亲和层析柱纯化兔抗血清,从而获得兔抗PlAMV多克隆抗体IgG。
1.6 PlAMV CP多克隆抗体的鉴定
称取0.1~0.2 g健康和分别感染LSV、CMV、LMoV和PlAMV的百合叶片,以及感染PVX的马铃薯叶片,加入液氮研磨,按照植物蛋白提取试剂盒说明书提取总蛋白。蛋白样品经煮沸变性后进行SDS-PAGE电泳,采用湿转法将目的蛋白于15 V恒压下转移至PVDF膜,转膜后移入5%脱脂奶粉配制的封闭液中4 ℃封闭。以制备的PlAMV CP多克隆抗体作为一抗(1∶1 000),AP标记的羊抗兔IgG作为二抗(1∶10 000),通过NBT/BCIP碱性磷酸酶显色试剂盒(蓝色)显色。
2 结果与分析
2.1 PlAMV cp序列的克隆
以侵染东方百合杂交品种Robina的PlAMV基因组RNA为模板,RT-PCR扩增PlAMVcp基因的部分序列。电泳检测结果显示,扩增片段的大小为500~750 bp,与预期的PlAMVcp基因大小一致(621 bp)(图2)。
2.2 测序结果与序列分析
对阳性pMD-19T重组质粒分别从两端进行测序。测序结果表明,重组质粒序列与已知百合PlAMVcp基因序列(KX245539)的相似性达到100%。将该序列与GenBank中已注册的PlAMVcp基因序列进行比较,发现各分离物之间核苷酸序列的相似性为74.7%~100%,氨基酸序列的相似性为83.6%~100%。其中,甘肃皋兰分离物(克隆所得序列)与百合PlAMV分离物亲缘关系更近,核苷酸序列相似性为85.7%~100%,氨基酸序列相似性为92.8%~100%;与紫花堇菜(LC155796)、南天竹(LC155795)、车前草(KU697313)、地黄(KY923700)和报春花(AB360796)等其他植物PlAMV分离物的亲缘关系相对较远,核苷酸序列相似性为74.7%~86.4%,氨基酸序列相似性为83.6%~93.7%。
从NCBI中选取不同植物PlAMV分离物的cp序列,以邻接法(N-J法)构建系统进化树(图3),分析甘肃皋兰分离物与其他植物分离物之间的进化关系。结果表明,不同PlAMV分离物可明显分为2个大组。第1大组内,百合的PlAMVcp序列可聚为一个分支,烟草、车前草、地黄的PlAMVcp序列可聚为另一个分支;而紫花堇菜的PlAMVcp序列,相比其他分离物,单独被分为一个大组;表明PlAMV的种群分布表现出寄主之间的差异性。在百合分离物聚成的分支内部,甘肃皋兰分离物与中国(KX245539)、韩国(KU159091)、荷兰(KU870359)、意大利(LN651194)和英国(MK005151)的百合分离物具有较近的亲缘关系,而与日本百合分离物(AB360790-AB360795)的亲缘关系相对较远。表明PlAMV的种群分布可能存在区域差异。

M,DNA 2 000 marker;1,阴性对照;2,PlAMV cp基因。M, DNA 2 000 marker; 1, Negative control; 2, PlAMV cp gene.图2 PlAMV cp基因的PCR扩增结果Fig.2 PCR amplification result of PlAMV cp gene
2.3 PlAMV CP蛋白的抗原表位预测
从NCBI上选取具有完整PlAMVcp序列的分离物进行ClustalW多序列比对,获得相似性达到90%的保守氨基酸位点。通过DNAStar 7.1软件分析甘肃皋兰分离物PlAMV CP蛋白的二级结构和性质,预测其抗原表位(图4)。选择抗原性指数较高(指数≥0)、亲水性好(指数≥0)、柔韧性好(指数≥0)且具有β转角或无规则卷曲结构的区域作为抗原表位(氨基酸数量≥4)。预测结果表明,抗原表位由35个氨基酸组成,其中28个是保守氨基酸,表明PlAMV CP蛋白的抗原表位保守。
2.4 重组原核表达载体的构建
PCR扩增pET-28a重组质粒,得到约600 bp的目的片段,与预期的PlAMVcp序列大小一致(621 bp)。重组原核表达载体经BamH Ⅰ和SalⅠ切割后出现2个条带,获得了预期大小的目的片段(621 bp),表明原核表达载体构建成功(图5)。
2.5 PlAMV CP蛋白的表达与纯化
取pET-28a-PlAMV质粒转化E.coliBL21(DE3),经IPTG诱导后,收集菌体进行SDS-PAGE电泳。在IPTG诱导下,预期大小的位置处均有明显的蛋白表达(图6-A)。但是随着IPTG浓度从0.5 mmol·L-1逐渐增加到2.0 mmol·L-1,目的蛋白表达量没有显著变化。扩大培养1 L菌体,经Ni-NTA重力柱纯化获得PlAMV CP蛋白,无非特异性条带产生(图6-B)。
2.6 ELISA测定抗血清效价

图3 基于PlAMV cp基因核苷酸序列构建的系统进化树Fig.3 Phylogenetic tree of PlAMV isolates based on the nucleotide sequences of their cp genes
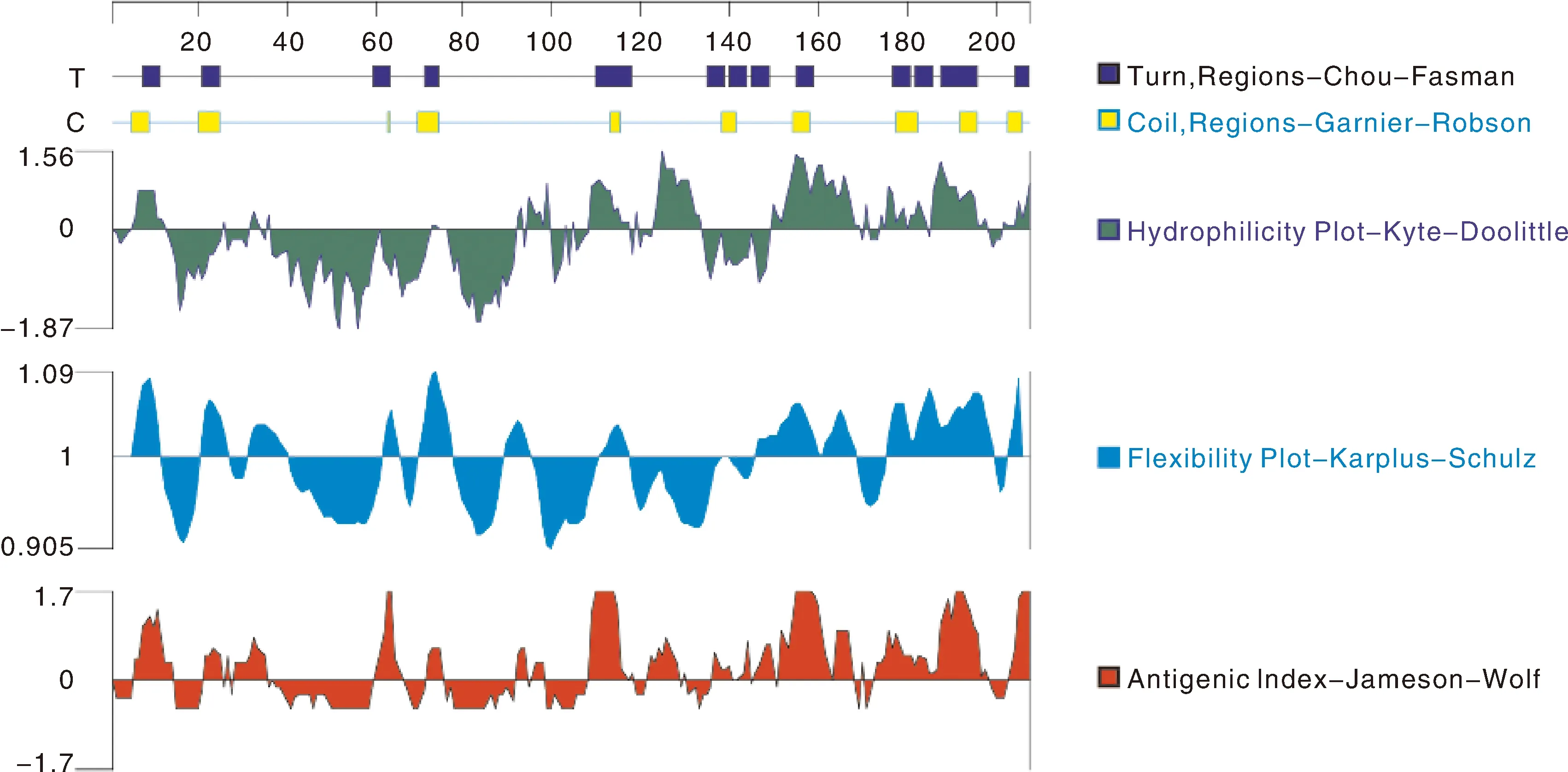
图4 PlAMV CP蛋白的二级结构、亲水性、柔韧性和抗原性预测Fig.4 Prediction of secondary structure, hydrophilicity, flexibility and antigenicity of PlAMV CP protein
为制备抗PlAMV CP蛋白的多克隆抗体,将纯化的CP蛋白免疫新西兰大白兔获得抗血清,通过间接ELISA测定抗血清效价。结果显示,制备的抗血清效价可达到32 000(表1),表明纯化的CP蛋白具有较好的免疫原性,制备的多克隆抗体具备高效价。
2.7 Western blot免疫印迹
提取百合和马铃薯叶片总蛋白,经Western blot检测,发现抗体与感染PlAMV的百合样品在预期大小位置处发生特异性反应,而与健康百合样品、分别感染LSV、CMV和LMoV的百合样品,以及感染PVX的马铃薯样品无交叉反应,表明抗体能够特异性结合PlAMV CP蛋白,具有良好的特异性(图7)。

M,DNA Marker;1,未经酶切的pET-28a重组质粒;2~3,pET-28a重组质粒的双酶切结果。M, DNA Marker; 1, Recombinant plasmid pET-28a without enzyme digestion; 2-3, Double enzyme digestion of recombinant plasmid pET-28a.图5 pET-28a重组质粒的双酶切鉴定结果Fig.5 Identification of recombinant plasmid pET-28a by double enzyme digestion
3 结论与讨论
全球化贸易推动了世界经济的发展,但是也为病毒的传播搭建了桥梁,PlAMV目前已发展成一种世界性的作物病毒。建立具有良好稳定性、特异性、灵敏性的病毒检测技术体系,对于PlAMV的检测、诊断、预警和防控具有重要意义。依赖RNA提取的核酸检测技术,需要专门的技术人员,不易普及。而血清学检测技术操作简便,同时能够快速检测大批量样品,适于田间大规模应用。为获得优质抗原,选择构建原核表达载体获得目的蛋白,相较于传统的纯化病毒颗粒制备抗原的方法,摆脱了对超高速离心机等仪器的依赖,降低了难度,从而大大提升血清学检测技术开发的速度以及检测的灵敏性和特异性[20]。
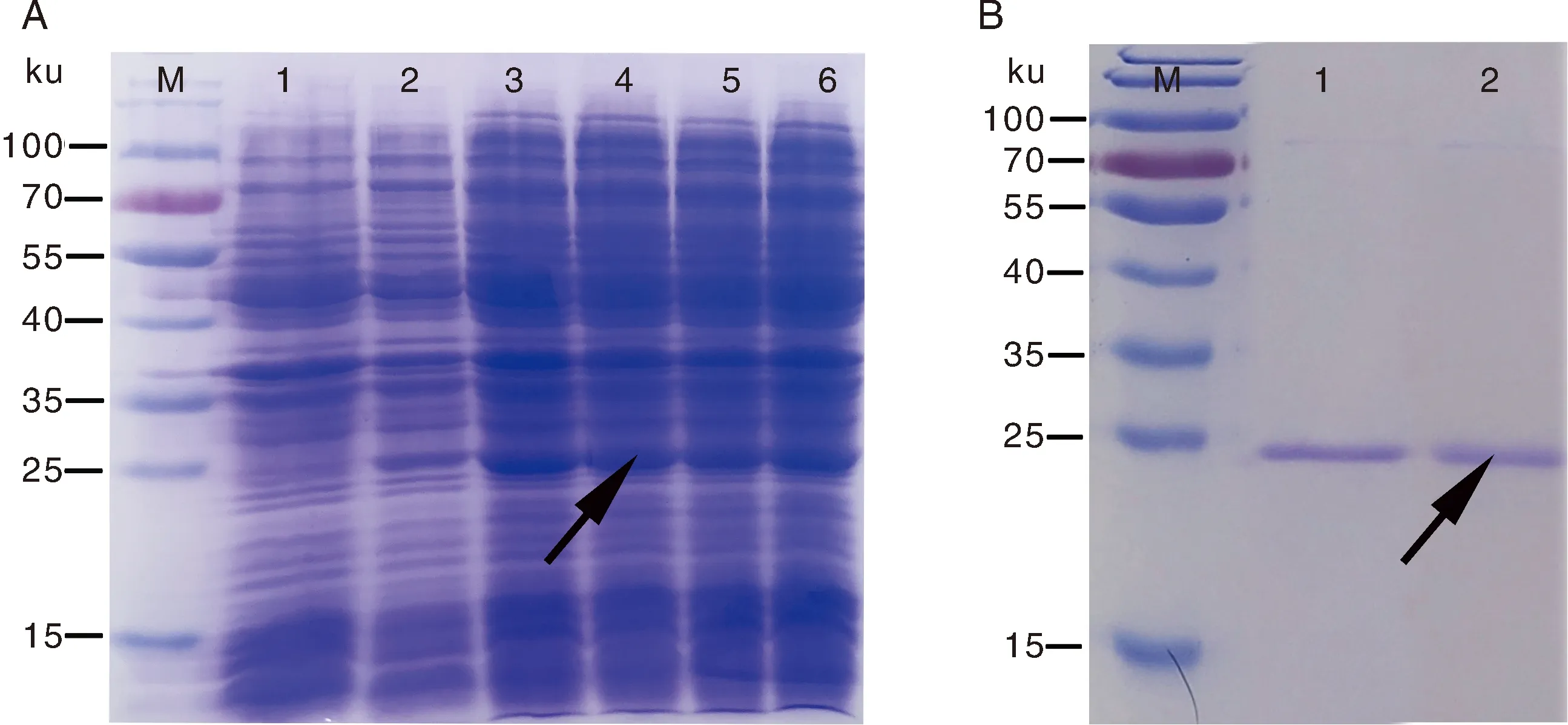
A,PlAMV CP蛋白的原核表达:M,蛋白质分子质量标准;1为pET-28a空载体对照;2~6 分别为0、0.5、1.0、1.5和2.0 mmol·L-1 IPTG诱导表达的PlAMV CP蛋白。B,PlAMV CP蛋白的纯化:M,蛋白质分子质量标准;1~2为纯化的重组CP蛋白。A, Prokaryotic expression of recombinant PlAMV CP: M, Protein marker; 1, Negative control of pET-28a without cp gene inserted; 2-6, Expression of PlAMV CP induced by 0, 0.5, 1.0, 1.5 and 2.0 mmol·L-1 IPTG, respectively. B, Purification of recombinant PlAMV CP: M, Protein marker; 1-2, Purified recombinant PlAMV CP protein.图6 PlAMV CP重组蛋白的SDS-PAGE分析Fig.6 SDS-PAGE analysis of recombinant PlAMV CP

表1 ELISA测定CP抗血清效价

续表1 Continued Table 1

M,蛋白质分子质量标准;1,健康百合样品;2~4,分别感染LSV、CMV和LMoV的百合样品;5,感染PVX的马铃薯样品;6,感染PlAMV的百合样品。M, Protein marker; 1, Negative control of healthy lily; 2-4, Extracts from lily samples infected with LSV, CMV and LMoV, respectively; 5, Extracts from potato samples infected with PVX; 6, Extracts from lily samples infected with PlAMV.图7 Western blot鉴定PlAMV CP多克隆抗体Fig.7 Western blot analysis of PlAMV CP using rabbit polyclonal antibody
病毒CP蛋白具有较好的免疫原性,通常被作为制备抗体的抗原[21-22],这和借助DNAStar软件预测得到PlAMV CP蛋白的抗原表位保守的结果一致。因此,本研究构建PlAMVcp基因的原核表达载体,并以纯化PlAMV CP蛋白为抗原制备了多克隆抗体,这些工作对于血清学检测技术开发,以及进一步的病毒蛋白功能研究都具有积极意义。
植物RNA病毒群体变异速度快且方式多样,这是病毒适应寄主环境的主要方式,也是病毒进化的主要动力[23]。本研究通过构建cp序列的系统进化树,以分析不同PlAMV分离物之间的进化关系,结果发现,PlAMV种群分布可能存在寄主差异和区域差异。甘肃分离物与其他百合分离物的核苷酸相似性最高达到100%,而与紫花堇菜分离物的相似性不到75%;此外,百合PlAMV分离物中日本与其他区域分离物序列差异最大。这些事实暗示了PlAMV种群分布可能存在寄主差异和区域差异。若要进一步探究种群基因组的遗传多样性、自然重组事件和进化选择压力,还需要更多来自不同地域、不同宿主的分离物的信息支持[24]。
原核表达病毒CP蛋白,省时省力,被广泛应用于植物病毒抗体制备。为提高CP蛋白的表达量,获得特异性良好和效价高的抗体,初步探究了重组蛋白的诱导表达条件。设置了CP蛋白诱导表达的IPTG浓度,探究IPTG浓度对CP蛋白表达量的影响。SDS-PAGE检测结果表明,培养基中加入IPTG诱导,PlAMV CP蛋白表达量得到明显提高,但是不同浓度IPTG作用下CP蛋白的表达量没有显著差异。这个结论与前人的研究结果基本一致,可能由于IPTG浓度过高,对E.coliBL21(DE3)菌株生长产生了明显的抑制作用,从而使不同浓度诱导下的蛋白表达未出现明显差异[25]。
CP蛋白作为病毒的结构蛋白,其表达和分布对病毒的侵染和复制都发挥着关键作用[7,26]。然而目前的研究中还未发现与PlAMV CP蛋白互作的寄主因子。因此,需要检测PlAMV病毒侵染过程中CP蛋白表达量的变化,并结合植物转录组测序,预测出与CP蛋白互作的潜在的寄主因子。本研究采用 Western blot分析百合叶片中病毒蛋白表达。制备的抗体与健康百合样品和分别感染LSV、CMV、LMoV的百合样品,以及感染PVX马铃薯样品的总蛋白无特异性结合,而与感染PlAMV百合样品的总蛋白发生特异性反应,这表明本研究所制备的抗体能特异结合天然病毒蛋白,可用于检测植物材料中PlAMV的蛋白表达。
——一道江苏高考题的奥秘解读和拓展

