心率减速力在曲妥珠单抗治疗乳腺癌相关心脏毒性的预测价值
俸艳英 阳志军
广西医科大学附属肿瘤医院1心肺功能中心,2妇瘤科(南宁530021)
曲妥珠单抗是人表皮生长因子受体-2(human epidermal growth factor receptor-2,HER-2)阳性乳腺癌患者靶向治疗的首选[1],能显著地改善患者的预后,但其所致的长期相关心脏毒性作用越来越受到关注,主要表现从无症状左心室收缩功能障碍到明显充血性心力衰竭。欧洲肿瘤内科学会(European Society for Medical Oncology,ESMO)提出要了解曲妥珠单抗潜在的心脏毒性作用需要严密监测左心室射血分数(LVEF)[2]。然而,当LVEF降低时心肌细胞的损伤已至晚期,且预后不良。因此,寻找能早期、有效地预测曲妥珠单抗相关心脏毒性的指标成为亟需解决的问题。心率减速力(DC)通过检测心动周期的调节痕迹,分析受试者全天心率整体趋向性和减速能力,是定量评估受试者迷走神经张力的方法,通过动态心电图检测DC 进行危险分层可筛选心脏性猝死高风险患者[3];如今该技术已广泛应用于临床,并进一步证实DC是多种心脏疾病不良结局的强有力预测因子[4-6]。本研究在曲妥珠单抗治疗前测定DC,随访观察曲妥珠单抗治疗过程中及治疗结束后LVEF 的变化评估心脏毒性,分析治疗前DC 与心脏毒性的相关性,探讨DC 在早期预测曲妥珠单抗相关性心脏毒性中的临床应用价值。
1 资料与方法
1.1 一般资料选自2015年6月至2017年6月在广西医科大学附属肿瘤医院经组织病理学证实HER2 阳性的浸润性乳腺癌患者。入选标准:(1)已完成以蒽环类药物阿霉素(ADM)或表柔比星(EPI)为主的辅助化疗序贯紫杉类联合曲妥珠单抗静脉注射治疗,曲妥珠单抗静脉注射,首次剂量为8 mg/kg,随后每3 周6 mg/kg 维持剂量,拟计划持续1年;(2)放疗技术采用三维适形、固定野或旋转调强照射;(3)年龄<65 岁;(4)体能状态ECOG(Eastern Cooperative Oncology Group)评分0~2 分;(5)曲妥珠单抗初始治疗前常规十二导联心电图、血清生物标志物(肌钙蛋白和脑钠肽)正常;(6)超声心动图基线LVEF ≥55%。排除标准:(1)非心脏功能障碍原因停用曲妥珠单抗;(2)合并有心脏基础疾病、高血压、糖尿病、高脂血症;(3)合并影响自主神经功能的疾病,如甲状腺功能异常;(4)失访或随访资料不全;(5)肿瘤复发、转移或合并其他恶性肿瘤患者。符合纳入标准的患者,根据是否产生心脏毒性分为心脏毒性组和无心脏毒性组。本研究经广西医科大学附属肿瘤医院伦理委员会批准及患者知情同意。
1.2 DC 检测所有患者在曲妥珠单抗治疗前一周内采用美国DMS-300-4A 型号的动态心电图记录仪,行24 h 动态心电图检测,根据BAUER 等[3]计算法分析软件自动计算DC值,单位为毫秒(ms)。
1.3 心功能监测采用GE.C9 型彩色多普勒超声诊断仪进行心功能评估,曲妥珠单抗治疗前、治疗中及治疗结束后第一年每3 个月1 次LVEF 监测,此后每半年1 次LVEF 监测,如果有心功能不全临床症状,患者应随时进行左室射血分数评估,所有患者均在同一台仪器上完成评估。观察终点为曲妥珠单抗相关心脏毒性的发生,心脏毒性为随访中LVEF 较治疗前下降≥10%或者LVEF <50%,伴随有或无相关心力衰竭症状[7]。
1.4 统计学方法应用SPSS 24.0 统计软件分析,计量资料表示为均数±标准差,组间比较采用t检验;计数资料以例数表示,组间比较采用χ2检验或Fisher 确切概率法检验;采用二元logistic 回归分析心脏毒性的影响因素。应用MedCalc统计软件分析受试者工作特征(ROC)曲线,评价不同变量预测心脏毒性事件的能力。以P<0.05为差异有统计学意义。
2 结果
2.1 基线临床特征150 例入选患者,年龄23~65 岁,心脏毒性组28 例(18.7%),其中3 例(2%)出现胸闷、乏力等轻-中度体力活动下降症状,其余患者为无症状左心室射血分数降低,未出现严重心力衰竭NYHA(New York Heart Association)Ⅳ级。心脏毒性组与无心脏毒性组在使用曲妥珠单抗前临床基线特征比较,患者的年龄、蒽环类药物治疗剂量、DC 及基线LVEF 差异有统计学意义(P<0.05),见表1。
2.2 影响心脏毒性相关因素的多因素logistic 回归分析将两组患者的年龄、蒽环类剂量、心率、DC 及基线LVEF 和临床相关的变量纳入logistic 回归分析,以有无心脏毒性发生为因变量,经多因素分析结果显示,蒽环类药物高治疗剂量、低DC 和低基线LVEF 是曲妥珠单抗心脏毒性发生的独立危险因素(P<0.05),见表2。
2.3 DC 与基线LVEF 在曲妥珠单抗心脏毒性中的预测能力评价以发生心脏毒性为状态变量,分别以DC 和基线LVEF 为检验变量,绘制ROC 曲线。DC 的ROC 曲线下面积(area under the cure,AUC)为0.875(95%CI:0.812~0.924,P<0.01),最佳诊断界值为4.5 ms,其对应的敏感性和特异性分别为78.6% 和83.6%。 基 线LVEF 的AUC 为0.763(95%CI:0.687~0.829,P<0.01),最佳诊断界值为63%,其敏感性和特异性分别为67.9%和77.9%。DC 对心脏毒性发生的预测能力优于基线LVEF,差异有统计学意义(P= 0.032),见图1。
3 讨论
曲妥珠单抗能显著改善HER2 阳性乳腺癌患者的预后,是抗HER2 治疗的标准选择。然而,作为曲妥珠单抗主要不良反应之一,心脏毒性仍是临床中的重要问题。先前的研究表明,曲妥珠单抗治疗后相关心脏毒性Ⅲ级或Ⅳ级的发生率为23.2%,有12.7%的患者出现严重的心脏不良事件[8],无症状左心室射血分数下降为8%~14%[9-10]。本研究中,尽管排除了高血压、糖尿病、高脂血症、冠心病、高龄等心脏毒性易感因素,150 例符合条件的患者中,心脏毒性发生率为18.7%(28 例),其中2%(3 例)为有症状心功能不全。因此,探索预测患者潜在有使用曲妥珠单抗相关心脏毒性风险的指标具有重要的临床意义。对于高危患者需要进行早期干预,如使用心脏保护剂治疗或调整治疗方案以避免左心室功能障碍。
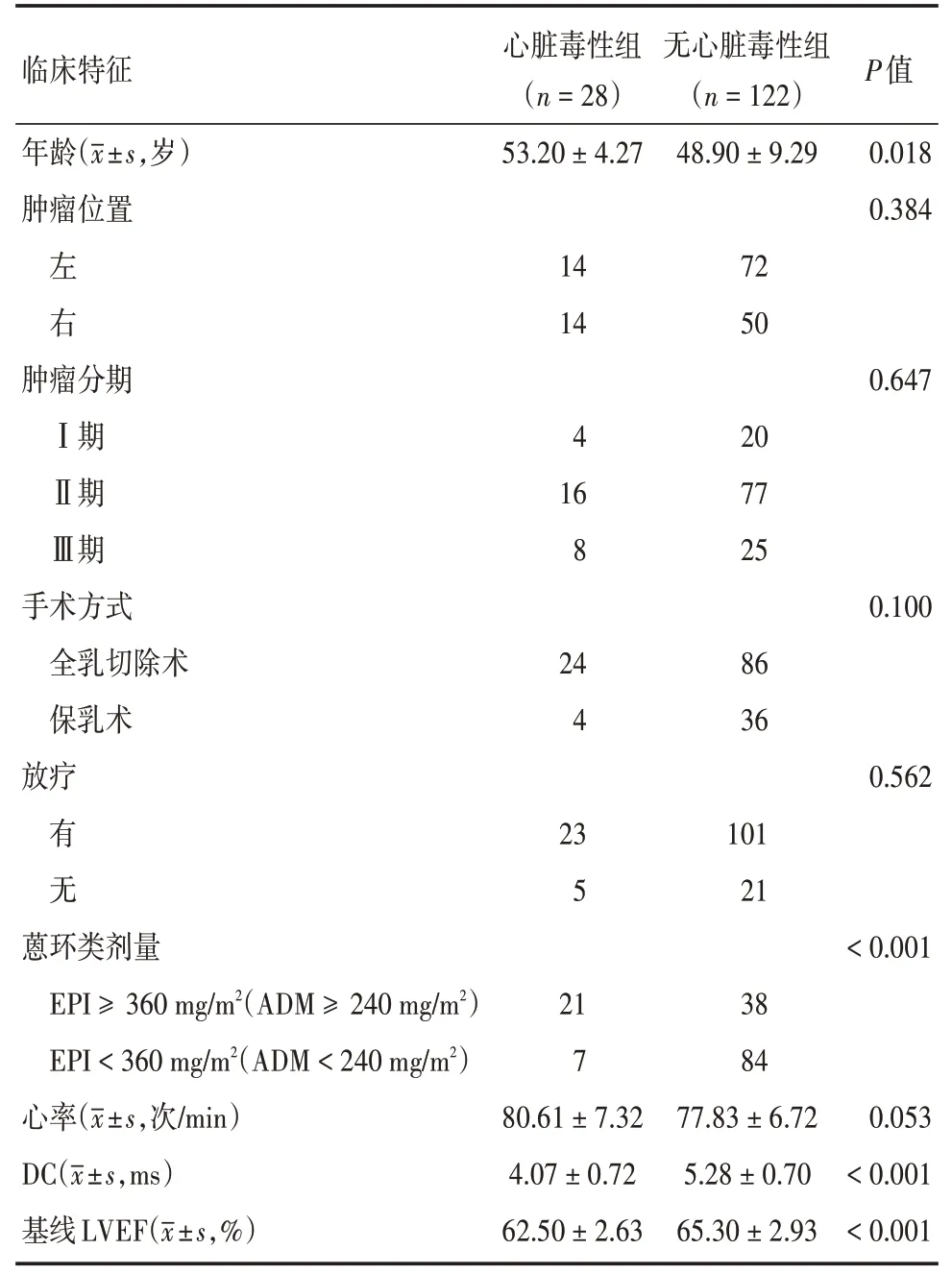
表1 心脏毒性组与无心脏毒性组临床基线特征比较Tab.1 Comparison of clinical baseline characteristics between cardiotoxicity and non-cardiotoxicity groups

表2 影响心脏毒性发生的多因素Logistic 回归分析Tab.2 Logistic regression analysis for the risk factors of cardiotoxicity

图1 DC 与基线LVEF 预测心脏毒性的ROC 曲线Fig.1 Receiver operating characteristic curves of DC and baseline LVEF for the prediction of cardiotoxicity
本研究结果显示在曲妥珠单抗使用前,蒽环类药物高治疗剂量、低DC 及低基线LVEF 是曲妥珠单抗心脏毒性发生的独立危险因素。相关研究也显示,高累积剂量的蒽环类药物是曲妥珠单抗相关心脏毒性的危险因素[11-12]。但蒽环类药物在乳腺癌化疗中有着较好疗效,所以仍被广泛应用于临床[13]。继蒽环类药物后序贯曲妥珠单抗治疗的HER2 阳性乳腺癌患者,其心脏毒性发生率往往较高[14],有研究将肌钙蛋白、尿钠肽、基线LVEF 等指标作为乳腺癌患者曲妥珠单抗治疗相关心脏毒性的预测因子[15-17],但各研究中患者异质性较大,导致得出的结论不一致[11,17]。目前曲妥珠单抗相关心脏毒性的早期预测指标仍是临床研究关注的问题。
本研究发现,在曲妥珠单抗开始使用前,无论蒽环类药物累积剂量或基线LVEF 如何,DC 与曲妥珠单抗心脏毒性发生显著相关,经ROC 曲线分析显示DC 对曲妥珠单抗心脏毒性的发生有较高的预测能力,其曲线下面积明显大于基线LVEF(0.875vs. 0.768,P= 0.032);而且数据分析显示,DC 越低心脏毒性发生的风险更高、发病时间更早。
本研究的对象均为无器质性心脏病的乳腺癌患者,但患者在整个抗癌治疗过程不仅承受疾病本身及抗癌治疗相关的躯体损伤,同时还承受来自于社会、经济、心理等多重创伤[18]。有确凿的证据证明心理社会因素与心脏疾病有相关性[19-20],研究显示这些患者常并发严重的自主神经功能紊乱,迷走神经和交感神经调节心脏的平衡功能遭受破坏,迷走神经对心脏的保护作用下降,这可能贯穿患者整个抗癌治疗过程。DC 是定量评估患者迷走神经张力高低的一种新的无创心电技术,在预警心脏事件中具有重要的临床意义,有较高的特异性和敏感性,对不伴有器质性心脏病患者也有较好的预警作用[21]。本研究显示DC 越低,曲妥珠单抗相关心脏毒性的发生风险越高,其对心脏毒性的发生有较高的预测能力,其最佳预测截断值为4.5 ms,与BAUER 等[3]研究一致。笔者之前的研究表明,DC 是表柔比星所致心脏毒性风险的有效预测因子[22]。DC 在靶向药物和细胞毒性药物所致的心脏毒性中有预测作用,其预测价值可能具有普遍性。因此,在使用抗癌药物治疗前进行DC 评估,可以将患者早期进行心脏毒性风险分层,并指导其抗癌治疗及心脏毒性监测管理。在抗癌治疗期间,对于高风险患者可给予心血管保护药物或心血管药物,以降低心脏毒性的发生率[23-24]。
综上,曲妥珠单抗使用前患者的DC 与其发生心脏毒性密切相关,有较强的临床预测价值。但本研究也有一定的局限性,首先,本研究的样本量较小,需要进行大规模、多中心的前瞻性研究来证实本研究的结论。第二,本研究在治疗过程中及结束后没有定期随访DC,无法了解治疗过程及治疗结束后DC 的变化是否与心脏毒性的发生紧密相关。因此,本研究还有待完善,需要进行DC 与LVEF 同步检测,进一步证实DC 与曲妥珠单抗心脏毒性的相关性,为临床提供便捷、有效的预测指标。

