Ghrelin对多柔比星诱导大鼠心力衰竭和心肌损伤的保护作用及机制
赵荫涛 裴小鑫 胡铂 杨海波 董建增 刘源
1郑州大学第一附属医院心血管内科(郑州450052);2同济大学附属东方医院心血管内科(上海200120)
慢性心力衰竭(chronic heart failure,CHF)是各种原发性和继发性心血管疾病发展到一定阶段的共同表现[1]。慢性心衰不仅严重危害人类的健康,而且给患者家庭和社会带来沉重经济负担[2]。随着我国经济水平、环境和医疗卫生健康方面的发展,人口预期寿命明显延长,罹患恶性肿瘤患者数量也随着增加[3]。部分抗肿瘤药物具有诱发心肌炎症反应、损伤心脏功能以及诱导心衰的不良作用,导致肿瘤患者承受治疗能力下降,严重影响抗肿瘤治疗的效果[4]。因此,寻找能减轻心肌炎症、改善心脏功能来对抗抗肿瘤药物治疗所引起的心脏毒性的因素或药物,对提高肿瘤患者的治疗效果有重要的临床意义。
多柔比星(doxorubicin,DOX)是一种蒽醌类抗肿瘤药物,临床上广泛应用于多种抗肿瘤治疗。但是,多柔比星会引起剂量依赖性的心脏毒性,可以导致不可逆的心肌损伤以及充血性心力衰竭[5]。多柔比星的心脏毒性严重干扰了它的临床应用。Ghrelin 是1999年在寻找生长激素促分泌素受体(GHS-R)的内源性配体时被发现的一种促进生长激素释放的多肽[6]。近些年研究发现,Ghrelin 具有广泛的生理学作用并与多种病理生理过程密切相关,如肥胖、心血管疾病和糖尿病等慢性疾病[7]。但是,Ghrelin 是否对多柔比星引起的大鼠心肌损伤和心衰有保护作用以及有关机理还没有报道。本试验通过研究Ghrelin作用于多柔比星诱发大鼠心肌损伤及心衰来探讨Ghrelin 在药物性心肌病中的保护作用及可能机制。
1 材料与方法
1.1 材料健康成年10 周龄雄性Sprague Dawley(SD)大鼠[动物许可证号:SYXK(沪)2003-0026]32 只,体质量250 ~300 g,购于上海交通大学医学院实验动物科学部。分笼喂养,4 只大鼠一笼。饲料为大鼠用普通饲料配方,动物房室内温度控制在24 ℃左右,12 h 明暗循环条件下喂养。
1.2 试剂与设备动物心脏超声检测机器和心脏超声探头(Visual Sonics,加拿大),盐酸多柔比星购于辉瑞制药(无锡)有限公司,盐酸氯胺酮液购于江苏恒瑞医药有限公司,CM1900 冰冻切片机(Leica,德国),酶标仪器(Thermo,芬兰),大鼠肿瘤坏死因子(TNF)-α 和大鼠白介素(IL)-10 酶联免疫试验(ELISA)试剂盒购于美国Sigma 公司,大鼠15-F2t-isoprostane 试剂盒购于美国Cell Biolabs 公司,大鼠Ghrelin 购于美国Anaspec 公司。
1.3 动物分组和模型制备32 只大鼠随机分成3 组。心力衰竭组(n= 13)和Ghrelin 组(n= 13)给予大鼠腹腔注射多柔比星溶液2 mg/kg 建立大鼠心力衰竭动物模型。对照组(n= 6)大鼠相同方法注射等容积的9 %氯化钠注射液。试验过程中定期观察大鼠的精神状态、活动量、体质量等大体情况,观察时间为8 周。
1.4 动物模型评估大鼠腹腔注射盐酸氯胺酮全身麻醉,对照组大鼠剂量为100 mg/kg,心力衰竭组和Ghrelin 组大鼠剂量为70 mg/kg。麻醉后用8% Na2S 脱毛,固定动物工作台上行超声心动图检查。测量参数包括:左心室舒张末期内径(LVDD)、左心室收缩末期内径(LVSD)、左心室射血分数(LVEF)和左心室短轴缩短率(LVFS),在3 个心动周期内完成测定并保存数据。所有实验数据由同一个研究员来完成,保证研究结果的统一性。
1.5 超声心动图检测造模后,Ghrelin 组给予50 nmol/kg Ghrelin,心力衰竭组和对照组分别给予等容积生理盐水,共持续6 周,均分别于每天上午8:00 和下午4:30 采用腹腔内注射方式给药。干预结束后再次对Ghrelin 组、心力衰竭组和对照组大鼠进行超声心动图检查。
1.6 血流动力学测定采用MPA-V 多道生物信号分析系统进行检测。盐酸氯胺酮腹腔内注射麻醉,仰卧固定,常规8% Na2S 脱去大鼠颈部皮毛,消毒,取颈部正中切口暴露两侧颈总动脉,分离出右颈总动脉,结扎远心端,并暂时夹闭近心端,逆行插入充满肝素生理盐水的聚苯乙烯导管至左心室。观察压力容积曲线,并记录以下血流动力学指标,包括:左心室收缩压(LVSP)、左心室舒张压(LVDP)、左心室内压最大上升速率(+dP/dtmax)和左心室内压最大下降速率(-dP/dtmax)。
1.7 心肌HE 染色采用断头法处死大鼠,取出心肌组织先经液氮处理,放置-80 ℃冷冻后制备冰冻组织切片,常规HE 染色,在光学显微镜下观察心肌组织学变化。
1.8 血浆炎症因子和15-F2t-isoprostane水平处死大鼠时取血4 mL,于4 ℃下1 500 r/min 离心10 min,去上清液,分装冻存于-80 ℃冰箱。采用ELISA 法检测血浆TNF-α、IL-10 和15-F2t-isoprostane 水平。
1.9 统计学方法应用SPSS 15.0 软件包进行统计分析。各参数以(x±s)表示,多组间采用单因素方差分析(方差齐)、两组间比较采用SNK-q检验;或多组间采用Kruskal-Wallis 检验(方差不齐),两组间采用Wilcoxon 检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 多柔比星造模后大鼠超声心动图变化所有大鼠在造模期间均存活,多柔比星造模8 周后予Ghrelin 干预前行超声心动图检查。相比对照组,心力衰竭组大鼠左心室显著扩大,室壁活动明显减弱,LVDD 和LVSD 明显增加(P<0.01),LVEF 和LVFS 明显降低(P<0.01),表明心力衰竭建立。见表1。
2.2 Ghrelin 干预后大鼠超声心动图变化Ghrelin干预后,与心力衰竭组比较,Ghrelin 组LVSD 明显减少(P<0.05),LVEF明显增加(P<0.05),表明Ghrelin明显改善心衰大鼠的心脏功能。见图1、表2。
表1 对照组与心力衰竭大鼠心脏超声心动图参数比较Tab.1 Comparision of echocardiographic parameters in control group and HF group ± s

表1 对照组与心力衰竭大鼠心脏超声心动图参数比较Tab.1 Comparision of echocardiographic parameters in control group and HF group ± s
注:LVDD,左心室舒张末期内径;LVSD,左心室收缩末期内径;LVEF,左心室射血分数;LVFS,左心室缩短率;与对照组比较,*P <0.01
组别对照组心力衰竭组例数6 26 LVDD(mm)5.14 ± 0.53 6.68 ± 0.67*LVSD(mm)1.21 ± 0.22 2.85 ± 0.27*LVEF(%)95.79 ± 9.35 79.04 ± 9.08*LVFS(%)78.26 ± 8.82 55.31 ± 7.84*
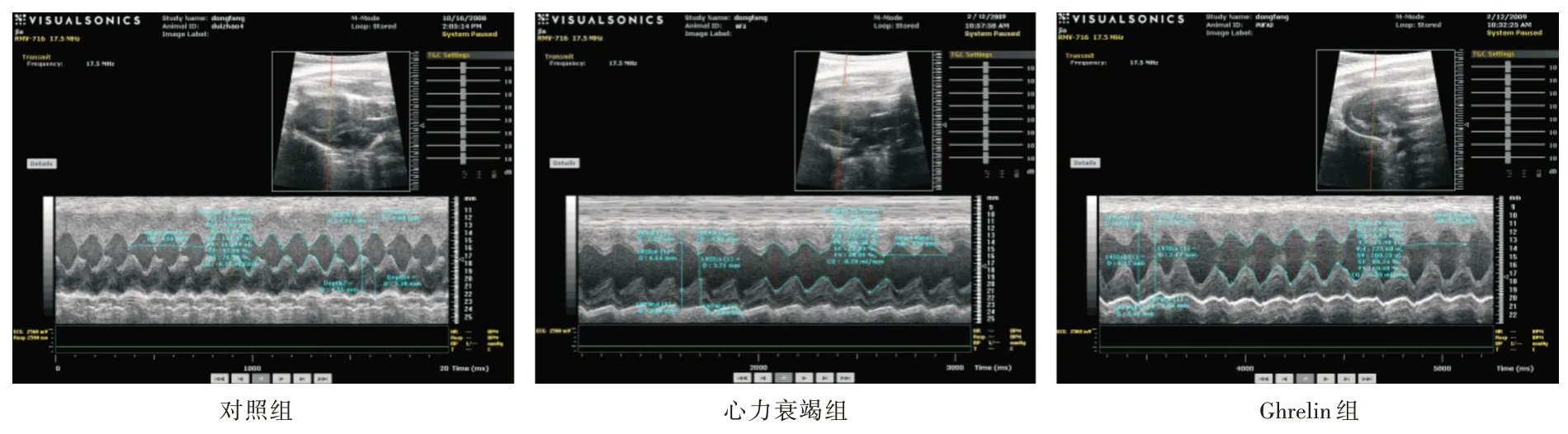
图1 各组大鼠心脏超声图像Fig.1 Echocardiogram in different group
表2 各组大鼠心脏超声心动图参数比较Tab.2 Comparisin of echocardiographic parameters in different group ± s
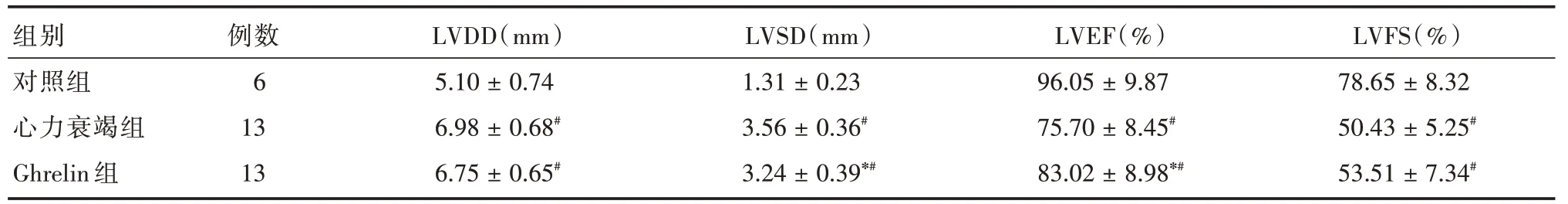
表2 各组大鼠心脏超声心动图参数比较Tab.2 Comparisin of echocardiographic parameters in different group ± s
注:LVDD,左心室舒张末期内径;LVSD,左心室收缩末期内径;LVEF,左心室射血分数;LVFS,左室缩短率;与心力衰竭组比较,*P <0.05;与对照组比较,#P <0.01
组别对照组心力衰竭组Ghrelin 组例数6 13 13 LVDD(mm)5.10 ± 0.74 6.98 ± 0.68#6.75 ± 0.65#LVSD(mm)1.31 ± 0.23 3.56 ± 0.36#3.24 ± 0.39*#LVEF(%)96.05 ± 9.87 75.70 ± 8.45#83.02 ± 8.98*#LVFS(%)78.65 ± 8.32 50.43 ± 5.25#53.51 ± 7.34#
2.3 血流动力学检测与对照组大鼠比,心力衰竭组 大 鼠 的LVSP、+dP/dtmax、-dP/dtmax 显著 降低(均P<0.05),LVDP 升高(P<0.01)。与心力衰竭组比较,Ghrelin 组大鼠的+dP/dtmax 显著增加(P<0.01),表明Ghrelin 明显改善心衰大鼠的血流动力状况。见表3。
表3 各组大鼠心脏血流动力学参数比较Tab.3 Comparisin of cardiac hemodynamics in different group ± s

表3 各组大鼠心脏血流动力学参数比较Tab.3 Comparisin of cardiac hemodynamics in different group ± s
注:LVSP,左心室收缩压;LVED,左心室舒张压;+dP/dtmax,左心室内压最大上升速率;-dP/dtmax,左心室内压最大下降速率;与心力衰竭组比较,*P <0.01;与对照组比较,#P <0.05,△P <0.01
组别对照组心力衰竭组Ghrelin 组例数6 13 13 LVSP(mmHg)112.71 ± 13.36 95.09 ± 14.95#98.70 ± 13.13#LVEP(mmHg)5.77 ± 1.62 10.26 ± 2.54△9.61 ± 2.13△+dP/dtmax(mmHg/s)6 334.76 ± 345.34 4 013.45 ± 282.17△5 236.58 ± 315.73*△-dP/dtmax(mmHg/s)5 116.45 ± 245.61 2 938.77 ± 202.17△3 071.46 ± 158.45#
2.4 心肌形态组织学变化对照组光镜下为心肌细胞排列整齐,细胞核清晰,横纹清晰,细胞间隙正常,无细胞变性和坏死,组织间质无炎症性渗出(图2)。心力衰竭组心肌细胞失去正常形态结构,心肌细胞排列不规则,部分出现变性、溶解、坏死,心肌细胞间隙增宽,间质内出现炎症细胞浸润。Ghrelin 组可见心肌细胞变性和坏死的程度和范围较心力衰竭组明显减轻。
2.5 血浆炎症因子和15-F2t-isoprostan 水平与对照组比较,心力衰竭组大鼠的血浆TNF-α、IL-10 和15-F2t-isoprostane 水平明显升高(P<0.01)。Ghrelin组较心力衰竭组大鼠的血浆TNF-α 和15-F2t-isoprostane 水平明显降低(P<0.01),血浆IL-10 水平明显升高(P<0.05),表明Ghrelin 明显改善心衰大鼠体内的炎症反应。见表4。

图2 光镜下大鼠心肌组织HE 染色图片(× 400)Fig.2 HE staining image of myocardium under light microscope(× 400)
表4 各组血浆TNF-α、IL-10 和15-F2t-isoprostane 水平变化Tab.4 Comparisin of plasma TNF-α,IL-10 and 15-F2tisoprostane level in different group ± s

表4 各组血浆TNF-α、IL-10 和15-F2t-isoprostane 水平变化Tab.4 Comparisin of plasma TNF-α,IL-10 and 15-F2tisoprostane level in different group ± s
注:TNF-α,肿瘤坏死因子-α;IL-10,白介素-10;与心力衰竭组比较,*P <0.05,#P <0.01;与对照组比较,△P <0.01
组别对照组心力衰竭组Ghrelin组例数6 13 13 TNF-α(pg/mL)13.65±3.04 54.56±12.18△39.91±10.07#△IL-10(pg/mL)78.82±8.73 111.25±23.48△137.03±26.42*△15-F2t-isoprostane(pg/mL)78.89±12.02 155.21±16.15△104.61±13.96#△
3 讨论
多柔比星是一种蒽醌类抗肿瘤化疗药物,临床用于各种实体瘤和血液系统肿瘤的治疗,但是由于心脏的严重毒性作用使其在临床上应用受到一定的限制[8]。多柔比星诱导的心肌病病理特征多与扩张型心肌病相似,包括:心肌细胞凋亡、线粒体肿胀、心肌细胞能量代谢紊乱和氧自由基(ROS)聚集[9]。但是,研究发现抑制ROS 聚集不能改善多柔比星对心脏的毒性作用[10],因此推测要从多种因素、多种路径干预才可能有明显效果。本研究表明Ghrelin 对多柔比星引起的大鼠心肌损伤有一定的保护作用,能够改善心脏的收缩功能,并且在组织学上一定程度上抑制心肌细胞的坏死以及调节循环中炎症因子和15-F2t-isoprostane表达。
Ghrelin 合成和分泌主要来自消化道,但是其受体在身体的各个组织器官中都有表达。Ghrelin在机体摄食和能量平衡调节中起到关键作用。另外,Ghrelin 可以作用于健康和罹患心脏病的个体心肌组织。有研究[11]表明CHF 患者血浆Ghrelin 水平明显高于健康人群,而心脏移植后血浆Ghrelin水平回落。同时,Ghrelin 可以通过促进垂体释放生长激素以及直接刺激GHS-R 以改善CHF 患者的心脏功能和心输出量[12]。在一项健康成人研究[13]中证实,给予双倍人体生理剂量的Ghrelin 后可以明显提高心脏指数(CI)和心脏搏出量指数(SVI)同时伴随降低外周血管阻力。以前的动物模型研究也发现,扩张型心肌病大鼠给予外源性Ghrelin能够降低左室舒张末期容积和提高LVEF,并且可以提高大鼠30 d 生存率[14]。本研究也发现Ghrelin可以部分改善心衰大鼠的心脏血流动力学参数。另一方面,Ghrelin 可以抑制健康人群交感神经活性,同时激活副交感神经活性,这可能部分解释为什么Ghrelin可以提高扩张型心肌病大鼠生存率[15]。本研究也证实,药物毒性心肌病大鼠给予外源性Ghrelin 在组织学上改善心肌细胞损伤,减小LVSD以及提高LVEF 和LVFS。
CHF 是一种慢性炎症状态,表现在血浆中炎症因子TNF-α 水平升高和肾素-血管紧张素系统激活[16]。Ghrelin 能够抑制血管内皮细胞过多产生氧化应激产物和NADPH 氧化酶激活,同时也通过抑制肿瘤坏死因子-κB(NF-κB)活化以抑制前炎症细胞因子生成。在一项对心肺移植患者的研究[17]中发现Ghrelin 可以降低循环中TNF-α、IL-6 水平和髓过氧化物酶活化达到保护心脏的作用。IL-10作为一种抗炎性细胞因子,能够抑制充血心力衰竭过程中产生的炎性细胞因子,可直接对抗心肌由炎性细胞因子介导的损害,对心脏有保护作用[18]。本试验研究发现,Ghrelin 可以提高IL-10 表达,提示Ghrelin 可能通过IL-10 在改善心力衰竭大鼠心功能中起到一定的作用。15-F2t-isoprostane 属于异构前列腺素家族成员,被认为是反映机体氧化应激、脂质过氧化损伤强度理想的生化指标。本研究在多柔比星诱导的心力衰竭大鼠模型中发现大鼠血浆15-F2t-isoprostane含量明显升高,给予Ghrelin干预后血浆15-F2t-isoprostane 水平显著下降,说明Ghrelin 可能部分通过抑制机体氧化应激反映,维持氧化/抗氧化平衡达到保护心脏的作用。近期研究发现,Ghrelin 可以通过调节基质金属蛋白酶/基质金属蛋白酶组织抑制因子途径,促使肝脏细胞外基质(ECM)降解,来抑制缺血再灌注诱导的肝纤维化发生发展,推测Ghrelin 可能对心脏或许有相似的有益作用,有待下一步研究证实[19]。既往研究[20]认为Ghrelin 能通过影响AMPK 和p38-MAPK 信号通路减轻多柔比星引起的小鼠的心脏毒性。因此,本研究认为Ghrelin 通过多种不同机制对多柔比星引起的心肌损伤和心衰起到保护作用的。
本研究具有一定的局限性。比如,对分子机制方面的探讨不够深入。在将来的研究中,可以对Ghrelin 组和心力衰竭组的心脏进行单细胞测序,更深入的理解不同的心脏细胞对Ghrelin 治疗的反应。
综上,Ghrelin 可以保护多柔比星对大鼠的心肌组织的损伤和改善心脏功能。这一发现为研究来源于消化道的生物活性物质Ghrelin 在预防和治疗药物毒性引起的心肌病类疾患的有益作用提供了一种新思路。在将来,可以研究Ghrelin 是否和其他有预防和治疗药物毒性引起的心肌病疗效的药物具有协同效应,以减少在临床应用时毒副作用的发生,同时进一步增强预防和治疗效应。

