皮肤未分化多形性肉瘤一例
刘洋爱,董正邦,王 飞
临床资料
患者,女,77岁。主因右腰部结节3个月余,于2019年4月就诊,患者3个月前无明显诱因右腰部出现一黄豆大小淡红色结节,表面光滑,无破溃、出血等,未予特殊处理。后结节出现疼痛并逐渐增大。既往有冠心病、高血压病史。体格检查:系统查体未见明显异常;皮肤科情况:右腰部见一1 cm×0.5 cm大小淡红色浸润性结节,高出皮面,边界清,表面毛细血管扩张并覆以细小鳞屑(图1),质地中等,有轻压痛。切除后行组织病理检查示:表皮萎缩,肿瘤细胞分布呈浸润性,累及真皮全层及皮下脂肪,部分区域细胞似成纤维细胞样,细胞核呈长形或梭形,交织排列呈席纹状;部分区域细胞似组织细胞样,呈多角形,核的形态不规则,胞质丰富,可见形状怪异的多核巨细胞,核分裂像多见(图2)。免疫组化染色:vimentin(+)(图3a),CD68(散在+)(图3b),CD10(+)(图3c),Ki67(50%+)(图3d),Fli-1(+),ERG(散在+);Des(-),SMA(-),CD34(-),S-100蛋 白(-),CK(-),SOX10(-),HMB45(-),CAM5.2(-)。诊断:皮肤未分化多形性肉瘤。头部、胸部、腹部、盆腔CT检查均未见明显异常征象,再次予患者原有皮损处扩大切除,随访至今无复发。
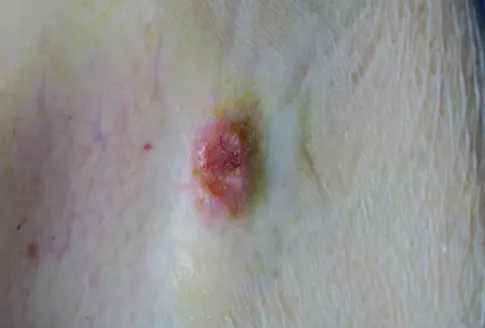
图1 皮肤未分化多形性肉瘤患者皮损临床表现
讨 论
未分化多形性肉瘤(undifferentiated pleomorphic sarcoma,UPS)曾被称为恶性纤维组织细胞瘤(malignant fibrous histocytoma,MFH)。2002年WHO重新定义MFH的概念,认为其本质是组织学来源及分化方向仍不明确的UPS,即两者指代相同,并将其分为多形性、巨细胞性和炎性3个亚型[1]。2013年WHO正式废除MFH这一术语,以UPS代之。特指没有任何特异性分化方向的高级别肉瘤[2],恶性程度高,易复发,是软组织肉瘤(soft tissue sarcoma,STS)中最常见的一种组织类型。与STS的其他亚型相比,晚期UPS患者的预后最差。UPS是起源于间叶组织的恶性肿瘤,病因及发病机制尚不清楚,可继发于放射线接触、化疗、烧伤、活检或手术创伤等修复过程中等,发病机制可能与RB1基因的失活或p53功能的频繁丧失有关,但是,UPS基因突变的情况尚未得到充分证实[3]。临床上患者多为中老年人,男性略多,但也有学者报告该病发病年龄呈双峰分布,主要为0~16岁的儿童或60岁以上的成人[4]。该病可累及任何部位,以四肢(尤其下肢)、腹膜后间隙、躯干多见。UPS临床不具特征性,主要表现为逐渐增大的无痛性或疼痛性肿块,大多数为深在性病变,肿块内常有坏死、囊性变,边缘较清楚,但不规则,向周围呈浸润性生长,易侵犯邻近血管、神经,仅累及皮肤者极罕见。而本例患者仅有皮肤受累,深部组织未见浸润,提示临床医师不可忽略UPS只存在表浅皮损的情况。
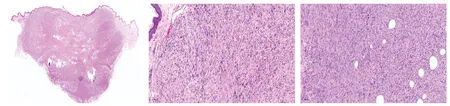
图2 皮肤未分化多形性肉瘤患者皮损组织病理像(HE染色)

图3 皮肤未分化多形性肉瘤患者免疫组化组织病理(EnVision法×100)
一般来说,UPS大体病理多呈孤立的分叶状鱼肉样肿物,可有坏死、出血及囊性变。镜下肿瘤细胞成分较为复杂,异形性明显,核分裂像易见,主要由席纹状区域和多形性区域混合而成。席纹状区域由表现为梭形细胞的纤维成细胞和平滑肌细胞及圆形组织样细胞组成,多形性区域由大量富于染色质、核不规则的多核巨细胞组成[5]。免疫组化染色可提示间叶来源,但缺少特征性标记。多数表达vimentin、CD68,部分也可表达S-100蛋白、CK、SMA、EMA、CD10、actin、Desmin、抗胰蛋白酶、抗糜蛋白酶等。本例患者免疫组化染色示vimentin、CD10(+),CD68(散在+),Ki67(50%+),与上述一致。虽然其中的CD10为非典型纤维黄色瘤(AFX)较特异的免疫表型,但Hanlon等[8]使用CD10对原发和复发AFX和UPS进行免疫组化染色,结果并未发现两者之间存在显著差异,因此CD10并不能帮助鉴别AFX和UPS。UPS在影像学检查方面依旧缺乏特征性表现。
UPS缺乏特征性组织病理表现及免疫组化标志,通常需排除以下疾病后方可诊断:①AFX:该病是一种交界性肿瘤,属低度恶性,多见于老年人头面部等曝光部位,男性更为多见,表现为单发的结节或斑块,表面常有破溃和出血,组织病理上无深层侵袭趋势,常局限于真皮,由多形性的梭形细胞组成,核分裂像及病理性核分裂较UPS少见,术后可复发,但很少发生转移。AFX与皮肤未分化多形性肉瘤最主要的鉴别为后者在组织学上侵犯的层次更深,常达皮下脂肪、骨骼肌及筋膜等[9]。本例患者组织病理上虽为推进性累及皮下脂肪,但瘤细胞异形性和核分裂像较显著,结合该例为老年女性,皮损为非曝光部位的浸润性疼痛性结节,肿瘤具有高度增殖活性(Ki67 50%+),考虑诊断皮肤未分化多形性肉瘤更合适。②隆突性皮肤纤维肉瘤:临床上表现为生长较慢的隆起性肿块,常侵及真皮深层及皮下脂肪,瘤细胞呈车辐状或席纹状排列,多核巨细胞和核分裂像少见,细胞异形性不明显,免疫组化席纹状区域常弥漫性表达CD34。③上皮样肉瘤:皮损可为丘疹、结节及斑块,常有坏死和溃疡,组织病理为上皮样细胞中混有梭形细胞, 可见核多形性和分裂像,多核巨细胞极少见,病变中央有坏死或纤维化改变具有特征性,免疫表型角蛋白、波形蛋白均阳性。④其他恶性多形性肉瘤:尤其是肌源性和神经源性肉瘤,如多形性平滑肌肉瘤、多形性脂肪肉瘤、多形性横纹肌肉瘤等在形态学上均具有多形性特征,镜下均有多形性的多核巨细胞且分化较差,故需结合临床、组织病理及免疫组化等进行综合分析后排除。
广泛完整的外科手术切除是UPS最主要的治疗方法,由于其具有较高的复发率和转移率,完整切除至关重要。最小切除边缘至少为10 mm,以尽可能减少局部复发和转移的风险[6]。对于不能完整切除或有转移的患者,可考虑放化疗,但疗效不确切。近年来,越来越多的学者提出靶向治疗,通过作用于特定的突变位点达到治疗效果,但目前并没有指南推荐的靶向用药。UPS确诊后应进行各系统全面查体,以早期发现转移性病灶。术后还需进行常规监测和随访,虽然目前为止暂无标准指南,但有学者建议每3~6个月进行1次,特别是在诊断和治疗后的2年,以评估局部复发、转移和其他潜在皮肤癌的发生[7]。
UPS是一种临床上少见的恶性肿瘤,无特异性临床表现、影像学表现,组织病理及免疫组化染色亦无特异性,为排他性诊断,漏诊率及误诊率均较高。尤其本例患者临床主要为皮肤上的结节,较表浅,极易误诊为其他皮肤肿瘤,提示医师临床上即便见到较表浅的皮损仍旧需考虑UPS可能。治疗首选根治性手术切除,因其具有高度的侵袭性,加之临床表现多为位置较深的无痛性肿块,发现时多为晚期,整体预后较差。本例患者因早期即出现疼痛性结节,遂及时就诊明确诊断,目前随访暂未发现复发及远处转移。
——一对性格习性迥异的兄弟

