表没食子儿茶素没食子酸酯二元醇脂质体的制备及体外透皮性质研究
宋 娟,吕成志,王 栋,丁 峰,于绪东
表没食子儿茶素没食子酸酯(EGCG)是绿茶提取物茶多酚的主要活性成分,约占儿茶素总含量的80%[1]。研究表明,EGCG对白癜风、紫外线辐射、银屑病、痤疮、保健美容等多种皮肤科疾病有效[2-5]。然而EGCG结构中B环上C3',C4'和C5'上的羟基及C环上C3位的没食子酸极易在光照、高温、碱性等条件下发生氧化、聚合、缩合等变化,导致其体内外分解快速,稳定性较差。且EGCG较强的水溶性致使其皮肤渗透性差,进一步限制了其在皮肤病治疗中的应用[6-8]。
二元醇脂质体(binary ethosome)是对乙醇脂质体改进后得到的一种新型的经皮给药载体,采用二元醇相(包括乙醇和丙二醇)代替单纯的乙醇制备的二元醇脂质体,具有生物相容性好、制备工艺简单、性质稳定、皮肤渗透性及滞留性强等特点[9-11]。因此,笔者采用乙醇和丙二醇组成的混合醇代替单纯的乙醇首次制备了EGCG二元醇脂质体(EGCG-EL),并对EGCG-EL的体外透皮性质进行考察。
1 材料
1.1 仪器
Waters 高效液相色谱仪(1525 Binary泵、2487 UV检测器、Breeze 色谱工作站,美国 Waters 公司);TK-12A 型 Franz 扩散池(上海锴凯科技贸易有限公司);BS110S型电子天平(赛多利斯科学仪器有限公司);JY92-II 型超声波细胞粉碎机(宁波新芝科器研究所);LP 220S型电子天平(赛多利斯科学仪器有限公司);Nano ZS90 粒度仪(英国Malvern 公司);DF-101S集热式磁力加热搅拌器(中国金坛市医疗仪器厂)。
1.2 试剂
EGCG原料(杭州禾田生物科技有限公司,纯度95%);EGCG对照品(上海友思生物技术有限公司,纯度>98%);大豆卵磷脂(北京奥博星生物技术有限公司);丙二醇(湖南尔康高科药业有限公司);乙醇(大连川连酒厂)。
2 方法与结果
2.1 EGCG-EL的制备
采用乙醇注入法制备EGCG-EL。称取EGCG、磷脂及胆固醇(磷脂与胆固醇的质量比为10:1)置于密闭容器中,加入适量的乙醇和丙二醇(体积比为2:1)混合溶液溶解,随后置于磁力搅拌器上。在30℃条件下,用注射器将纯化水以缓慢细流状注入至上述溶液中,注完后继续搅拌适当时间,将得到的水性混悬液超声后过0.22 µm滤膜,即得EGCG-EL。
2.2 EGCG-EL中EGCG含量测定
2.2.1 HPLC 色谱条件色谱柱:Elite-ODS柱(200 mm×4.6 mm,5 µm);流动相:甲 醇:水:乙 酸=23:75:2;柱温:30℃;流速:1.0 ml/min;检测波长:272 nm;进样量:20 µl。
2.2.2 溶液的配制 空白脂质体溶液:精密量取 0.1 ml不含EGCG的空白脂质体溶液置10 ml量瓶中,加甲醇 3 ml,超声 1 min 后,加流动相稀释至刻度,取上清液过0.45 µm 滤膜即得空白脂质体溶液。供试品溶液:精密量取 0.1 ml EGCG-EL 溶液置10 ml量瓶中,加甲醇 3 ml,超声 1 min 后,加流动相稀释至刻度,取上清液过0.45 µm 滤膜即得供试品溶液。
2.2.3 专属性 精密量取EGCG对照品溶液、空白脂质体溶液、供试品溶液各 20 µl,按1.2.2.1方法进行检测。结果显示溶剂、辅料及杂质对EGCG测定无干扰,见图 1。
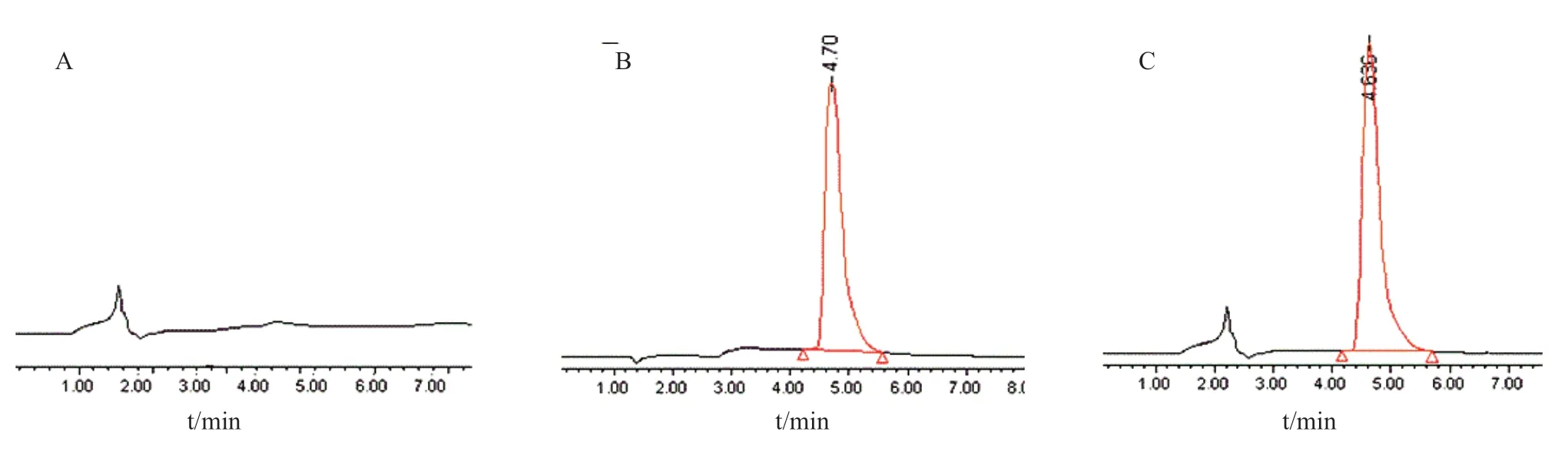
图1 HPLC 色谱图
2.2.4 线性关系 精密称取EGCG对照品 10.0 mg,置100 ml量瓶中,加流动相溶解并稀释至刻度,摇匀;分别吸取 0.5、1、2、4、8 ml 置10 ml量瓶中,加流动相稀释至刻度,摇匀,配制成浓度分别为5.0、10.0、20.0、40.0、80.0 µg/ml系列标准溶液,精密量取20 µl注入液相色谱仪,记录色谱图。以EGCG的峰面积A对质量浓度C进行线性回归。得回归方程A=24501C-30829,r=1,表明EGCG在5.0~ 80.0 µg/ml浓度内线性关系良好。
2.2.5 准确度精密量取 0.1 ml 空白脂质体溶液置10 ml 量瓶中,分别加入 0.1 ml 低、中、高三个浓度(1.6,2.0,2.4 mg/ml)的 EGCG 标准溶液,涡旋 30 s,加甲醇 3 ml 超声 1 min 后,加流动相稀释至刻度,取上清液过 0.45 µm 滤膜。精密量取20 µl注入液相色谱仪,记录色谱图,计算得到低、中、高3个浓度EGCG 平均回收率分别为101.7%、100.5%、100.3%(n=3),RSD 分别为 0.35%、0.11%、0.35%。
2.2.6 精密度 取“线性关系”项下20.0 µg/ml溶液,精密量取20 µl注入液相色谱仪,记录色谱图,重复进样6次,相对标准偏差(RSD)为1.69%。
2.2.7 稳定性 取供试品溶液,室温放置,分别于0和4 h精密量取20 µl,注入色谱仪,记录色谱峰面积,色谱峰面积的相对标准偏差(relative standard deviation,RSD)为0.17%,表明供试品溶液在室温放置4 h稳定。
2.3 EGCG-EL质量评价
2.3.1 EGCG-EL的外观 采用目测法,观察制备的EGCG-EL外观,肉眼观察EGCG-EL为半透明乳状液,且带明显的乳光(图2)。
2.3.2 EGCG-EL的粒径及Zeta 电位 取EGCGEL适量,以水为稀释递质,用激光粒度测定仪测定EGCG-EL的粒度及其分布和Zeta电位。采用乙醇注入法制备的EGCG-EL粒径分布均匀(图3),平均粒径为(144.5±11.3)nm,PDI为 0.19±0.04。EGCGEL的Zeta 电位为 -34.8 mV,EGCG-EL所带相同电荷之间的排斥作用能够有效的阻止脂质体的相互聚集,提高EGCG-EL的聚集稳定性。

图2 EGCG-EL的外观
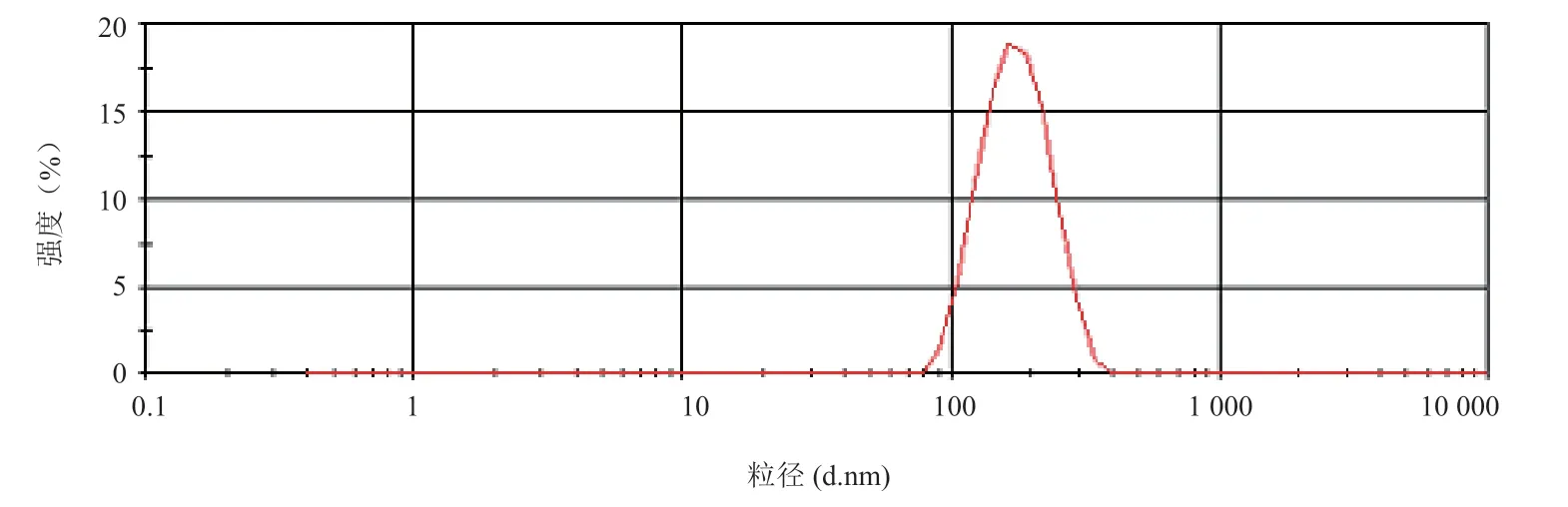
图3 EGCG-EL的粒径分布
2.3.3 pH值 磷脂易氧化水解,其氧化水解速率受环境pH值的影响较大,只有在一定的pH范围内才比较稳定。因此,本文采用pH计对EGCG-EL的pH值进行测定。本文测得EGCG-EL的pH值为6.38±0.10,利于脂质体和药物的稳定性。
2.3.4 EGCG-EL的包封率 采用超滤-HPLC法测定EGCG-EL的包封率。精密量取EGCG-EL 0.2 ml置10 ml量瓶中,加纯化水稀释至刻度,摇匀,取稀释后的样品,置超滤离心管中(超滤膜截留相对分子量50 000 Da),10 000 r/min离心20 min,测定游离药物浓度(C游离),另精密量取EGCG-EL 0.1 ml置10 ml量瓶中,加一定量的甲醇后超声,采用流动相稀释至刻度,测定总药量(C),按包封率(%)=(C-C游离)÷C×100%计算3批样品的包封率为(65.91±1.45)%。
2.3.5 EGCG-EL中药物含量测定 采用HPLC测定EGCG-EL中EGCG的含量。精密称取0.1 ml置10 ml量瓶中,加入3 ml甲醇后超声,采用流动相稀释至刻度。取上清液过 0.45 µm 滤膜。精密量取20 µl注入液相色谱仪,记录色谱图,采用标准曲线法计算EGCG的含量。结果显示3批样品的含量为(2.21±0.02)mg/ml。
2.4 大鼠体外经皮渗透性及皮肤滞留量考察
2.4.1 离体皮肤的制备 取断颈处死的雄性SD大鼠,用电动剃毛器剔除大鼠腹部鼠毛,剥离腹部皮肤,并除去皮肤上的脂肪及多余组织,生理盐水漂洗干净后将其放置-20℃条件保存,并在7 d内使用。
2.4.2 体外经皮渗透性试验 采用 Franz 扩散装置进行体外经皮渗透性试验,将处理好的大鼠皮肤固定于供给池和接受池之间,分别取 2 ml EGCG-EL及EGCG溶液剂(EGCG-S),置于供给池中,并将其顶部密封。接受池中注满生理盐水,使得接受液与鼠皮充分接触,无气泡。将此装置置于(32 ± 0.5)℃恒温水浴中,磁力搅拌,分别于0.5、1、2、4、6、12、24 h取出5 ml接受液,并立即补加同温同体积新鲜接受液。采用 HPLC法测定不同时间接受液中EGCG的浓度,按如下公式计算单位面积累积透过量(Q):Q=Cn校×V/A 。以时间(t)为横坐标,Q为纵坐标作图,得到药物体外经皮渗透曲线,见图4。由图可知,随着时间的延长,EGCG-EL的累积透过量要明显的大于EGCG-S,但二者的药物累积透过量总体均很小,这会使血液中的药量降低,不良反应减少,有利于皮肤科疾病的治疗。Cn校=Cn测+Vi÷V×∑Cp,式中Q为t时间单位面积累积透过量(µg/cm2),Cn校为校正后接受液中药物的浓度;Cn测为第n次取样测得接受液中药物的浓度;V和Vi分别为接受池中接受液的总体积和每次取样体积;∑Cp为该取样点前各点的测定浓度之和;A为有效透皮扩散面积。
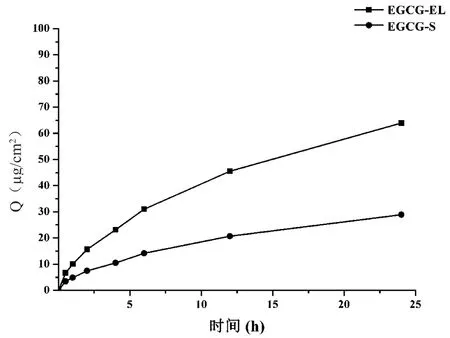
图4 EGCG两种制剂单位面积累积透过量
2.4.3 皮肤内药物滞留量试验 待透皮试验结束后,取下皮肤,反复用蒸馏水洗净皮肤表面残存的药物,滤纸吸干水分后剪去周边的皮肤,称重,将皮肤剪碎,置于超声管中,加入3 ml甲醇,超声5 min,将上清液移入至5 ml量瓶中,加流动相稀释至刻度,过滤,取续滤液20 µl进样,测定皮肤中滞留的药物浓度,计算单位面积皮肤中EGCG的滞留量,结果如表1。由表1可知,EGCG-EL的大鼠体外皮肤滞留量为(526.82±6.37)µg/g,要明显的高于EGCG-S(P<0.001)。
表1 EGCG两种制剂单位面积皮内滞留量(±s)

表1 EGCG两种制剂单位面积皮内滞留量(±s)
制剂平均滞留量(µg/g)EGCG-S 114.10±8.75 EGCG-EL 526.82±6.37
3 讨论
本研究采用乙醇和丙二醇组成的混合醇代替单纯的乙醇制备的EGCG-EL,一方面能够通过增加醇脂质体的黏度及负电荷来提高EGCG-EL的稳定性,另一方面降低了乙醇在处方中所占的比例,抑制乙醇挥发且减弱了其对皮肤的刺激性。
采用超滤-HPLC法测定EGCG-EL的包封率发现该制剂的包封率偏低,这是因为亲水性小分子药物在制备过程中易发生泄露导致,尽管如此,EGCGEL的透皮性能仍优于普通溶液剂。
体外经皮渗透性试验结果显示,EGCG在二元醇脂质体中的累积透过量及皮肤滞留量要显著大于溶液剂,这是由于乙醇的加入一方面改变了角质层脂质分子的紧密排列,增加了脂质的流动相,另一方面乙醇能够增加二元醇脂质体膜的柔韧性及流动性,使得在经皮给药的过程二元醇脂质体易于变形,透过紊乱的角质层,从而增加药物的皮肤渗透性。同时在经皮渗透的过程中二元醇脂质体能够与角质层的脂质融合,释放药物,这种融合作用会进一步增加EGCG的渗透性。通过对制剂的皮肤滞留量研究发现,EGCG-EL与EGCG溶液剂相比能显著提高EGCG在皮肤中的滞留量。

