五味子-甘草配伍的调血脂作用及对甘油三酯合成途径的影响
王晓艳,李伟霞,张 辉,张明亮,孟祥乐,贾文汇,牛 璐,王 炎,唐进法
(河南中医药大学 1.第一附属医院中药临床评价技术河南省工程实验室,河南 郑州 450000,2.药学院,河南 郑州 450046)
五味子SchisandraechinensisFructus为木兰科植物五味子Schisandrachinensis(Turcz.) Baill.的干燥成熟果实,习称“北五味子”。因其具有酸、苦、甘、辛、咸等五味而得名,具有收敛固涩、益气生津、补肾宁心的功效,用于久嗽虚喘、梦遗滑精、遗尿尿频、久泻不止、自汗盗汗、津伤口渴、内热消渴、心悸失眠[1]。课题组前期研究发现,五味子中活性最强的联苯环辛烯类木脂素-五味子素B(Schisandrin B,Sch B),一次大剂量(0.1 ~ 2 g·kg-1)给药,在一定时间内(12~96 h)与临床高脂血症-脂肪肝-肝损伤的发病过程极为接近,且此过程可被临床常用降血脂药-非诺贝特所逆转[2-4]。Sch B在人体中的最佳日剂量尚未确定,药典规定五味子用量2~6 g,但有文献研究建议成人五味子剂量为0.5~1.5 g,每天两次[5],相当于Sch B每天20~60 mg[6]。临床上所用五味子剂量较大,远远超出了五味子的推荐用量,相当的Sch B的含量也超出了引起小鼠高脂血症的最低剂量的人的等效剂量(973 mg),致使五味子存在诱发高脂血症和脂肪肝的潜在风险。
甘草GlycyrrhizaeRadixEtRhizoma为豆科植物甘草GlycyrrhizauralensisFisch.、胀果甘草GlycyrrhizainflataBat.或光果甘草GlycyrrhizaglabraL.的干燥根和根茎,味甘、性平,可缓和诸药之偏性,还能缓急止痛,顾护肝脏之气血,有“解毒之王”之称。临床上含五味子的中药方剂,多含甘草,如桂苓五味甘草汤含甘草半升,小青龙汤中甘草三两,养阴益气汤中含甘草15 g,茵陈退黄汤中甘草3 g,各方中五味子-甘草配比用量不同。上述方剂临床应用并未发现脂代谢紊乱、诱发高脂血症和脂肪肝现象,或与甘草的“解毒”作用密切相关。
血液中甘油三酯(triglyceride,TG)主要有内源性和外源性两个途径,外源性途径是指食物中的脂肪在小肠分解为脂肪酸、甘油二酯和甘油一酯,当这些产物吸收入小肠细胞后合成TG,并和胆固醇一起形成乳糜微粒,通过淋巴系统进入血液循环[7]。而内源性途径则是在肝脏中进行,肝脏会将糖类转化成脂肪酸或从头合成脂肪酸,脂肪酸继而与甘油酯化形成TG,最后与载脂蛋白B等脂蛋白装配形成极低密度脂蛋白,并分泌入血[8]。而固醇调控原件结合蛋白-1c(sterol regulatory element-binding protein-1c,SREBP-1c)和过氧化物酶体增殖物激活受体α(peroxisome proliferator-activiated receptor-α,PPARα)是TG合成途径中重要的调控因子,通过对其下游靶基因的调节,进而影响脂肪酸和TG的合成。
基于此,本实验拟以五味子和甘草为研究对象,观察大剂量五味子对正常小鼠血脂的影响,同时观察配伍甘草后的血脂变化,以期为五味子临床合理应用提供数据支撑。并针对TG的合成途径进一步探讨其调脂的作用机制。
1 材料与方法
1.1 仪器Neofuge 1600R型低温台式高速离心机(上海力申科学仪器有限公司);Multiskan FC型酶标仪(赛默飞世尔科技公司);ECLIPSE 80i型显微镜(日本尼康);Rm-2235型石蜡切片机(德国莱卡公司);TL-820型冰冻切片机(湖北泰维科技实业有限公司);EG1150H型包埋机(德国莱卡公司)。
1.2 试剂TG(批号20190615)、总胆固醇(total cholesterol,TC,批号20190615)、高密度脂蛋白胆固醇(high-density lipoprotein-cholesterol,HDL-C,批号20190316)、低密度脂蛋白胆固醇(low-density lipoprotein-cholesterol,LDL-C,批号20190318)、丙氨酸转氨酶(alanine aminotransferase,ALT,批号20190320)试剂盒均购自南京建成生物工程研究所;脂肪酸合成酶(fatty acid synthase,FAS,批号0911E19)、乙酰辅酶A羧化酶(acctyl-COA carboxylase,ACC,批号0911E19)、乙酰基辅酶A氧化酶(acy-CoA oxidase,ACO,批号0911E19)、甘油三磷酸酰基转移酶(Glycerol triphosphate acyltransferase,GPAT,批号0911E19)ELISA试剂盒均购自上海茁彩生物科技有限公司;SREBP-1c(货号ab28481)抗体购自abcam公司;PPARα(货号GB11163)购自武汉塞维尔生物科技有限公司。
1.3 药物与其制备五味子(批号19060102,郑州瑞龙制药股份有限公司);甘草(批号19080101,郑州瑞龙制药股份有限公司);称取五味子及五味子-甘草不同配比(1 ∶1、1 ∶1.5)混合药材适量,粉碎,用5倍量80%乙醇浸泡0.5 h后,回流提取两次,第一次回流1.5 h,第二次回流2 h。提取物过滤得滤液,合并滤液,用旋转蒸发仪回旋至无醇味后浓缩,得五味子醇提物及五味子-甘草不同配比浸膏。其中,五味子组浸膏生药含量为1.43 g·g-1,五味子-甘草(1 ∶1)和五味子-甘草(1 ∶1.5)浸膏中五味子生药含量分别为0.465和0.428 g·g-1。
1.4 动物分组与给药ICR小鼠,♂,体质量(22.47±0.68)g,SPF级,购自北京维通利华实验动物技术有限公司,合格证号为SCXK(京)2016-0006。本实验通过河南中医药大学第一附属医院实验动物伦理委员会批准(批准号YFYDW2019006)。ICR小鼠分为4组,分别为:正常对照组(Control)、五味子组(SchisandraechinensisFructus,SF)和五味子-甘草配伍2个配比组(SchisandraechinensisFructus-GlycyrrhizaeRadixEtRhizoma,SG,1 ∶1,1 ∶1.5),每组10只。五味子-甘草配伍比例依据桂苓五味甘草汤(1 ∶1)及养阴益气汤(约1 ∶1.5)。给药组均按照五味子药典规定临床等效剂量的5倍量(3.9 g·kg-1)进行灌胃给药。对照组小鼠灌胃给予等体积的生理盐水,每日灌胃给药1次,连续10 d共给药10次。
1.5 生化法检测血脂变化末次给药8 h后,小鼠经眼眶取血,置于EP管中,室温静置2 h后,3 500 r·min-1离心10 min(4 ℃),取血清,-80 ℃分装冻存。严格按照试剂盒说明书,检测小鼠血清TG、TC、HDL、LDL含量。
1.6 生化法检测肝功能变化取出分装冻存的血清至室温,严格按照试剂盒说明书,利用酶标仪检测血清中ALT活性。
1.7 肝脏病理学检查取血后立即取出肝脏,取同一部位的肝脏组织块约0.5 cm3,迅速投入10%的中性福尔马林中充分固定。固定48 h以上的小鼠肝脏组织,制备常规肝脏病理学切片,HE染色后,观察其病理学变化。
1.8 酶联免疫吸附法检测肝脏FAS、ACC酶活性和GPAT、ACO水平各组肝脏组织,用生理盐水经组织匀浆机研磨成组织匀浆,4 ℃,4 000 r·min-1离心15 min后,取上清液,采用ELISA法,严格按照试剂盒说明书,利用酶标仪对肝脏FAS、ACC活性和GPAT、ACO水平进行检测。
1.9 免疫组化法检测肝脏受体SREBP-1c、PPARα蛋白表达采用免疫组化法检测肝脏组织中SREBP-1c、PPARα蛋白的表达。切片脱蜡至水,PBS冲洗3×5 min。柠檬酸抗原修复5~10 min,自然冷却。PBS浸泡5 min,3次(3×5 min)。3%H2O2封闭内源性过氧化物酶,室温20 min。PBS浸泡5 min,3次。滴加一抗(1 ∶100)50 μL/片,4 ℃过夜。PBS浸泡5 min,3次。滴加HRP标记二抗50 μL/片,37 ℃孵育30 min,PBS浸泡5 min,3次。DAB显色,显微镜下控制,自来水中止。苏木精复染,梯度酒精(80%-95%Ⅰ-95%Ⅱ-100%Ⅰ-100%Ⅱ)脱水,二甲苯(I和II)透明,中性树胶进行封片,置于光学显微镜下进行观察并拍照,Image Pro Plus 6.0 软件分析平均吸光度值。
1.10 统计学方法采用SPSS 20软件对数据进行统计分析,计量资料多组间比较采用单因素方差分析(One-way ANOVA),两组间比较用t检验。
2 结果
2.1 血脂变化与Control相比,SF组小鼠血清TG和TC水平明显升高(P<0.05),血清HDL水平明显降低(P<0.05)。与SF相比,SG 1 ∶1可明显降低血清TG水平(P<0.05)。见Tab 1。
2.2 肝功能变化与Control组比,SF组小鼠血清ALT活性明显升高,但无统计学意义(P>0.05)。与SF组相比,SG 1 ∶1.5可明显降低血清ALT活性(P<0.05)。见Fig 1。
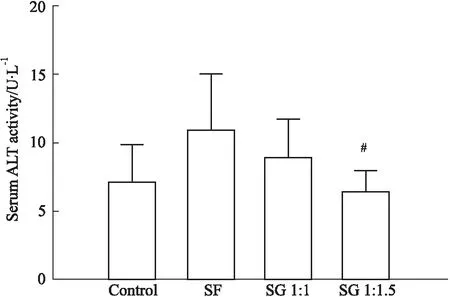
Fig 1 Activity of serum n=10)
2.3 肝脏组织病理学变化在光镜下,对照组可见细胞形态规则,肝小叶结构正常,细胞质均匀,肝细胞自中央静脉为中心,呈放射状排列,伸向肝小叶周边部,肝血窦窦间隙清晰;五味子组肝小叶轮廓不清晰,中央静脉周围肝细胞条索少见,肝细胞内出现较多的脂肪空泡,散布在整个胞质中,小叶内有少量炎性细胞浸润;五味子-甘草 1 ∶1组部分肝细胞结构异常,中央静脉周围肝细胞索少见,部分细胞内可见较大的脂肪空泡;五味子-甘草 1 ∶1.5组肝细胞条索依稀可见,有部分细胞内存在少量的脂肪空泡。见Fig 2A-D。
2.4 肝脏组织FAS、ACC活性和GPAT、ACO水平变化与Control组比,SF组小鼠ACC活性和GPAT水平明显升高(P<0.05,P<0.01);SG 1 ∶1和SG 1 ∶1.5组小鼠GPAT水平明显升高(P<0.05,P<0.01);SG 1 ∶1和SG 1 ∶1.5组小鼠ACO水平明显降低(P<0.01)。与SF相比,SG 1 ∶1组GPAT和ACO水平明显降低(P<0.05,P<0.01)。见Tab 2。
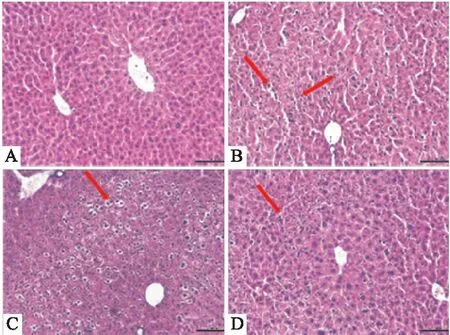
Fig 2 Histopathological changes of liver (×200)(n=4)
2.5 肝脏组织SREBP-1c、PPARα蛋白表达变化SREBP-1c蛋白阳性表达为棕褐色。SF小鼠SREBP-1c颜色较深,图像分析结果表明,蛋白表达量较对照组明显上调(P<0.01)。SG 1 ∶1和1 ∶1.5组棕褐色较五味子组浅,图像分析结果表明,SREBP-1c蛋白表达量较SF组明显下调(P<0.05,P<0.01)。见Fig 3。
PPARα蛋白阳性表达为棕褐色。结果可见,Control组小鼠PPARα蛋白表达量较多,SF组小鼠较对照组阳性表达减少,图像分析结果表明,PPARα蛋白表达明显降低(P<0.01),SG 1 ∶1和1 ∶1.5组阳性染色较五味子组增多,图像分析结果表明PPARα蛋白表达较SF组明显增多(P<0.05,P<0.01)。见Fig 4。
3 讨论
现代研究表明五味子在中枢系统、心血管系统、肾脏和生殖系统等方面应用广泛,具有保护肝脏、抗氧化、抗肿瘤、抑菌、降血脂和抗炎等作用[9],并有研究表明五味子具有“适应原”样作用[10],在中枢系统具有“双向调节”作用。而作为五味子中含量最高的联苯环辛烯类木脂素,Sch B(50~200 mg·kg-1)小剂量可降低高胆固醇血症小鼠肝脏TC和TG的含量,一次大剂量给药能时间和剂量依赖性的升高小鼠血TG含量,并伴随肝TG含量升高[2-3],存在“双向调节”作用。前期研究发现,低剂量五味子醇提物可降低高胆固醇血症小鼠血清和肝脏TG含量[11],本实验发现高剂量的五味子可升高正常小鼠血TG和TC含量,说明五味子在调节血脂方面存在“双向调节”作用。

Tab 1 Influence of Schisandrae Fructus and compatible with Glycyrrhiza on levels of serum TG, TC, HDL and LDL in normal n=10)

Tab 2 Influence of Schisandrae Fructus and compatible with Glycyrrhiza on activities of liver ACC and FAS and GPAT, ACO levels in normal n=10)
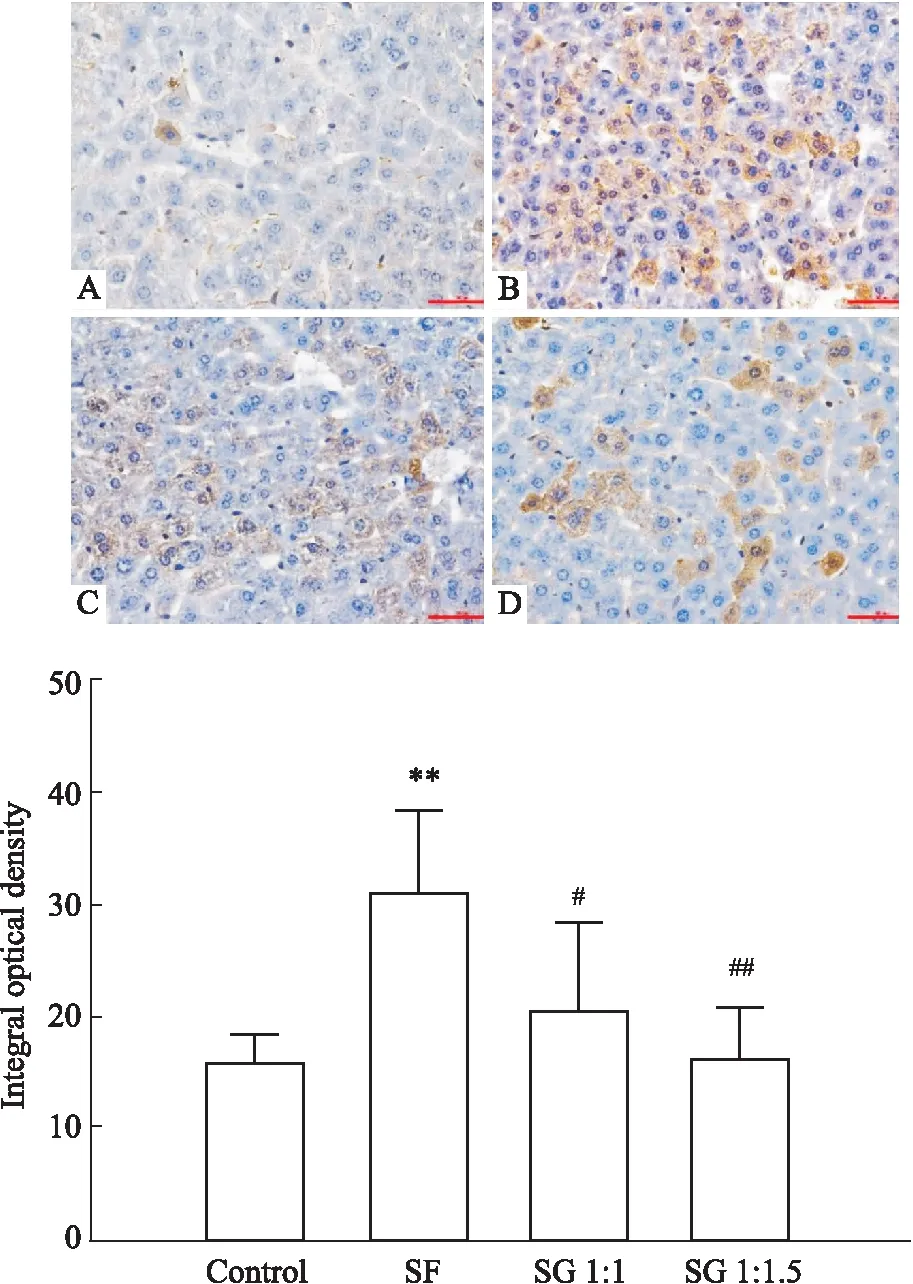
Fig 3 Expression of liver tissue SREBP-1c protein detected by
中药剂量是指临床应用时的分量,它主要指明了每味药的成人一日量。其次指方剂中每味药之间的比较分量,也即相对剂量。准确地掌握用药剂量是确保用药安全、有效的重要因素之一。由于诸多原因,中药饮片超剂量应用现象越来越普遍,由此直接导致了我国中药资源的大量浪费,并且有研究报道超剂量使用与不良反应的发生存在一定的关联性,进而导致中药饮片的不良反应发生率日益增多。中药的配伍应用是中医用药的主要形式,其作用是综合性的表现,并非指所有组成药物的功效和剂量的简单组合,通过配伍可提高药效、降低毒副作用、适应复杂病情、扩大治疗范围并预防药物性中毒。本实验结果显示,与五味子组比,五味子-甘草1 ∶1组血清TG含量明显降低,表明甘草与五味子配伍可明显降低大剂量五味子诱发高甘油三酯血症的风险。
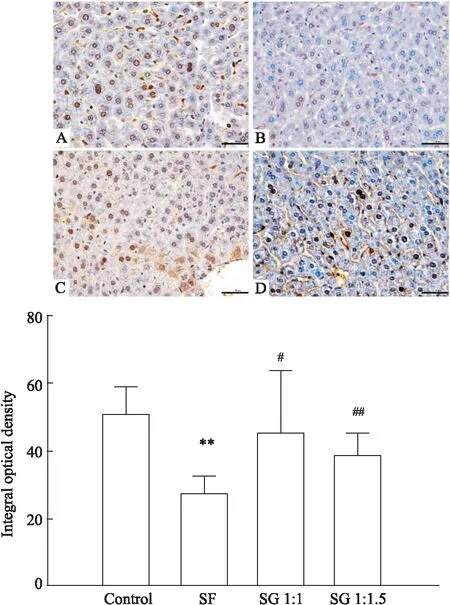
Fig 4 Expression of liver tissue PPARα protein detected
HDL和LDL是体内运载磷脂和胆固醇最重要的蛋白。HDL具有逆向运输胆固醇功能,即将肝外组织中过多的胆固醇从外周组织转运到肝脏进行代谢,通过胆汁酸或者直接通过胆汁从肠道排出,以防胆固醇在这些组织中过多地聚集,因此被认为是好的脂蛋白[12]。LDL由VLDL转变而来,能将肝脏中的TC转移到外周组织(如血管壁),易造成动脉粥样硬化,从而增加了冠心病的危险性,通常被称为坏的脂蛋白[13]。本实验结果显示,大剂量五味子可明显降低血清HDL水平,可能为其升高血清TC含量的机制之一。
SREBP-1c和PPARα在TG合成途径中发挥重要作用[14]。肝脏中SREBP-1c作为负责调解脂肪酸和甘油三酯的重要调控蛋白,主要通过调节其下游多种参与脂肪酸和甘油三酯合成酶的靶基因,包括ACC、FAS、GPAT等的表达来调节肝脏中TG的合成。ACC作为脂肪酸合成的限速酶,与脂肪合成速率密切相关;而FAS是内源性脂肪酸合成的关键酶,在机体脂质沉积过程中发挥重要作用[15]。GPAT是TG合成的关键限速酶之一,研究报道[16],敲除GPAT基因可以减少小鼠肝脏TG沉积并改善肝脏胰岛素抵抗。本实验结果显示,五味子组小鼠表现为肝脏SREBP-1c蛋白表达量、ACC活性和GPAT水平明显升高,说明五味子增加肝脏中TG合成的机制可能是通过增强肝脏SREBP-1c蛋白的表达,并上调肝脏ACC活性及GPAT含量。与五味子比,五味子-甘草 1 ∶1组GPAT水平明显降低,说明甘草配伍五味子降低五味子升高的TG含量可能与调节GPAT有关。
PPARα作为一类能被过氧化物酶体增殖物激活的核转录因子,主要通过影响脂蛋白及长链脂肪酸的代谢,进而调控脂质代谢,研究表明,PPARα激活后,可直接增加脂肪酸的氧化,减少脂肪的积聚,维持内环境的稳定[17],同时可上调其下游基因ACO的表达,从而降低TG的合成水平。ACO作为脂肪酸β-氧化反应的关键酶之一,可催化肝脏细胞内脂滴的氧化分解过程[18]。实验结果发现,五味子组小鼠肝脏PPARα蛋白表达量明显降低,ACO水平有降低趋势,五味子-甘草 1 ∶1和1 ∶1.5组PPARα蛋白表达量较五味子组明显升高,表明甘草通过上调PPARα蛋白的表达,从而加速脂肪酸的β氧化分解,最终可减少高剂量五味子诱发的TG合成增加。
综上表明,高剂量的五味子一方面增加TG的合成速度,其机制可能是增加肝脏中SREBP-1c的蛋白表达,上调脂肪酸合成过程的限速酶ACC活性和TG合成过程中关键酶GPAT含量;另一方面,降低脂肪酸的β氧化,增加TG在肝脏中的沉积,其机制可能为下调肝脏PPARα蛋白的表达,降低脂肪酸β-氧化途径的关键酶ACO的活性。通过以上两种途径联合增加肝脏中TG的合成,诱发高脂血症,而甘草配伍五味子后可通过调节TG合成途径相关蛋白,降低五味子诱发的高脂血症风险。由此说明,临床应用五味子时需对其用药剂量慎重考虑,建议配伍同等剂量的甘草,避免其在血脂方面的“双向调节”作用,为五味子的临床合理应用提供数据支撑。
(致谢:本实验在河南中医药大学第一附属医院中药临床评价技术河南省工程实验室、中药药代动力学实验室开展,感谢各位老师和同学的帮助。)

