吴茱萸碱通过TRIB2/AKT信号通路诱导人白血病细胞K562凋亡
牟凤林,刘北忠,,余莉华,但文冉,李 健,熊 玲,钟 梁,叶 娇
(1.重庆医科大学临床检验诊断学,教育部重点实验室,重庆 404016;2.重庆医科大学附属永川医院,重庆 402160)
慢性粒细胞白血病(CML)是一种与造血干细胞失调相关的骨髓增生性疾病,它以9号染色体上的ABL1基因与22号染色体上的BCR基因融合为遗传学特征,其编码的BCR/ABL融合蛋白可持续增强酪氨酸激酶的活性,进而激活下游信号通路,导致肿瘤的发生与发展[1]。临床统计显示,每10万人中出现1~2例发病患者,约占成人新确诊白血病病例的15%,其发病率呈增长趋势[2]。目前,已有不同类型的抗CML药物应用于临床。其中,BCR/ABL酪氨酸激酶抑制剂(TKIs)作为一线临床用药,取得了较好的治疗效果,大大延长了患者生存率,但是,该药物具有一定的副作用。此外,CML慢性期患者易产生耐药,复发以及急变等情况,使治疗效果不佳[3]。因此,寻找新的治疗方法和治疗靶点,以提高患者的顺应性和生活质量至关重要。
吴茱萸碱(evodiamine,EVO)是一种从吴茱萸中提取的生物碱,具有多种生物活性,如抗炎、神经保护和抗肿瘤等作用[4-6]。有研究报道[7-10],EVO对乳腺癌、胃癌、肺癌、肝癌等多种肿瘤都展现出潜在的抗肿瘤活性,但其对白血病细胞增殖与凋亡的影响及作用机制尚未完全阐明,仍待进一步研究。
丝氨酸/苏氨酸激酶 AKT作为一种原癌基因,在调控细胞代谢、生长、增殖、存活、转录以及蛋白质合成方面发挥重要作用。在肿瘤细胞中,过度激活的AKT会导致NF-κB和mTOR通路活化,使细胞产生抗凋亡作用[11]。假激酶Tribbles 2 (TRIB2)也是一种致癌基因,其转录受到Wnt/TCF所调控,能抑制FOXO蛋白活性,影响着黑色素瘤和白血病的发生及发展。有文献报道[12],TRIB2能与AKT形成蛋白复合物而激活AKT,最终诱导肿瘤细胞耐药,临床研究也显示TRIB2的表达水平与患者的预后相关。因此,抑制AKT的激活,可明显诱导多种肿瘤细胞凋亡的发生[13],有研究表明,EVO可通过抑制PI3K/AKT通路诱导黑色素瘤、肝癌、胰腺癌等肿瘤细胞的凋亡[14],但其在白血病细胞中是否可通过抑制AKT通路诱导细胞的凋亡,以及TRIB2在EVO抑制AKT信号通路中的具体作用尚不明确。因此,本研究以人白血病细胞K562细胞为模型,探究EVO抑制其增殖的TRIB2/AKT相关机制。
1 材料与方法
1.1 细胞株细胞株:人白血病细胞K562由重庆医科大学附属第一医院馈赠。
1.2 主要试剂与仪器主要药品与试剂:吴茱萸碱,SC79和SKL2001购自美国Selleck公司(货号:S2382,S786303,S832001);二甲基亚砜(DMSO)购自美国Sigma公司(货号:L2630,V90090);胎牛血清购自乌拉圭Lonsera公司(货号:S711-001S);高糖培养基DMEM购自美国赛默飞世尔公司;蛋白浓度测定试剂盒、凝胶配制试剂盒、青链霉素购自中国碧云天公司;Cell Counting Kit-8(CCK-8)购于日本DOJINDO公司;iScriptTM逆转录试剂盒购自美国Bio-Rad公司(货号:170-8840);一抗抗体TRIB2、AKT、p-AKT、IκBα、p-IκBα、NF-κB p65、p-NF-κB p65、caspase-3、Bcl-2购自美国SantaCruz公司,Cleaved caspase-3(c-caspase-3)、β-actin与二抗抗体(Goat anti-rabbit、goat anti-mouse)购自Cell Signaling Technology公司;Annexin V-FITC/PI细胞凋亡检测试剂盒购自上海碧云天生物科技研究所(货号:C1062L)。引物由上海吉玛制药技术有限公司合成:TRIB2:上游5′-CACAGGTCTACCCCCATCAC-3′,下游5′-CCCGATACAAGAAACGCAAT-3′。主要仪器:低温高速离心机(平凡仪器,TGL-185);酶标仪(美国Thermo Scientific,Multiskan MK3);荧光定量PCR仪(美国Bio-Rad,CFX96 Optics Module);SDS-PAGE电泳仪(美国Bio-Rad,Power Pactm Basic);流式细胞检测仪(美国艾森生物科学公司,NovoCyteTM)。
1.2 方法
1.2.1细胞培养与收集 K562细胞经复苏后,使用含10%胎牛血清、1%青链霉素的DMEM培养基适当混匀细胞,于含5% CO2、饱和湿度的细胞培养箱中37 ℃恒温培养,并选取处于对数生长期的K562细胞进行实验。
1.2.2药液配制 EVO使用DMSO溶解,配制浓度为10 mmol·L-1的储备液,-20 ℃避光分装保存备用,实验前使用DMEM培养基稀释至所需浓度进行实验,DMSO的使用终浓度小于0.1%。
1.2.3CCK-8法检测细胞活性 取处于对数生长期的人白血病K562细胞,以1×103个/孔的密度将细胞接种于96孔板,培养过夜后重新更换完全培养基,加入浓度为1、2、4、8、16、32、64 μmol·L-1的EVO药液,每孔200 μL,作为实验组。另设置两组,分别加入等量含0.1% DMSO的完全培养基和正常完全培养基作为溶剂组和对照组。细胞分别培养24、48 h后,据 CCK-8试剂盒说明书检测各孔的吸光度(A),最后计算细胞存活率:细胞存活率/%=(A实验组-A溶剂组)/(A对照组-A溶剂组)×100%。
1.2.4流式细胞术检测细胞凋亡 收集对数期生长的K562细胞,按5×105个/孔加入6孔培养板中,实验组分别加入不同浓度的EVO药液处理细胞或先使用SKL2001预处理细胞后,再加入浓度为16 μmol·L-1的EVO药液,按试剂盒说明书先后加入Annexin V-FITC和PI室温避光孵育10 min,随即使用流式细胞仪进行检测。
1.2.5qRT-PCR检测细胞mRNA的表达 按照“1.2.4”项下方法接种细胞,实验组分别加入浓度为4、8、16 μmol·L-1的EVO药液处理细胞,对照组加入与实验组等量的溶媒,每组3个复孔,培养24 h。使用TRIzol试剂提取总RNA,然后按逆转录试剂盒说明书合成cDNA,以cDNA为模板进行PCR扩增,PCR反应的循环条件为:94 ℃预变性3 min,进入循环;94 ℃变性30 s,50 ℃退火30 s,72 ℃延伸30 s,共循环35次;最后72 ℃延伸5 min。按照iQTMSYBR Green Supermix试剂说明书配制扩增产物,于荧光定量PCR仪中进行检测。
1.2.6Western blot检测细胞蛋白水平的表达 按照“1.2.4”项下方法接种细胞,实验组分别加入浓度为4、8、16 μmol·L-1的EVO药液处理细胞或先使用SC79(10 μmol·L-1)预处理细胞30 mine或者SKL2001(5 μmol·L-1)预处理细胞24 h后,再加入浓度为16 μmol·L-1的EVO药液,对照组加入与实验组等量的溶媒培养48 h,抽提细胞全蛋白。蛋白进行SDS-PAGE电泳,电转至硝酸纤维素膜上,5%脱脂奶粉室温封闭1 h,分别加入一抗(TRIB2、caspase-3、Cleaved caspase-3、Bcl-2、p-AKT、p-IκBα、p-NF-κB p65、AKT、IκBα、NF-κB p65、β-actin,稀释比例均为1 ∶1 000)后4 ℃孵育过夜;TBST液洗膜3次,每次5 min,加入对应属性的二抗(Goat Anti-Rabbit和Goat Anti-Mouse稀释比例均为:1 ∶10 000)室温孵育1 h,再用TBST洗膜,于成像系统中检测蛋白表达情况。独立实验重复3次。
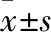
2 结果
2.1 EVO对K562细胞增殖的影响如Fig 1,检测结果显示,与对照组相比,EVO可抑制K562细胞的生长,且呈现浓度和时间依赖性。随着EVO浓度的升高及作用时间的延长,细胞的存活率降低,其作用K562细胞48 h的IC50为16 μmol·L-1。
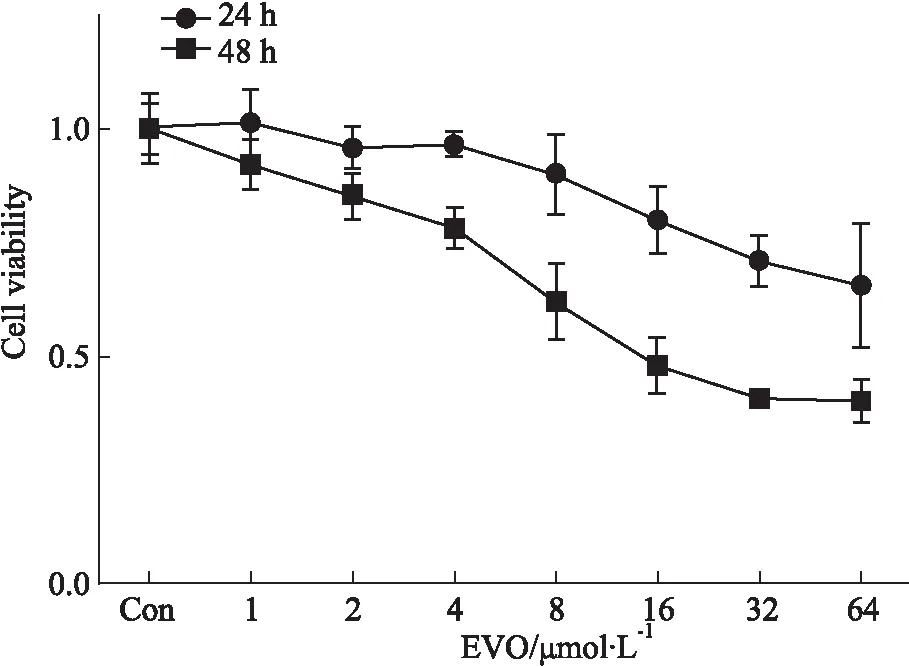
Fig 1 Effect of EVO onproliferationof K562 cells
2.2 EVO对K562细胞凋亡的影响如Fig 2,检测结果显示,与对照组相比,EVO可诱导K562细胞凋亡,且呈现浓度依赖性。随着EVO浓度的增大,细胞凋亡率明显升高,当EVO浓度为16 μmol·L-1时,细胞凋亡最为明显(P<0.01)。
2.3 EVO对TRIB2mRNA表达的影响如Fig 3,检测结果显示,与对照组相比,EVO可降低TRIB2 mRNA的表达,且呈现浓度依赖性。随着EVO浓度的增大,TRIB2 mRNA的表达量降低,当EVO浓度为16 μmol·L-1时,TRIB2 mRNA的表达量最低(P<0.01)。
2.4 EVO对TRIB2/AKT信号通路相关蛋白表达水平的影响以不同浓度的EVO处理K562细胞48 h,提取全蛋白,利用Western blot检测TRIB2/AKT信号通路相关蛋白的表达。如Fig 4,结果显示,EVO可抑制TRIB2、p-AKT、p-IκBα、p-NF-κB p65蛋白的表达(P<0.01);凋亡相关蛋白caspase-3以及c-caspase-3升高(P<0.01),Bcl-2降低(P<0.01)。
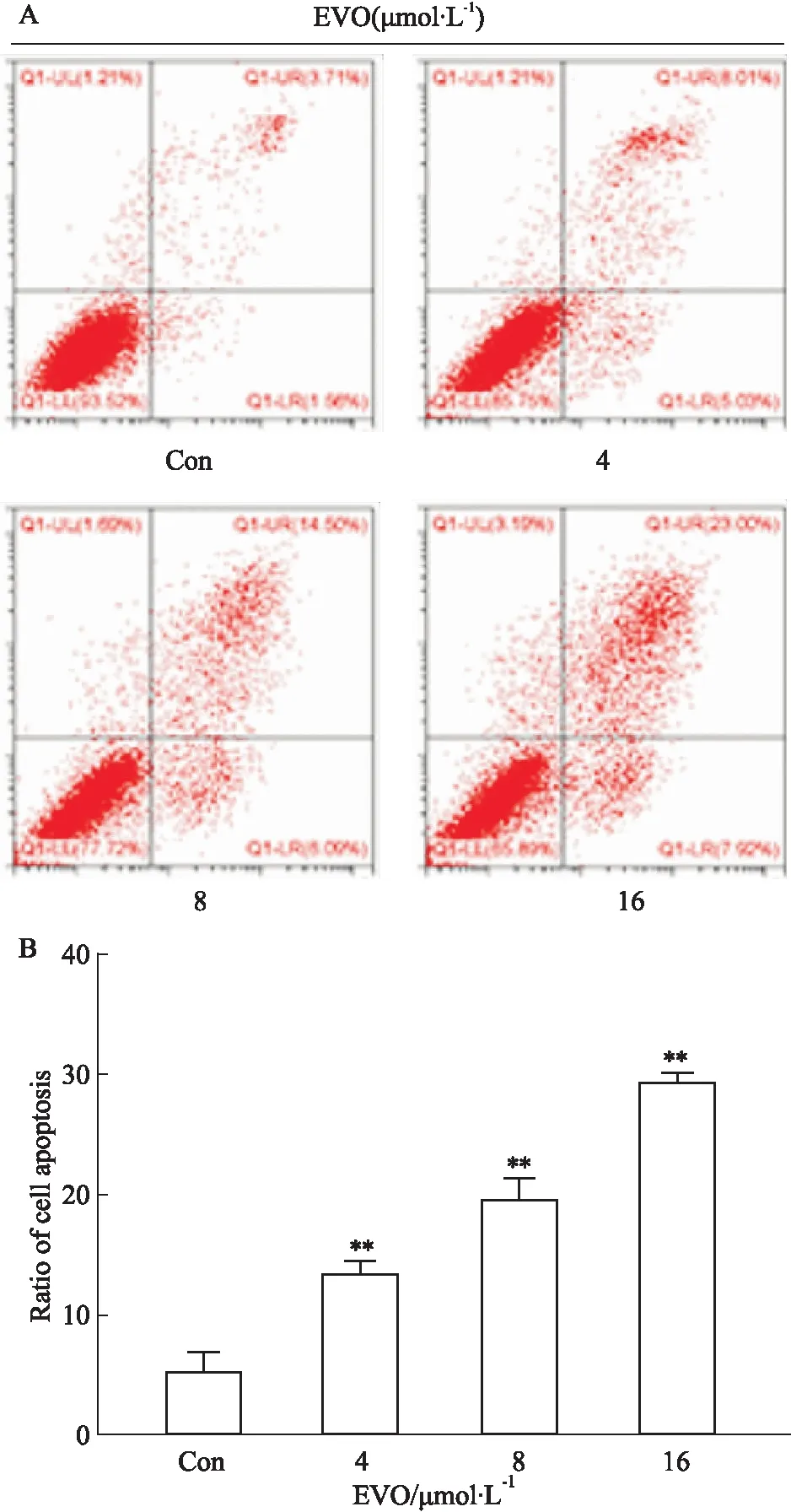
Fig 2 Apoptosis of K562 cells induced by EVO

Fig 3 Expression of TRIB2 mRNA inhibited by EVO
2.5 SC79逆转EVO诱导K562细胞凋亡和AKT 抑制我们以浓度为16 μmol·L-1EVO作用于AKT激活剂SC79预处理后的K562细胞,流式检测细胞凋亡,Western blot检测TRIB2/AKT信号通路相关蛋白的表达。如Fig 5A,流式结果显示,与EVO组相比,经SC79预处理后,EVO诱导K562细胞凋亡率降低(P<0.01)。如Fig 5B,Western blot检测结果显示,与只加入EVO组相比,尽管TRIB2的表达未受SC79影响,但p-AKT、p-IκBα、p-NF-κB p65蛋白的表达升高(P<0.01),凋亡相关蛋白caspase-3和c-caspase-3降低(P<0.01),Bcl-2升高(P<0.05)。
2.6 SKL2001逆转EVO对于TRIB2/AKT信号通路的抑制作用经Wnt激活剂SKL2001预处理24 h再用EVO诱导K562细胞48 h,如Fig 6A所示,TRIB2的表达上升, EVO对于p-AKT的的抑制作用被削弱(P<0.01)。
3 讨论
慢性粒细胞白血病是恶性血液肿瘤中比较常见的一种类型,其发病是由于融合基因BCR-ABL1可持续激活酪氨酸激酶,并通过多条信号通路,如 Ras-Raf-MAPK、STAT-Bcl-XL、PI3K-AKT、NF-κB等,参与和调控白血病细胞的恶性增殖[15]。目前,为了抵抗细胞的耐药性,第三代TKIs已可用于CML的治疗,但其也会带来更严重的副作用和并发症。对于使用TKIs的绝大多数患者几乎需要终生服药,停药可能会引起复发及急变,这便大大增加了患者的经济负担,严重影响了患者的生活质量[16]。因此,开发新的治疗药物和靶点以抵抗药物耐药性、减弱药物副作用和并发症、增加患者依从性便显得尤为重要。

Fig 4 TRIB2/AKT signaling pathway inhibited by EVO
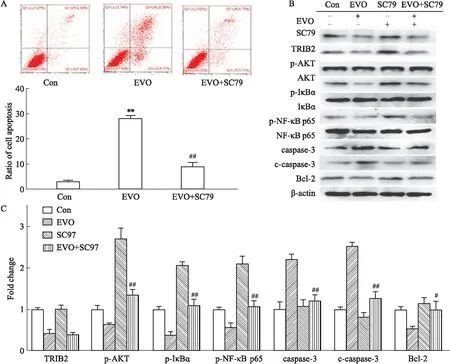
Fig 5 EVO-induced apoptosis of K562 cells inhibited by SC79 and its ability to down-regulate related protein impaired by SC79
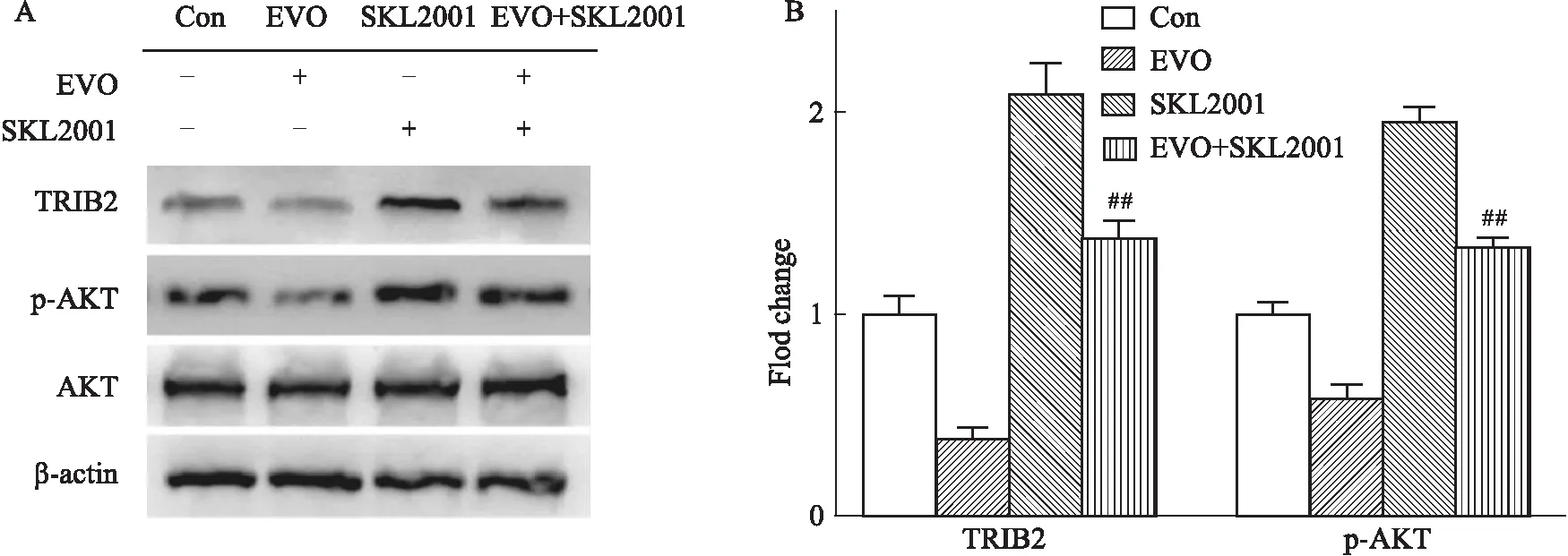
Fig 6 The inhibitory effect of EVO on TRIB2 / AKT signaling pathway reversed by SKL2001
最近的研究探索中,研究人员发现中药的活性成分不仅可以缓解化疗药物治疗白血病的不良反应,而且还能提高患者对于癌症的抵抗能力,提高病人的生存率,减少并发症,改善病人的生活质量,降低复发率。吴茱萸碱从传统中药吴茱萸中提取而来,具有潜在的抗肿瘤活性。相关报道显示,EVO可通过抑制PI3K/AKT通路诱导黑色素瘤、肝癌、胰腺癌等肿瘤细胞的凋亡,或通过激活JNK信号通路来诱导结肠癌细胞的凋亡[17],但其是否可抑制白血病细胞增殖及其相关机制尚处于探索阶段。因此,本研究着重探讨EVO对白血病细胞凋亡的影响,并初步探索其潜在的分子机制。
本研究以K562为细胞模型,首先通过CCK-8法检测EVO对细胞的增殖抑制作用,结果表明EVO可抑制K562细胞的生长,并且呈现时间和浓度依赖性。当作用时间不变,EVO的使用浓度达16 μmol·L-1时,增殖抑制作用达到平衡,再结合IC50,综合选择高、中、低浓度分别为4、8、16 μmol·L-1的EVO处理细胞48 h来进行后续实验。同时,流式结果显示EVO可明显诱导K562细胞凋亡,且呈浓度依赖性,这与CCK-8检测细胞增殖的结果一致。
然后,本研究进一步对EVO诱导K562细胞凋亡进而抑制其增殖的机制进行了探究。相关研究表明,PI3K/AKT信号通路的异常激活广泛存在于恶性肿瘤中,在该信号通路中,AKT的激活起着关键作用,其经磷酸化激活后形成p-AKT,可进一步激活多种下游蛋白,进而调控肿瘤细胞的增殖与凋亡;而假激酶TRIB2可利用自身COP1结构域促进AKT磷酸化,充当PI3K网络的调节因子,激活癌细胞中的AKT,使细胞产生耐药性,已有研究报道[18]TRIB2参与了白血病的发生和发展。因此,本研究采用qRT-PCR检测EVO对TRIB2 mRNA表达的影响,结果显示EVO可降低TRIB2 mRNA的表达,并且呈现浓度依赖性;进一步采用Western blot检测TRIB2、p-AKT及其相关下游蛋白、凋亡相关蛋白的表达水平。结果显示,TRIB2、p-AKT、p-IκBα、p-NF-κB p65蛋白的表达降低,AKT、IκBα、NF-κB p65蛋白的表达没有变化,凋亡相关蛋白caspase-3 与c-caspase-3升高,Bcl-2降低。根据该结果推测EVO通过降低TRIB2蛋白的表达来抑制AKT的磷酸化,进而阻止下游蛋白IκBα激活而释放NF-κB p65,抑制NF-κB p65的磷酸化,最终导致直接调节细胞凋亡的相关蛋白变化,诱导细胞凋亡。另一方面,AKT、IκBα、NF-κB p65蛋白的表达没有变化,提示EVO下调p-AKT是通过抑制TRIB2的表达来抑制AKT的磷酸化,而非直接抑制AKT的表达实现的。AKT的激活剂SC79能抑制EVO诱导K562细胞凋亡,并且其对TRIB2/AKT及其下游蛋白表达的抑制作用也被削弱。之前有报道TRIB2的转录受到Wnt/TCF的转录调控,因此我们使用了Wnt的激活剂SKL2001来激活TRIB2的表达,进一步研究TRIB2在其中扮演的角色。在经过Wnt的激活剂SKL2001预处理后,发现EVO对TRIB2/AKT的抑制作用降低了,这进一步提示了EVO是通过TRIB2/AKT通路来抑制AKT的活性,从而调控凋亡相关蛋白的表达,最终诱导细胞凋亡而抑制其增殖。而Wnt/TCF信号通路在EVO诱导白血病细胞K562凋亡当中扮演的作用还需进一步研究。
综上所述,EVO可明显诱导白血病细胞K562凋亡并抑制其增殖,其机制可能是通过抑制TRIB2/AKT信号通路的激活来引发凋亡相关蛋白的表达,最终抑制细胞生长。本研究显示,EVO具有潜在抗慢性粒细胞白血病的活性,可进一步开发应用于临床。

