EGCG对卵巢癌移植瘤生长及对VEGF和PCNA的影响
于 丹,付明磊,王 娟,秦建莉,皇甫梦杰,陈 旭
(桂林医学院 1. 药学院,广西 桂林 541100;2. 第二附属医院药剂科,广西 桂林 541199)
卵巢癌是妇科恶性肿瘤之一,严重威胁着女性的健康。早期卵巢症状不明显,60%的患者一经诊断就处于晚期,且其5年生存率约为40%[1-2]。晚期卵巢癌的标准治疗策略是铂和紫杉醇联合化疗[3],尽管化疗可以增加卵巢癌病人的生存期,但毒副作用大且易出现耐药,因此,急需寻找疗效好毒性低的抗卵巢癌药物。表没食子儿茶素没食子酸酯(epigallocatechin-3-gallate,EGCG) 是茶叶的有效活性成分,具有抗肿瘤、抗氧化、抗炎、降血压、降血脂及降血糖等药理作用[4-5]。因EGCG毒副作用小,其抗肿瘤活性引起许多研究者的关注,已有研究证实EGCG对肝癌、鼻咽癌、乳腺癌、宫颈癌及大肠癌等多种肿瘤有一定的抑制作用[6]。目前针对EGCG的抗卵巢癌研究主要集中在体外,体内研究报道较少,而且也未见有关其对血管生成因子 (vascular endothelial growth factor,VEGF)和增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)影响的文献报道。本研究拟观察EGCG对卵巢癌 SKOV3细胞裸鼠移植瘤的抑制作用,以卵巢癌一线药物紫杉醇为阳性对照,比较EGCG体内抗卵巢癌的效果;观察EGCG干预后移植瘤中VEGF、PCNA 的表达,探讨其抗卵巢癌的可能机制。
1 材料与方法
1.1 材料
1.1.1细胞及动物 卵巢癌SKOV3细胞为本课题组传代保存。实验动物SPF级♀ 6~8周龄BALB/c 裸鼠,体质量(15±2)g,购买于湖南斯莱克景达实验动物有限公司。许可证号SCXK(湘)2016-0001。
1.1.2药物和试剂 EGCG购自大连美仑生物技术有限公司,胎牛血清购自Gemini公司,RPMI 1640培养基购自Gibco公司,PBS购自索莱宝,PIPA蛋白裂解液购自碧云天公司,逆转录试剂盒购自promega公司,SYBR试剂盒购自康为公司,PCNA与VEGF兔多抗购自万类生物公司,β-actin购自中杉金桥公司,鼠二抗、兔二抗购自北京依玛博科技有限公司,ECL超敏化学发光试剂购自Thermo公司。
1.1.3主要仪器 CO2培养箱(德国Eppendorf公司);生物安全柜(新加坡ESCO公司),超低温冰箱(日本松下公司),电泳槽、转膜槽、荧光定量PCR仪及化学发光仪(美国BIO-RAD公司),低温高速离心机(美国Thermo公司)。
1.2 方法
1.2.1移植瘤模型建立及干预 体外培养卵巢癌SKOV3细胞,待培养至对数生长期,消化收集细胞,磷酸盐缓冲液(PBS)制成细胞悬液(5×107个·L-1),每只裸鼠右侧前肢肩背部皮下接种0.2 mL细胞悬液。待移植瘤长至4 ~ 5 mm时将裸鼠随机分成5组,每组7只。阴性对照组每天腹腔注射生理盐水,EGCG(10、 30、 50 mg·kg-1)每天进行腹腔注射,紫杉醇(5 mg·kg-1)每3 d进行腹腔注射,给药剂量均为0.2 mL/只。给药期间观察裸鼠的生长情况,每2 d记录移植瘤的长径和短径,称量裸鼠体重。给药3周后处死裸鼠,取出皮下移植瘤,瘤块称重后过液氮,并保存于-80 ℃冰箱。依据肿瘤的长短径绘制肿瘤生长曲线,计算抑瘤率。
1.2.2HE染色观察肝组织形态学的变化 取阴性对照组、紫杉醇组和EGCG高剂量组的裸鼠肝组织经多聚甲醛固定后,进行HE染色,光学显微镜下观察上述各组肝组织形态学的变化。
1.2.3RT-qPCR分析VEGF和PCNA基因的表达 将液氮保存的瘤组织研磨后,按照TRIzol RNA提取方法提取总组织RNA,将2 μg RNA逆转录成cDNA稀释5倍备用,采用SYBR法进行实时荧光定量PCR, 反应体系10 μL,引物由Invitrogen上海公司合成,内参为Actin。使用2-ΔΔCt方法计算mRNA的相对表达水平。引物序列见Tab 1。

Tab 1 PCR primer sequence
1.2.4Western blot检测VEGF和PCNA蛋白的表达 将液氮保存的瘤组织研磨后,加入蛋白裂解液,离心后取蛋白上清。以每组30 μg进行SDS-PAGE凝胶电泳,将样品蛋白转印至NC膜上,丽春红观察转膜效果,脱脂牛奶室温封闭NC膜2 h,分别加入VEGF、PCNA和Actin的一抗(1 ∶1 000)4 ℃孵育过夜。PBST洗膜3次后孵育相应的二抗(浓度1 ∶4 000-1 ∶8 000)1 h。ECL发光,Bio-Rad 凝胶成像系统获取条带,并进行灰度值分析和计算。
2 结果
2.1 EGCG抑制移植瘤的生长随着EGCG浓度的增加,裸鼠移植瘤的体积增长速度减慢。干预d 21后,移植瘤的体积分别为:阴性对照组(858.2±97.4) mm3,紫杉醇组(462±41) mm3,EGCG:(10 mg·kg-1) (738.5±115.3) mm3,(30 mg·kg-1) (542±73) mm3,(50 mg·kg-1) (306±64) mm3。提示EGCG可明显地抑制裸鼠移植瘤的生长,并且其抑制作用和浓度有关(Fig 1)。

Fig 1 Growth of ovarian cancer SKOV3 cell xenograft tumor inhibited by EGCG
2.2 裸鼠移植瘤瘤质量和抑瘤率的比较给药21 d后,处死裸鼠,剥取移植瘤,与阴性对照组相比,EGCG中、高剂量组瘤质量(g)明显减小(P<0.01),且随着EGCG浓度(mg·kg-1)的增高,抑瘤率(%)逐渐增加,且呈剂量依赖性。EGCG高剂量组抑瘤率(71.08 %)大于紫杉醇组(48.19 %)(P<0.05)。见Tab 2。
Tab 2 Tumor weight and anti-tumor rate n=7)
2.3 EGCG作用于裸鼠移植瘤后VEGF及PCNA mRNA的表达变化给药不同浓度的EGCG,发现VEGF和PCNA随着给药浓度越高,表达越低。并且NC组与EGCG中、高剂量组相比差异有显著性(P<0.05)。PCNA的表达EGCG各组均高于NC组,差异有著性(P<0.05)。见Tab 3。

Tab 3 Expressions of VEGF and PCNA mRNA in xenografts of nude n=3)
2.4 EGCG作用于裸鼠移植瘤后VEGF及PCNA的蛋白表达变化如Fig 2蛋白印迹结果显示,与NC组相比,EGCG组移植瘤组织中VEGF和PCNA蛋白表达明显下降,随着给药组浓度增加,差异越明显,高剂量组与阴性组相比差异有显著性(P<0.01)。见Tab 4。
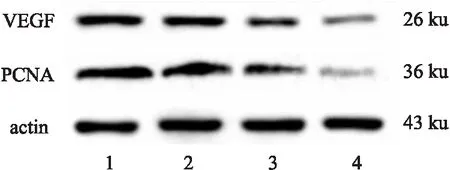
Fig 2 Effect of EGCG on VEGF and PCNA of ovarian cancer SKOV3 cell xenograft tumor 1-4 NC,EGCG(10, 30, 50 mg·kg-1)
Tab 4 Protein expressions of VEGF and PCNA in tumor xenografts of nude mice n=3)
2.5 EGCG对裸鼠体重和肝脏的影响给药期间,裸鼠体重无明显下降,表明裸鼠对EGCG耐受良好,见Fig 3。肝切片显示阴性对照组肝组织完整,肝细胞以中央静脉为中心向周围放射状排列,细胞核染色深而大,细胞间无明显间隙,细胞质成分区分明显。与阴性对照组相比,EGCG高剂量组裸鼠肝组织无明显变化,而紫杉醇组肝细胞之前间隙明显,细胞核固缩。见Fig 4。
3 讨论
卵巢癌作为女性常见的生殖器官恶性肿瘤之一,发病率与死亡率较高[7]。近十年来,卵巢癌的治疗方法和药物不断发展,但总体发展缓慢,卵巢癌的死亡率仍在增加,所以探索新的治疗药物对于治疗卵巢癌至关重要。本研究通过建立卵巢癌SKOV3细胞裸鼠移植瘤模型,在体内水平来探讨EGCG对卵巢癌生长的抑制作用。移植瘤体积大小和抑瘤率可以直观的反映药物的抑瘤效果,本研究结果表明,裸鼠对EGCG的耐受良好,同时EGCG对裸鼠的肝脏无明显毒性。紫杉醇是从短叶红豆杉树皮中提取出的紫杉烷类抗癌药物,对卵巢癌抑制作用较为明显[8],铂类联合紫杉醇化疗是治疗卵巢癌的一线化疗方案;我们的研究结果显示,EGCG高剂量组(50 mg·kg-1)对卵巢癌移植瘤生长抑制作用优于紫杉醇(5 mg·kg-1),且其对裸鼠肝脏的影响比紫杉醇小,揭示EGCG可能是卵巢癌治疗的潜在药物。

Fig 3 Effect of EGCG on weight of ovarian cancer SKOV3 cell xenograft tumor

Fig 4 HE staining of nude mouse livers (×100)
VEGF是一种重要的血管生成因子,可以促进血管内皮细胞增殖,促进新血管形成;它是目前发现的对血管产生影响最大的内皮生长因子,能增加肿瘤血管生长,加快肿瘤生长发展[9]。有文献报道,VEGF在结肠癌、肝癌、肺腺癌等肿瘤的发生发展中都发挥了重要作用[10-12];VEGF在卵巢恶性病变晚期水平升高, 抑制其表达水平能抑制卵巢肿瘤的恶性发展。本研究发现,随着EGCG剂量增加,移植瘤组织中VEGF表达逐渐减少。此外,我们还发现EGCG也能抑制卵巢癌移植瘤组织中PCNA的表达。PCNA是近年来被用来作为恶性肿瘤发生、发展的重要标志物,在乳腺癌、胃癌、大肠癌、肺癌、卵巢癌等恶性肿瘤均异常表达。并且有研究表明抑制PCNA的表达能抑制卵巢癌的发生发展[13]。因此,EGCG抑制卵巢癌生长可能与其下调VEGF和PCNA的表达有关。
综上所述,EGCG可以明显抑制卵巢癌SKOV3细胞裸鼠移植瘤的生长,其机制可能与VEGF及PCNA的表达下调有关,且EGCG毒副作用小,因此EGCG有望成为治疗卵巢癌高效低毒的候选药物。

