瑞舒伐他汀通过调控UCP2-SIRT3通路减轻脑缺血/再灌注对神经元线粒体的损伤
董雪佳, 江名芳, 包立道
(内蒙古医科大学1. 研究生院,内蒙古 呼和浩特 010058,2. 附属医院神经内科,内蒙古 呼和浩特 010059,3. 基础医学院药理学教研室,内蒙古 呼和浩特 010110)
RS能提高OGD/R细胞的存活率、抑制细胞凋亡、改变细胞形态、稳定细胞线粒体膜电位;增加OGD/R细胞中UCP2、SIRT3分子和TOMM20蛋白表达,并诱导Drp1和Opa1 mRNA的表达,抑制PGC1 mRNA的表达;沉默UCP2后能明显降低OGD/R细胞的存活率及TOMM20蛋白的表达,降低Drp1和 Opa1 mRNA的表达,使PGC1 mRNA的表达增加。结论RS通过调控UCP2-SIRT3通路减轻CIR对神经元线粒体的损伤,发挥神经细胞保护作用。
脑卒中是一种常见的临床疾病,是我国导致死亡和残疾的主要原因,脑缺血性卒中最为常见,其较高的发病率和致残率,给人民生活带来沉重负担[1]。目前认为唯一有效的治疗措施是时间窗内尽快恢复缺血区域脑灌注、挽救缺血半暗带神经元,但缺血区域血流恢复可能诱发进一步组织损伤和神经功能障碍,这被称为脑缺血/再灌注(cerebral ischemia/reperfusion injury,CIR)损伤[2]。这是一个涉及细胞毒性、氧化应激损伤、炎症、凋亡和自噬等多种复杂机制的病理生理过程。众多研究表明[3-4],能量缺乏和氧化应激是导致神经细胞缺血/再灌注损伤的主要因素。线粒体作为细胞能量代谢和氧化应激的调节中心,在其中发挥重要作用,因此抑制能量缺乏和氧化应激介导的线粒体损伤对于改善CIR损伤非常重要。解偶联蛋白2(uncoupling protein 2,UCP2)和去乙酰化酶3(sirtuin-3,SIRT3)作为细胞信号转导的重要调节因子,影响着细胞在应激条件下的适应和存活。近年来[4-6],多项研究证明UCP2-SIRT3信号通路通过能量代谢/氧化应激调控CIR损伤。
瑞舒伐他汀(rosuvastatin,RS)在CIR动物模型中通过减轻炎症损伤[7]、调节血栓形成、改善内皮功能、促进血管生成、减少氧化应激等发挥神经保护作用[8-9],被广泛推荐用于缺血性卒中的一级和二级预防治疗。近年来很多研究表明,他汀类药物除影响血脂之外,还具有抑制小胶质细胞过度激活、降低细胞免疫炎症反应、抑制细胞凋亡坏死、调节线粒体自噬[10]等细胞保护作用,在脑及心肌细胞缺血/再灌注损伤过程中发挥重要作用。Wang等[11]研究证实,RS通过调节UCP2和PPAR-γ表达,保护原代心肌细胞免受OGD/R损伤;Vélez等[12]研究发现,RS能通过负性调节蛋白激酶B-糖原合成酶激酶3β(Akt-GSK-3β)通路,减少线粒体通透性转换孔开放,保护线粒体,减少OGD/R损伤对心脏细胞的损害;由此我们推测,在CIR损伤中RS同样具有保护作用,为进一步证实我们的推测,并研究RS在CIR损伤中发挥保护作用的机制,进而开展了本实验的研究。通过观察RS对CIR神经元线粒体损伤的影响,探讨他汀类药物神经保护作用及其可能机制,为减轻CIR损伤寻找更多途径,为缺血性脑卒中临床治疗提供新的实验依据。
1 材料和方法
1.1 实验材料和主要试剂
1.1.1实验材料 人神经母细胞瘤细胞(SH-SY5Y细胞)(AC217)购自于上海泽叶生物科技有限公司。
1.1.2试剂 DMEM培养基(AE2942349)购自于Hyclone;F12k无糖无血清培养基(DZPYG0041)由博士德生物定制;全反式视黄酸(RA)(R2625)和瑞舒伐他汀(RS)(Y0001719)均购自Sigma公司;胎牛血清(100099141)、双抗(SV30010)、胰酶消化液(T1350-100 mL)购自Gibco公司;山羊血清(SP9001)来自北京中杉金桥生物技术有限公司;UCP2抗体(sc390189)购自美国SANTA;SIRT3抗体(ab40963)和TOMM20抗体(ab56783)均购自Abcam;荧光二抗-抗兔(33106ES60)和荧光二抗-抗鼠(33212ES60)均购自YEASEN;UCP2 siRNA和阴性对照(NC-siRNA)均由上海吉玛合成提供;细胞凋亡检测试剂盒(A005-3)和CCK8检测试剂盒(C008-3)均来自七海复泰生物公司;X-tremeGENE HP DNA Transfection Reagent(X-T)转染试剂(06366236001)购自ROCHE。
1.1.3仪器 超净工作台(浙江苏净);CO2培养箱(Thermo Fisher);三气培养箱(松下);酶标仪(美国BioTek);倒置显微镜(重庆光电);奥林巴斯荧光显微镜;小离心机(1.5 mL)(大龙);小离心机(1.5 mL)(湘仪);水平多用脱色摇床(其林贝尔);超低温冰箱(海尔);超微量分光光度计(美国DeNovix);实时定量PCR仪(英国ITIS)。
1.2 实验方法
1.2.1细胞培养 将SH-SY5Y细胞接种在含有10%胎牛血清和1%双抗的DMEM培养基中,并放置在37 ℃、含5% CO2和饱和湿度的培养箱中培养。每隔1 d对细胞换液1次,每周按照1 ∶3进行传代1次,收集对数期细胞用于后续研究。
1.2.2细胞转染 将UCP2-siRNA(UCP2siRNA673;UCP2siRNA853;UCP2siRNA1235)和阴性对照(NC-siRNA)用 Lipofectamine 2000按照转染试剂3 μL +siRNA 6 μL在SH-SY5Y细胞中进行转染,4 h后更换正常完全培养基,继续培养24 h后,采用real-time PCR和Western blot分别检测UCP2 mRNA和蛋白表达水平,筛选沉默效果最好的UCP2-siRNA用于后续研究。
1.2.3细胞模型建立及分组 将SH-SY5Y细胞用无糖无血清的F12k培养基,在37 ℃、2% O2、5% CO2条件下培养4 h,构建OGD/R细胞模型;根据指定实验要求,分别给予不同处理,常规培养的SH-SY5Y细胞为control组;造模成功后不给予任何药物处理的对照组为OGD/R组;RS(40和2.5 μmol·L-1)分别处理OGD/R细胞24 h,分别标记为OGD/R+RSH组和OGD/R+RSL组。筛选出沉默效果最好的UCP2siRNA后,将NC-siRNA和UCP2siRNA用脂质体法转染OGD/R细胞4 h后,分别予以2.5和40 μmol·L-1RS处理24 h,分别标记为OGD/R+NC组、OGD/R+NC+RSL组、OGD/R+NC+RSH组、OGD/R+UCP2组、OGD/R+UCP2+RSL组和OGD/R+UCP2+RSH组。
1.2.4Real-time PCR检测UCP2、PGC1、Drp1和Opa1的基因表达 按照“2.2细胞转染”处理细胞后,用Trizol裂解液提取总RNA并逆转为cDNA,取cDNA和引物根据反转录试剂盒步骤进行扩增。反应条件为: 95 ℃预变性15 min,然后进行40 个循环(95 ℃变性10 s,55 ℃退火20 s,7 ℃延伸20 s)。引物序列(正向和反向)分别为:UCP2:5′-TAG ACGTGGTCAAGACGAGATA-3′和5′-AGGGCATGAA CCCTTTGTAG-3′;β-actin:5′-GCACTCTTCCAGCCT TCCTT-3′和5′- CGTACAGGTCTTTGCGGATG-3′以β-actin为内参照,采用2-△△CT法对UCP2-siRNA表达进行相对定量分析。按照“2.3细胞分组”处理细胞后,用同样的方法,以GAPDH为内参照定量分析PGC1、Drp1和Opa1的表达,引物序列(正向和反向)分别为:PGC1: 5′-CCAAACCAACAACTTTATC TCTTCC-3′和5′-CACACTTAAGGTGCGTTCAATAGT C-3′;Drp1:5′-CACCCGGAGACCTCTCATTC-3′和5′-CCCCATTCTTCTGCTTCCAC-3′;Opa1:5′-GTGCTGCC CGCCTAGAAA-3′和5′- TGACAGGCACCCGTACTCA GT-3′;GAPDH: 5′-AGAAGGCTGGGGCTCATTTG-3′和5′-AGGGGCCATCCACAGTCTTC-3′。
1.2.5Western blot检测UCP2蛋白的表达 按照“2.2细胞转染”处理细胞后,将取得的细胞离心加入适量体积的裂解液,冰上裂解1~2 h,4 ℃ 1 500 r·min-1离心10 min,收集上清液。根据说明书,采用BCA法蛋白定量,完成后将蛋白在沸水中变性5 min,冷却后待使用,将蛋白样本进行SDS-PAGE凝胶电泳。UCP2蛋白选择NC膜,采用湿转法进行转膜,转膜时间为75 min。5%脱脂奶粉封闭1 h后,与膜一起放入密闭塑料袋中4 ℃孵育过夜。配制二抗与膜一起在室温、摇床上孵育2 h,采用化学发光法将试剂1 ∶1进行混合后滴加在膜上,在蛋白凝胶成像系统下进行显影。
1.2.6CCK8法检测细胞存活率 参照2.3细胞造模及分组,分别将UCP2沉默前实验各组(control组、OGD/R组、OGD/R+RSH组和OGD/R+RSL组)及沉默后实验各组(control组、OGD/R组、OGD/R+RSL组、OGD/R+RSH组、OGD/R+NC组、OGD/R+NC+RSL组、OGD/R+NC+RSH组、OGD/R+UCP2siRNA组、OGD/R+UCP2siRNA+RSL组和OGD/R+UCP2siRNA+RSH组)每孔加入10 μL的CCK8试剂,37 ℃孵育1 h后用酶标仪检测在450 nm处的吸光值。
1.2.7流式细胞仪检测细胞凋亡率 将UCP2沉默前实验各组细胞用400 μL的binding buffer悬浮细胞,分别加入5 μL的Annexin V-Alexa Fluor 488 37 ℃避光孵育15 min后加入10 μL PI 4 ℃避光反应20 min,在1 h内上流式细胞仪检测。
1.2.8高倍镜下观察细胞形态,激光共聚焦法观察UCP2、SIRT3和TOMM20分子表达和定位 分别将UCP2沉默前后实验各组采用共聚焦小皿吸弃培养基,PBS清洗5 min×3次,然后用预冷的4%多聚甲醛固定15 min,再次用PBS清洗5 min×3次,观察细胞形态并拍照。用0.1% Triton-X100(PBS稀释)破膜10 min,PBS清洗5 min×3次,滴加正常山羊血清后室温封闭1 h。吸弃血清后进行一抗和二抗孵育,用DAPI(PBS稀释,稀释比例1 ∶2 000)染色8 min,PBS清洗5 min×3次,最后滴加足量50%甘油后,进行共聚焦荧光拍照,分别观察UCP2沉默前实验各组的UCP2和SIRT3及沉默后实验各组SIRT3和TOMM20分子表达和定位。
1.2.9JC-1法检测细胞线粒体膜电位变化 将UCP2沉默后实验各组吸弃培养基,加入100 μL JC-1染色工作液,充分混匀后置入细胞培养箱37 ℃、5% CO2孵育20 min;在孵育期间,按照每1 mL JC-1染色缓冲液加入4 mL蒸馏水的比例,配制适量的JC-1染色缓冲液,并置于冰浴;孵育结束后,吸弃上清,用JC-1染色缓冲液洗涤2次;加入100 μL细胞培养液,荧光显微镜下观察并拍照。
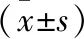
2 结果
2.1 UCP2沉默细胞系的建立如Fig 1所示:与其它组相比,UCP2siRNA-853组的UCP2在mRNA水平的表达降低,差异具有统计学意义(P<0.05);如Fig 2所示,与对照组相比,3组UCP2siRNA组的UCP2蛋白表达均降低,差异具有统计学意义(P<0.05),3组UCP2siRNA组间差异无显著性,但UCP2siRNA-853组的表达最低,即UCP2siRNA-853沉默效果最好。因此,选择UCP2siRNA-853序列用于实验研究。
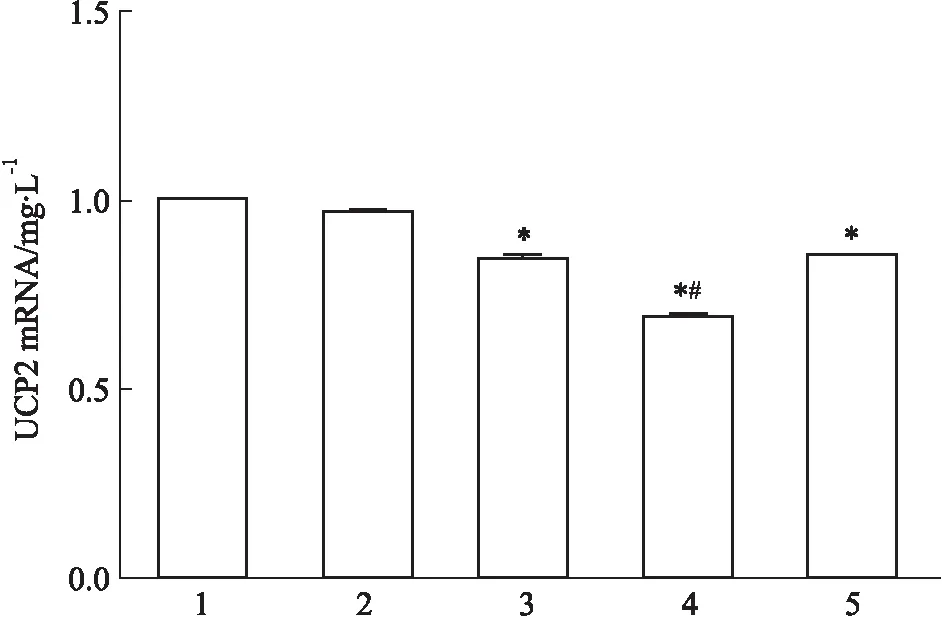
Fig 1 Effect of different UCP2 series on UCP2 mRNA relative expression on SH-SY5Y
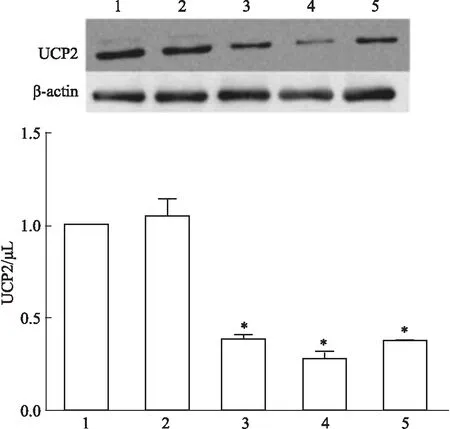
Fig 2 Effect of different UCP2 series on UCP2 protein
2.2 RS对OGD/R细胞的影响
2.2.1RS对OGD/R细胞存活率的影响 如Fig 3所示,与对照组相比,OGD/R组细胞存活率降低,差异具有统计学意义(P<0.05);与OGD/R组相比,RS组细胞存活率升高,且高剂量RS组作用更明显,差异均具有统计学意义(P<0.05);UCP2沉默后,实验组各组细胞存活率较沉默前各组均明显降低,差异有统计学意义(P<0.05)。
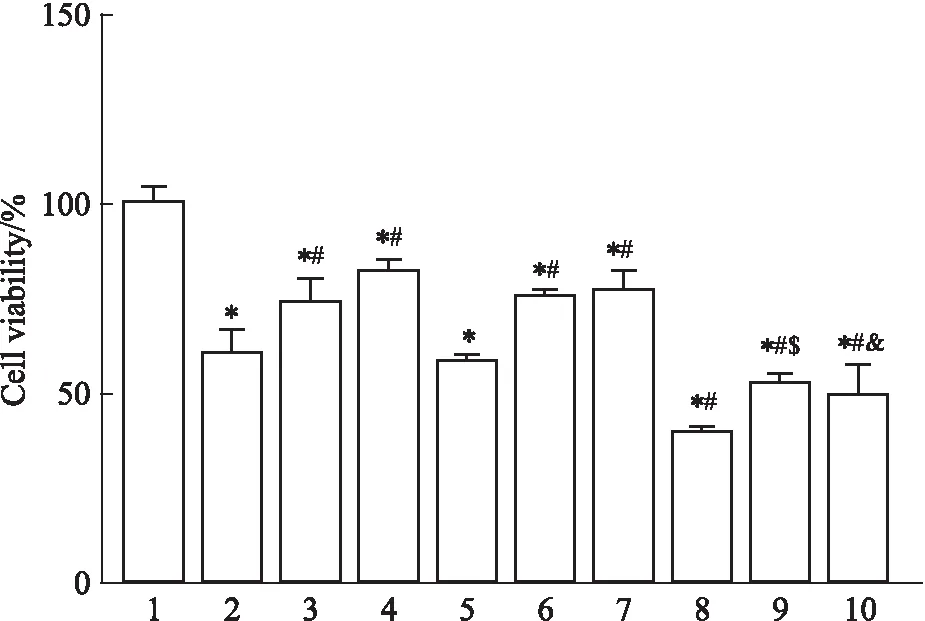
Fig 3 Effect of different concentrations of rosuvastatin on OGD/R cell survival rate after UCP2
2.2.2RS对OGD/R细胞凋亡的影响 细胞凋亡率/ %=早期凋亡率(B4)+晚期凋亡率(B2)。如Fig 4所示,与对照组(8.7%)相比,OGD/R组细胞凋亡率明显升高(33.2%);高剂量RS组细胞凋亡率为11.5%,低剂量RS组为9.6%,二者均明显低于OGD/R组,差异具有统计学意义(P<0.05)。
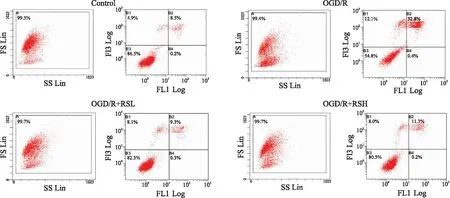
Fig 4 Effect of different concentrations of rosuvastatin on OGD/R cell apoptotic rate
2.2.3RS对OGD/R细胞形态的影响 如Fig 5和Fig 6所示,高倍镜观察发现:RS组细胞突起延伸和分支明显多于OGD/R组。UCP2沉默后,转染组细胞形态较转染前各组无明显变化。
2.2.4RS对OGD/R细胞中UCP2、SIRT3和TOMM20分子表达和定位的影响 UCP2、SIRT3和TOMM20均在细胞质中表达;如Fig 7所示,OGD/R组中UCP2和SIRT3免疫荧光最弱,即表达最低,与OGD/R组相比,RS组两种分子免疫荧光较明显增强,说明RS能够增加OGD/R细胞UCP2和SIRT3表达。Fig 8示:UCP2沉默前,RS组TOMM20表达较对照组水平更高,而UCP2沉默后,各组 TOMM20表达均降低。UCP2沉默前后,各组SIRT3表达无明显差异。
2.2.5RS对OGD/R细胞线粒体膜电位的影响 如Fig 9所示,JC-1在细胞正常情况下以聚集物的形式存在于线粒体基质中而显示红色荧光。当膜电位下降时,这些红色聚集物就会分解成绿色荧光单体。Positive组细胞基本都显示绿色荧光,与control组相比,OGD/R组绿色荧光增强,红色荧光基本消失,提示细胞可能进入早期凋亡;RS组红色荧光明显增强,提示细胞状态较好;UCP2沉默后,RS组红色荧光强度仍然较强,且高剂量组更为明显,说明RS可以明显改善OGD/R细胞状态。
2.2.6RS对OGD/R细胞PGC1、Drp1和Opal表达的影响 如Fig 10所示:与control组相比,OGD/R组细胞中Drp1和Opa1 mRNA表达降低,PGC1mRNA表达增高,差异均具有统计学意义(P<0.05);RS可以促进OGD/R细胞中Drp1和Opa1 mRNA的表达(P<0.05)降低PGC1mRNA的表达(P<0.05);UCP2沉默后,RS组Drp1 mRNA表达降低,但低剂量组除外,差异均具有统计学意义(P<0.05);Opa1 mRNA表达降低(P<0.05);PGC1mRNA表达增高(P<0.05)。
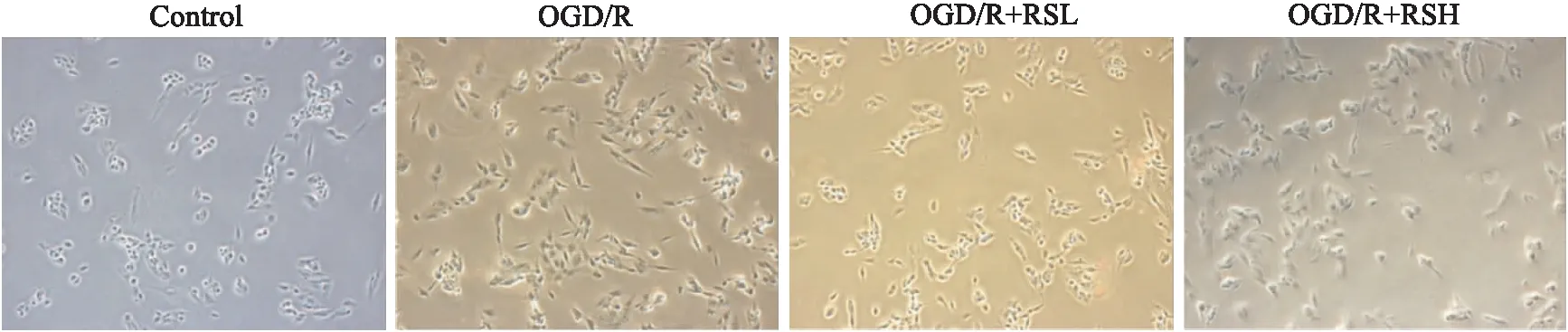
Fig 5 Effects of different concentrations of rosuvastatin on OGD/R cell morphology(200×)

Fig 6 Effects of different concentrations of rosuvastatin on OGD/R cell morphology after UCP2 silence(200×)
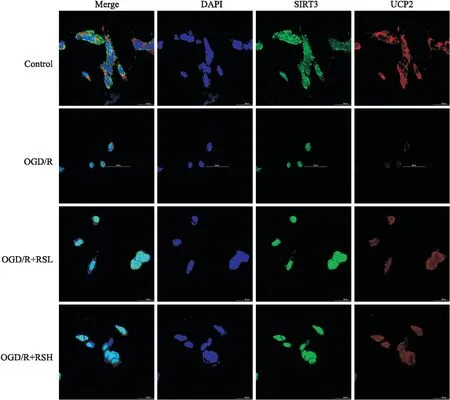
Fig 7 Effects of different concentrations of RS on expression of UCP2 and SIRT3 molecules in OGD/R cells(400×)
3 讨论
CIR损伤作为一种复杂的病理生理过程,各种病理机制间相互作用,共同导致了神经细胞的坏死和凋亡,严重影响着急性缺血性卒中的治疗及预后。近年来,随着对CIR研究不断深入,线粒体功能障碍成为CIR损伤的重要机制之一。其中,能量转换障碍、氧化应激损伤和细胞凋亡作用较大。UCP2和SIRT3作为细胞内重要的能量调节因子,参与线粒体氧化应激反应,在CIR损伤过程中发挥重要作用[13]。研究发现[4,6],UCP2通过调节线粒体呼吸链能量和活性氧的产生,间接影响SIRT 3的活性,SIRT3通过调节下游抗氧化剂PGC 1影响线粒体的生物合成,从而减轻细胞氧化损伤,改善线粒体功能。
RS作为急性缺血性卒中治疗的重要药物,在临床上发挥越来越重要的作用。RS一直因其强化降脂、稳定斑块、改善内皮功能、减少炎症等作用被人们熟知。随着研究的深入,RS的神经保护作用逐渐被发现,其机制可能与调节线粒体发生和抑制细胞调亡等有关[14-15]。目前国内外研究主要集中在核转录因子(NF-κB)介导的信号通路的阻断[16]、过氧化物酶体增殖物激活受体-γ(PPAR-γ)的调节、PI3K-Akt-GSK-3β通路和Notch通路激活等方面,对UCP2-SIRT 3信号通路方面的研究较少。本实验立足于二者之间的相关性设计实验,通过建立UCP2沉默细胞系,研究RS的神经保护作用机制与UCP2-SIRT 3信号通路之间的关系。实验发现,CIR损伤会明显抑制细胞中UCP2和SIRT 3分子的表达,而RS对该抑制作用具有明显拮抗作用,说明RS能增加OGD/R细胞中UCP2和SIRT3分子的表达;同时还发现,RS能够明显提高OGD/R细胞的存活率,抑制OGD/R细胞凋亡,但当UCP2沉默后,各组细胞存活率均明显降低,说明RS通过调节UCP2分子介导CIR神经元细胞的损伤;RS该作用机制在心脏OGD/R模型中得到广泛证实[11,17],本实验首次验证RS在脑OGD/R模型中发挥的保护作用及作用机制,具有重要临床意义。
与我们猜想不同的是,SIRT 3分子的表达在UCP2沉默前后却未发生明显变化,通过阅读文献,我们发现SIRT 3分子并非直接受控于UCP2分子调节,二者之间的相互作用是通过NAD+水平的变化来实现的,UCP2通过感知能量水平来调节SIRT3活性,维持线粒体稳定状态,发挥细胞保护作用,RS作用过程中可能存在其他途径影响细胞能量代谢,从而影响了SIRT3分子表达,我们尚不得而知,RS作用过程中的能量变化机制,需要我们进一步的研究和探索。
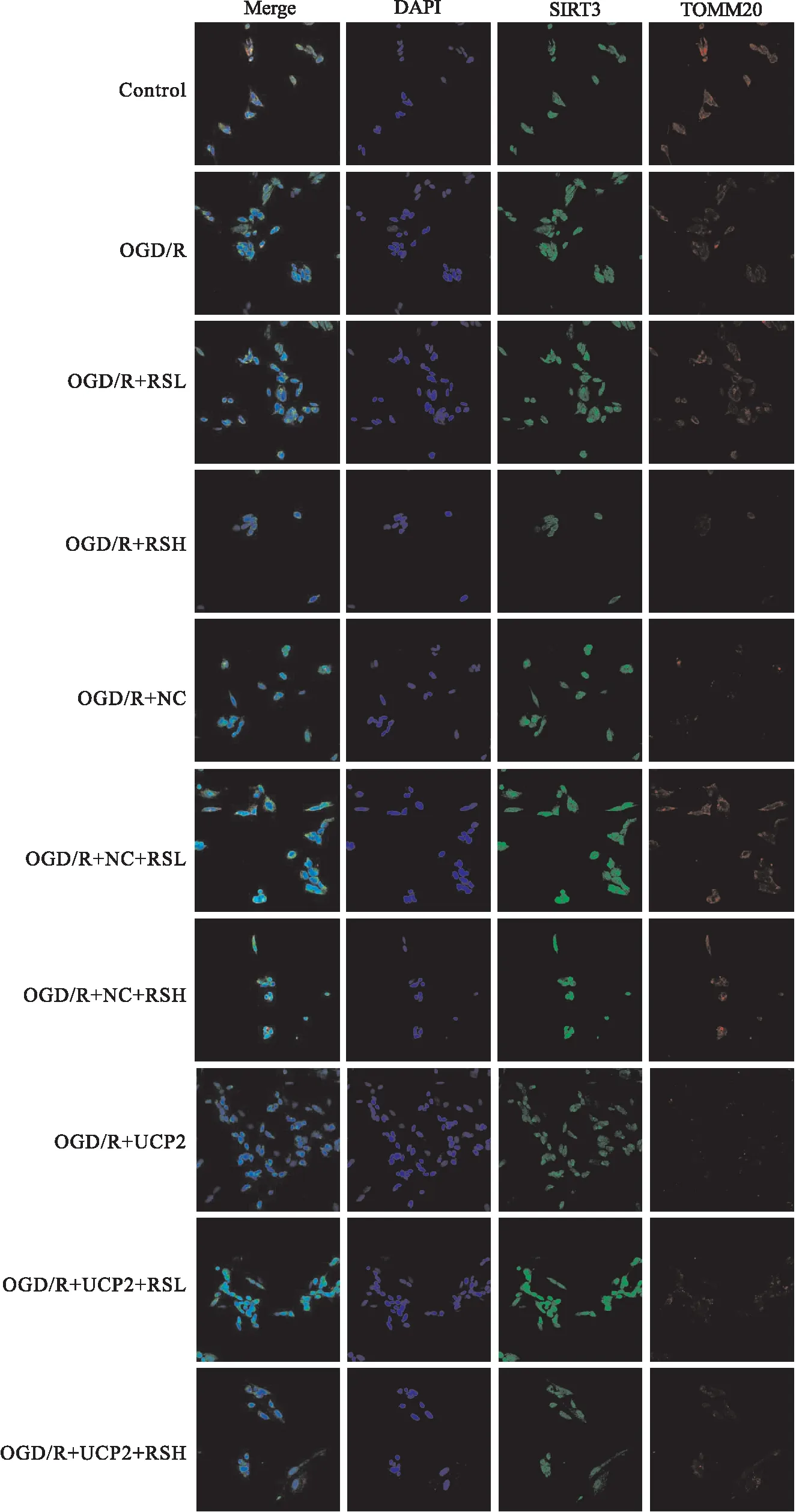
Fig 8 Effects of different concentrations of RS on expression of TOMM20 and SIRT3 molecules in OGD/R cells after UCP2 silencing(400×)
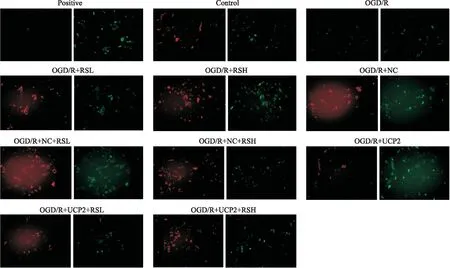
Fig 9 Changes of mitochondrial membrane potential in cells after UCP2 silencing under different concentrations of RS
实验中通过高倍镜下观察细胞形态发现,RS可以明显改变OGD/R细胞形态,促进细胞增殖,这与He等[18]发现的RS能促进原代皮层神经元突起的生长,保护神经细胞免受缺血缺氧损伤的结论相一致;此外RS还可以拮抗OGD/R细胞线粒体膜电位的下降,明显改善OGD/R细胞状态,这种作用在UCP2沉默后仍然存在,说明RS通过影响线粒体膜电位而发挥神经细胞保护作用;实验发现,RS组TOMM20蛋白表达更高,当UCP2沉默后,各组 TOMM20表达都降低,提示RS通过UCP2通路影响线粒体TOMM20蛋白的表达,进而影响线粒体的生物发生。
在线粒体合成相关基因的表达上,实验发现RS可以诱导OGD/R细胞中Drp1和Opa1 mRNA的表达,拮抗OGD/R损伤引起的PGC1 mRNA的表达增加,当UCP2沉默后,RS的类似作用均消失,充分说明RS通过UCP2途径介导线粒体相关基因的表达,发挥细胞保护作用。实验中,在Drp1 mRNA的表达上发现,当UCP2沉默后,低剂量组的RS发挥了明显的促表达作用,这与预想的实验结果相矛盾,不能排除有实验误差存在可能性,通过阅读文献也发现一些类似问题,He等[18]研究发现,用不同浓度RS处理OGD/R损伤细胞,相比于50 μmol·L-1和1 μmol·L-1的RS,5 μmol·L-1的RS对OGD暴露的皮层神经元神经生成有最大的促进作用。这也使我们对实验结果有了新的思考,RS介导的线粒体合成基因的表达可能受到药物浓度和剂量影响,也可能存在其它机制的作用,需要我们进一步的实验和研究。
本实验观察到RS通过UCP2-SIRT3途径提高OGD/R细胞的存活率、增加TOMM20蛋白的表达,影响Drp1、Opal和PGC1 mRNA的表达,从而发挥缺血/再灌注损伤神经细胞的保护作用。目前关于UCP2-SIRT3信号通路在CIR中作用机制尚不完全清楚,对于不同因子之间相互作用,以及与缺血/再灌注时间的关系,还需要进一步研究,同时,对于RS与UCP2-SIRT3信号通路之间具体作用机制及相互影响也将是我们未来研究的方向。RS对线粒体损伤的保护作用被视为其发挥作用的新机制,对于RS发挥神经保护作用的最佳剂量需要我们进一步研究和发现。我们的实验为RS在急性脑梗死治疗中的作用和机制提出了新的方向和思考,也为临床更加规范有效的使用他汀类药物提供更多有价值的依据,具有重要的临床研究和实践意义。
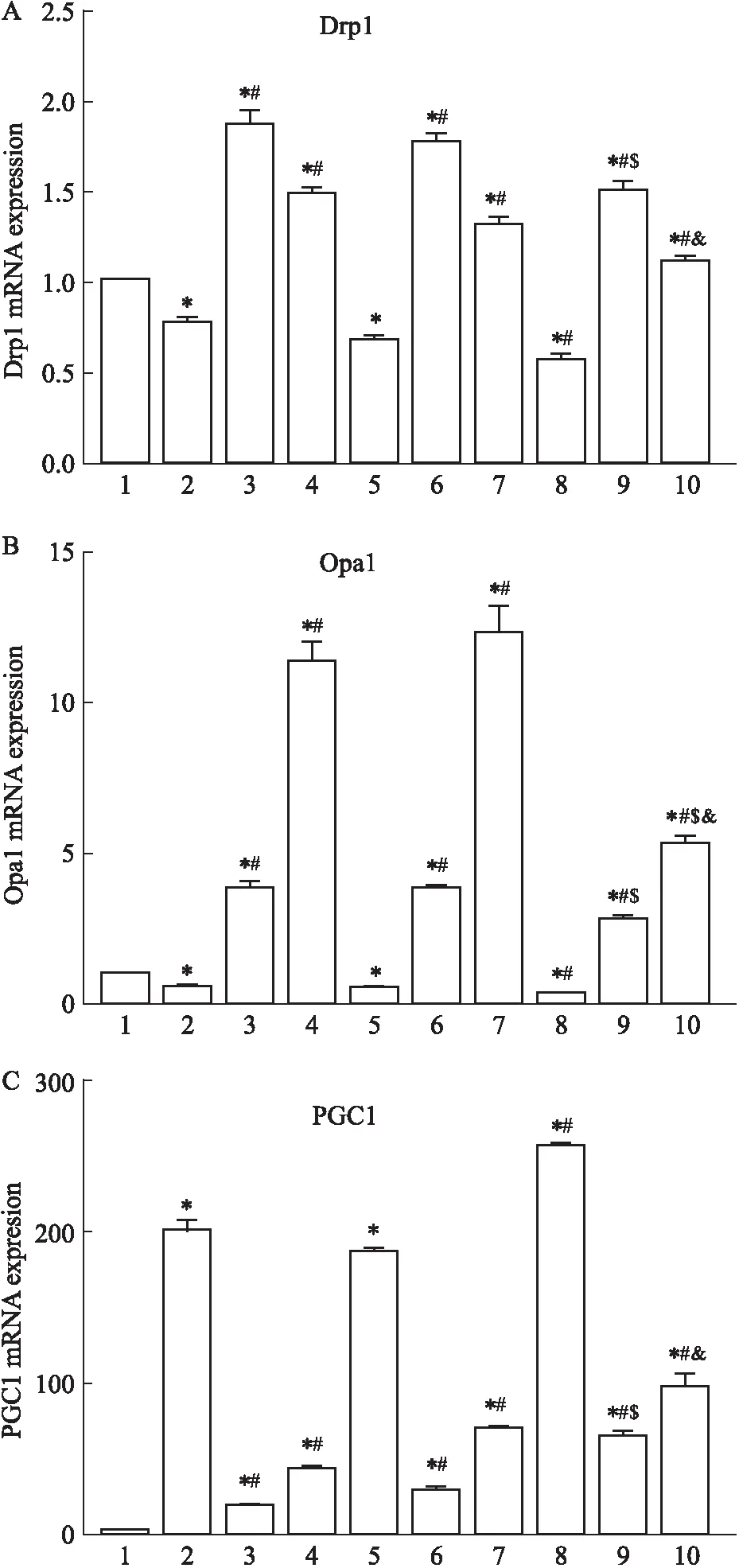
Fig 10 Relative expression of Drp1, Opa1 and PGC1mRNA in cells after UCP2 silencing under different concentrations of

