黑色素聚集激素与抑郁症关系的研究进展
努尔乎玛尔·库尔班,崔素颖,张永鹤
(北京大学基础医学院药理学系,北京 100191)
抑郁症是以显著而持久的心境低落、快感缺失为主要临床特征的一类心境障碍,严重影响患者的生活质量[1]。世界卫生组织最新调研报告显示,在全球范围内,超过3亿人患有抑郁症,相当于世界人口的4.4%[2]。抑郁症是世界各地的首要致残原因,是仅次于心血管疾病造成全球疾病负担的重大因素之一。抑郁症的神经生物学和药理学研究始于20世纪50年代,关于其发病机制有多种假说,如单胺耗竭、突触可塑性、神经发生、神经炎症、能量代谢和谷氨酸假说等[2]。但由于抑郁症临床表现、病因、病程的复杂性,无法用现有的假说机制诠释该病。近年来,随着神经生物学和药理学研究技术的进步,对抑郁症发病机制有了新认识,其中有关黑色素聚集激素(melanin concentrating hormone,MCH)与抑郁症的相关性研究及以MCH系统为靶点的新型抗抑郁药的研发备受关注。
1 黑色素聚集激素概述
MCH是由19个氨基酸构成的高度保守的环形神经肽,其氨基酸序列为Asp-Phe-Asp-Met-Leu-Arg-Cys-Met-Leu-Gly-Arg-Val-Tyr-Arg-Pro-Cys-Trp-Gln-Val。MCH最初在硬骨鱼类中发现,是一种与皮肤色素沉着有关的垂体分泌肽。MCH参与复杂的下丘脑神经网络信号传导,整合内源性和外源性信息,调节多种神经生理功能,如情绪、摄食行为、睡眠-觉醒周期、学习记忆和能量平衡[3]。研究人员通过放射免疫学、免疫组织化学等研究方法,证实大鼠的MCH能神经元主要分布于外侧下丘脑及未定带,并投射至整个中枢神经系统,包括前额叶皮层、海马、蓝斑核、中缝背核和腹外侧视前区等[4-5],见Tab 1。

Tab 1 Projections of MCH-containing neurons of rats
MCH通过作用于两种G蛋白偶联受体MCH-R1和MCH-R2发挥其生物学作用。1999年几个实验室同时鉴定了一种称为SLC-1(GPR24)的孤儿G蛋白偶联受体,后被命名为MCH-R1[6]。MCH-R1在所有哺乳动物中都有表达,在啮齿动物和人类之间的同源性超过90%。MCH-R1广泛分布于整个中枢神经系统,大量表达于下丘脑腹内侧核、海马、杏仁核、伏隔核壳部、中缝背核和蓝斑核等脑区,提示MCH-R1可能参与摄食、情绪、认知、睡眠-觉醒行为的调节[7]。此外,MCH-R1在肠道、淋巴细胞和脂肪细胞等外周组织中也有表达,但在人和大鼠外周组织中检测到的MCH-R1 mRNA水平远低于大脑[6],提示MCH/MCH-R1系统广泛参与中枢神经系统以及外周的生理功能,但是在中枢神经系统可能发挥更为主要的作用。
另一个受体MCH-R2最初是利用电子数据挖掘技术,在人类基因中发现并鉴定的。MCH-R2与Gq蛋白偶联,激活Gq蛋白下游的信号传导通路,兴奋神经元[8]。已在人、狗、雪貂等动物中检测到MCH-R2蛋白,但在啮齿类动物中尚未发现其功能性表达。人类MCH-R1与MCH-R2仅有38%的序列同源性。由于缺乏MCH-R2受体相关的动物模型,MCH-R2的功能尚不清楚,有待于后续研究[9]。
2 黑色素聚集激素与抑郁症
尽管早期关于MCH能神经元投射以及MCH-R1受体分布的研究,提示MCH可能参与情绪调控,但是MCH是否直接参与抑郁症相关的情感障碍一直缺乏证据[3]。而近几年的神经生物学、药理学临床前研究提供了大量的直接证据。这些研究表明,在大、小鼠拮抗MCH-R1或敲除Mchr1基因可能诱导动物产生抗抑郁样效应[10],并且其作用机制可能有别于经典抗抑郁药。尽管许多研究已证实MCH/MCH-R1系统参与抑郁样行为调控,但目前对于这一调控所涉及的神经环路仍知之甚少。近年来,MCH参与抑郁症的作用机制研究主要聚焦在两个方面。(1)MCH通过抑制中缝背核、蓝斑核等脑区的单胺能神经递质功能直接参与抑郁样行为调节;(2)通过调控睡眠-觉醒间接参与抑郁样行为调节(Fig 1)。
2.1 MCH/MCHR1系统直接参与抑郁样行为调节机制由于蓝斑核的去甲肾上腺素能神经元、中缝背核的5-羟色胺能神经元和伏隔核的多巴胺能神经元在抑郁症的神经生物学机制中均发挥重要的作用,因此,多数研究集中在了这些核团中的MCH/MCH-R1系统参与抑郁症的形成及其作为抗抑郁作用靶点或靶系统的机制方面。
2.1.1蓝斑核的MCH能系统与抑郁症 蓝斑核位于脑桥前背部,是合成去甲肾上腺素的主要核团,在应激反应、抑郁样行为调节及快速眼动睡眠(rapid eye movement sleep,REMS)的调控中起重要作用。蓝斑核的去甲肾上腺素能神经元也与抑郁症的调控关系密切。去甲肾上腺素再摄取抑制剂是治疗抑郁症的一线药物之一,可显著增强大脑去甲肾上腺素信号传导。研究表明[11],在大鼠蓝斑核微量注射MCH使前额叶皮层去甲肾上腺素水平显著降低,并且诱导大鼠出现抑郁样行为,如在强迫游泳实验中不动时间显著增加,攀爬或游泳时间减少,在糖水偏好实验中对糖水的偏爱降低;而在蓝斑核内预先注射MCH-R1拮抗剂SNAP-94847可显著逆转MCH诱导的大鼠抑郁样行为[3]。
2.1.2中缝背核的MCH能系统与抑郁症 中缝背核位于中脑导水管腹侧,存在大量的5-羟色胺能神经元,并广泛投射至整个大脑,参与多种生理功能调节,如情绪、焦虑、奖赏与睡眠-觉醒等[12]。临床一线抗抑郁药选择性5-羟色胺再摄取抑制剂(selective serotonin reuptake inhibitor,SSRI)主要是基于增强中枢的5-羟色胺能神经元传导而实现抗抑郁作用。中缝背核的5-羟色胺能神经元接受MCH能抑制性神经纤维投射。研究表明在大鼠中缝背核微量注射MCH,在强迫游泳实验中出现抑郁样行为,如不动时间增加,攀爬或游泳行为减少等。SSRI类药物氟西汀和MCH-R1拮抗剂可有效逆转此抑郁样行为[13-14]。在大鼠中缝背核中微量注射MCH下调中缝背核5-羟色胺水平,这种抑制效应被认为是诱导大鼠出现抑郁样行为的原因[15]。
2.1.3伏隔核的MCH能系统与抑郁症 伏隔核位于基底核与边缘系统交界处。有大量实验证实伏隔核参与动机、快乐、成瘾和奖赏的调控[16]。快感缺失、动机减退和焦虑是人类抑郁状态的主要表现。MCH-R1在伏隔核中也密集表达。有研究表明,侧脑室注射MCH降低伏隔核中多巴胺代谢产物3,4-二羟基苯乙酸(3,4-dihydroxyphenylacetic acid,DOPAC)水平。与野生型小鼠相比,Mchr1基因敲除小鼠中脑边缘多巴胺受体表达上调,伏隔核壳部多巴胺D1和D2受体的表达增加[17]。以上结果提示,MCH对伏隔核多巴胺系统可能有负性调节作用。值得关注的是,在大鼠伏隔核定位注射MCH显著减少大鼠强迫游泳实验中的不动时间,诱导抑郁样行为。而用MCH-R1拮抗剂可有效地逆转该抑郁样行为[18]。这些发现提示,伏隔核中的MCH系统与抑郁症的发展密切相关。
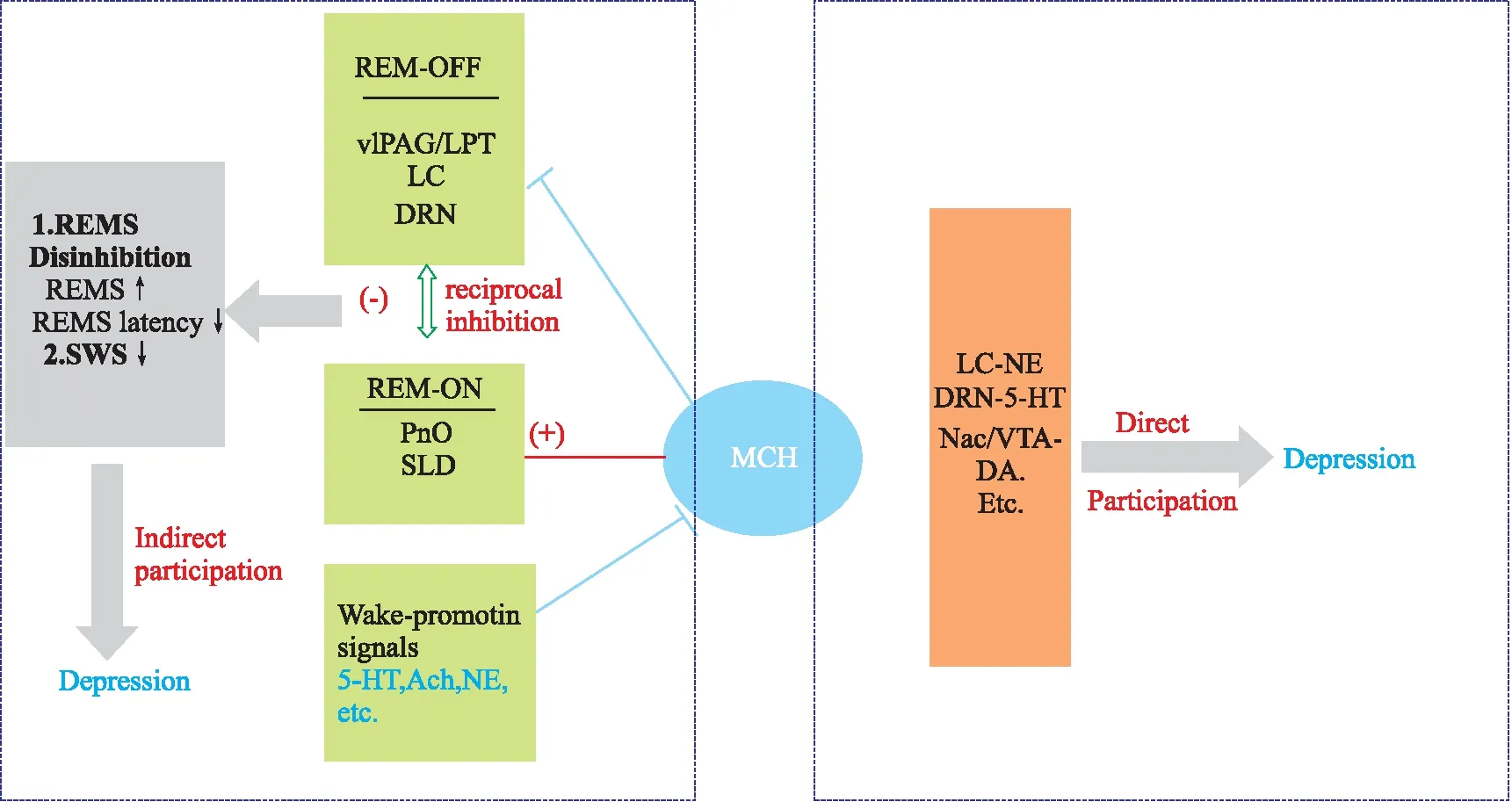
Fig 1 Role of MCH/MCHR1 system in pathophysiology of depression
2.1.4MCH-R1拮抗剂与抑郁症 大量药理学研究表明,在啮齿类动物中急性或慢性予以MCH-R1拮抗剂可直接引起抗抑郁样和抗焦虑样作用。选择性MCH-R1拮抗剂SNAP-7941具有抗抑郁样作用,显著降低强迫游泳中的不动时间,其功效与氟西汀相似。随后,另有几种MCH-R1拮抗剂ATC0065、ATC0175和GW803430均在大鼠强迫游泳实验中表现出抗抑郁样效应[6]。另一种选择性MCH-R1拮抗剂SNAP-94847则被报道能显著逆转慢性应激造成的糖水偏好实验中的快感缺乏现象。这些研究结果提示,MCH-R1拮抗剂在急性及慢性抑郁模型中均有效。除了药理学研究,遗传学研究也进一步说明了MCH能系统与抑郁样行为的联系。研究表明,在慢性应激抑郁症模型中,海马的MCH-R1表达水平显著升高,且这一变化可被SSRI类药物氟西汀逆转[10]。Mchr1基因敲除小鼠与正常小鼠相比,强迫游泳的不动时间显著减少,攀爬行为显著增多,表现出抗抑郁样行为特征[6]。最近一项研究表明,MCH合成前体(prepro-melanin concentrating hormone,ppMCH)高表达以及MCH-R1的低表达可作为抑郁症严重程度的生物标记物,再次强调了MCH能系统在抑郁症病生理学机制中的重要性[19]。
2.2 MCH/MCH-R1系统间接参与抑郁样行为调节机制在21世纪初,MCH引起了睡眠领域的关注,被认为是一种新型“内源性促眠因子”。研究发现[9],在实验动物脑室注射MCH,延长非快速眼动睡眠(non-rapid eye movement sleep,NREMS)时间和REMS时间,并且对REMS的影响尤其显著。在大鼠侧脑室注射MCH,REMS时间增加一倍,同时REMS潜伏期缩短。神经组化研究表明,MCH能神经元的c-Fos蛋白表达在REMS期间增加[20],睡眠剥夺使大鼠MCH能神经元c-Fos表达减少。大鼠REMS剥夺会导致REMS反弹,并伴随MCH神经元过度激活[21]。电生理研究显示MCH能神经元在觉醒期间放电频率最低,在NREMS期间放电频率略有增加而在REMS期间活性达到最高,提示该神经元在REMS期间最为活跃[9]。近年来,得益于光遗传学实验技术的发展,研究人员可选择性操控MCH能神经元的活性,借此MCH能系统与睡眠关系的相关研究取得了重要进展。采用光遗传实验技术,激活大鼠MCH神经元可显著缩短睡眠潜伏期、减少觉醒,并且增加夜间REMS及NREMS,而在白天仅增加了REMS[22]。但在后来的研究中发现了一些不同的结果,激活MCH神经元增加了REMS,但并没有增加NREMS,反而NREMS略有减少[23]。在NREM睡眠期间,激活MCH神经元使进入REMS的频率增加一倍,而在REMS期间激活MCH神经元延长REMS的持续时间。NREMS的减少可能归因于REMS转换的频率增加,从而导致NREM时间缩短[23]。化学遗传学研究表明慢波睡眠(slow wave sleep,SWS)的超正节律与MCH神经元的活性有显著的关系,MCH能神经元被抑制时,SWS平均持续时间显著延长。相反,激活MCH能神经元时SWS时间明显缩短,进一步说明MCH神经元不仅参与REMS的发生和调节,同时也可能参与SWS的终止,从而增加SWS向REMS的过渡,增加REMS[24]。
MCH能神经元向蓝斑核、中缝背核、中脑导水管周围灰质腹外侧区和脑桥外侧被盖区发送密集投射,并且在这些投射部位有大量Mchr1基因表达。这些区域与REMS的调节有关[25]。所有这些投射部位神经元具有共同特征,即在清醒时活跃,进入REMS后,会变得沉默,称为REM-OFF神经元。一般认为,REM-Off神经元在清醒时抑制REM-On神经元的活动,但在REMS发生时停止放电。这些REM-On神经元投射到REM-Off神经元,形成一种REM-on/off回路[26]。考虑到MCH能神经元投射至许多与睡眠-觉醒调节相关的脑区,一系列研究采用在以上脑区定位注射MCH的方法探究MCH参与REMS调节的可能神经环路。5-羟色胺能的中缝背核和去甲肾上腺素能的蓝斑核在REMS的产生和抑郁症的病理生理学机制均起重要作用。在中缝背核和蓝斑核定位注射MCH可诱发REMS[13, 27],而注射MCH-R1拮抗剂或MCH抗体进行免疫中和均可产生相反的作用[3, 14],表明MCH神经元参与了REMS的发生和调节。
睡眠障碍,尤其是REMS行为异常,被认为是抑郁症的核心特征,并与其发病和持续性有关。大量研究表明,睡眠障碍症状并非继发于抑郁症,相反,它往往先于抑郁发作,而在抑郁发作后及缓解期也持续存在。NREMS障碍与REMS失调均与抑郁症严重程度呈正相关[28]。抗抑郁药对抑郁症患者的睡眠结构产生长久影响,总体上有改善抑郁症患者睡眠障碍的趋势,大多数抗抑郁药对REMS均有抑制作用。睡眠完全剥夺或选择性REMS剥夺可以快速改善抑郁症状[29],再次强调REMS与抑郁症的密切相关性。MCH对睡眠-觉醒的影响,如REMS潜伏期缩短、REMS增加、总SWS减少等均与抑郁症患者睡眠特征相对应[30]。目前主流的观点认为抑郁症往往伴随着MCH能神经元的过度激活,这也在一定程度上解释了抑郁症患者REMS过多现象。与之对应的,拮抗MCH能系统则减少REMS,同时逆转抑郁样行为[29]。综上所述,大量的研究已证实,MCH在REMS的启动、维持中起至关重要的作用,REMS的异常伴发于抑郁症。因此,MCH能系统可能通过调控REMS间接参与抑郁症的发生和发展,MCH能系统有望成为治疗和预防抑郁症伴发睡眠障碍的干预靶点。
上述神经生物学和药理学研究为抑郁症的MCH能假说提供了有利的实验室依据,初步探明MCH-R1拮抗剂在抑郁症治疗中的潜在用途,提示MCH-R1可能是治疗抑郁症的新靶点(Tab 2)。今后仍需要采用多种动物模型及分子生物学研究方法,进一步深入阐释MCH能系统与抑郁样行为之间的内在关系。
3 小结与展望
总之,大量临床前研究表明,MCH/MCH-R1系统可能与抑郁症的病因学机制有关,但相关的神经解剖学通路和分子生物学研究相对缺乏,有待进一步研究阐明。尽管如此,迄今为止的研究数据为MCH/MCH-R1系统是否可作为临床治疗抑郁症的新靶点或靶系统,提供了可借鉴的、具有潜在临床应用价值的参考依据。但关于MCH/MCH-R1系统参与抑郁形成机制及其临床抗抑郁疗效尚未得到充分证实。因此,在未来的研究中,将进一步研究MCH/MCH-R1系统参与抑郁形成及其在抗抑郁治疗中的作用机制的同时,还需要把寻找更有效、更安全的MCH/MCH-R1系统抑制剂或MCH-R1拮抗剂作为临床前研究重点。考虑到MCH/MCH-R1系统与抑郁症之间相关机制的独特性,MCH能系统的抑制剂或MCH-R1拮抗剂将有望成为克服现有抗抑郁药不足的新型抗抑郁剂,并为抑郁症的治疗提供一种新的治疗途径和治疗策略。

Tab 2 MCH/MCH-R1 system and its main effects on different brain regions

