一种快速定量检测猴组织中SIV/SHIV 的方法
高 歌孟凤珍姚艳丰∗
(1.中国科学院武汉病毒研究所,武汉国家生物安全实验室,武汉 430071;2.武汉大学基础医学院,武汉大学动物实验中心,武汉 430071)
艾滋病(acquired immune deficiency syndrome,AIDS)是全球三大传染病之一,自发现以来在全球迅速蔓延,对人类的生命健康造成严重威胁。 世界卫生组织(World Health Organization, WHO)2020 年统计的数据显示,全球已有3800 万人感染了艾滋病病毒(human immunodeficiency virus,HIV),2019 年新增170 万病例,AIDS 导致的死亡人数高达 69万[1]。 在众多HIV 相关研究的动物模型中,非人灵长类动物如恒河猴感染SIV 后出现的临床症状和发病机制与人类感染 HIV 相似[2-3]。 因此,SIV 感染非人灵长类动物模型被广泛应用于HIV/AIDS 的研究,并为 WHO 所推荐[4]。 抗 HIV/AIDS 的逆转录治疗的主要靶点是HIV 的逆转录酶。 为了建立逆转录酶抑制剂治疗的动物模型,研究人员将SIV 的逆转录酶基因改造为HIV 的逆转录酶基因,形成基于SIV 骨架,含有HIV 逆转录酶的SIV-HIV 杂交病毒,即SHIV[5]。 SHIV 感染猴主要用于抗逆转录病毒药物耐药性的研究[5]。 近年来,越来越多的研究人员将 SHIV 感染猴模型用于抗 HIV 新药的研究[6-8]。 检测感染猴体内SIV/SHIV 载量的变化是评价和分析疾病发展的重要指标[9-11]。 因此,建立一种快速,敏感和特异的实验方法监测SIV/SHIV载量十分必要。 基于SIV/SHIV 骨架中重要且高度保守的gag基因作为目标检测对象,本研究利用TaqMan 探针技术建立了检测SIV/SHIV 病毒核酸的实时荧光定量法。
1 材料和方法
1.1 实验材料
1.1.1 实验动物
普通级雄性中国恒河猴17 只,体重6 ~8 kg,5岁。 均购于中国科学院昆明动物研究所[SCXK(滇)K2017-0003]。 无菌手术在武汉大学动物实验中心生物安全三级实验室进行[SYXK(鄂)2019-0013]。 这些动物是按照国际实验动物护理评估和认证协会的规定进行护理。 该研究方案和程序经武汉大学医学院动物管理与使用委员会批准(2015024)。 所有的动物组织样本均保存于武汉大学动物实验中心动物生物安全三级实验室。
1.1.2 毒株
R5 SHIVSF162p3n(由美国 Aaron Diamond 艾滋病研究中心Cecilia Cheng-Mayer 博士惠赠);SHIVKU-1、SIVmac239、SIVmac251、HCV JFH-1(由美国 NIH艾滋病研究项目提供);pCMV ayw HBV(由吉林大学吕铭宇博士惠赠);EBV(B95-8 毒株)、HSV-1 17syn+以及HSV-2 G 毒株(由中国科学院武汉病毒研究所胡勤学博士惠赠)。
1.2 主要试剂与仪器
TIANprep Mini Plasmid Kit 购自北京天根生化科技有限公司;E.Z.N.ATMGel Extraction Kit 购自美国 Omega Bio-Tek 公司;pGEM® -T and pGEM® -T Easy Vector Systems 购自美国 PROMEGA 公司;JM109 购自美国 BioVector NTCC 公司;Taq DNA Polymerase 购 自 TaKaRa 公 司; Ficoll-PaqueTMPREMIUM 购自美国 GE Healthcare 公司;Tri Reagent-LS 购自美国 MRC 公司;AllPrep DNA/RNA/miRNA Universal kit (50)购自美国Qiagen 公司; M-MLV RT 5X Buffer、 M-MLV Reverse Transcriptase、 Random Hexame primer、 RiboLock RNase inhibitor 购自美国 Thermo 公司;REGULAR AGAROSEG-10 购自西班牙 Biowest 公司。 Real-Time PCR Bio-Rad MyIQTM2 和 PCR Bio-Rad MyCyclerTMthermal cycler 购自美国 Bio-Rad 公司;NANODROP 2000 spectrophotometer 购自美国Thermo 公司。
引物和探针的设计合成:扩增gag基因的引物和探针是参考文献[12](Forward primer gag: 5’-TGGAGAACAAAGAAGGATGTCAAA-3 ’, Reverse primer gag: 5’-CACCAGATGACGCAGACAGTATTA T-3’;Gag-Probe: FAM-5’-TTGGCACTAATGGAGCT AAGACCGAAAGTATT-3’-BHQ1)由武汉天一辉远生物科技有限公司合成。
1.3 实验方法
1.3.1 RNA 的提取和 cDNA 的合成
按照RNA 提取试剂Tri Reagent-LS 操作步骤从病毒液中提取SHIVSF162p3n病毒的RNA,加入20 μL无 RNA 酶的水溶解,56℃助溶 15 min,然后用NanoDrop 2000 检测 RNA 的浓度。 将得到的 RNA进行逆转录得到cDNA,逆转录反应总体积为20 μL,分别加入 4 μL M-MLV RT 5X Buffer,1 μL dNTPs(5 μmol/L),1 μL Random Hexame primer(5 μmol/L), 0.5 μL RiboLock RNase inhibitor( 1 U), 0.5 μL M-MLV Reverse Transcriptase(10 U),10 μL RNA(1 μg)模板,剩余体积用 Rnase free water 补足到20 μL。 逆转录的反应程序为37℃,60 min;95℃,5 min。
1.3.2 SHIVgag质粒标准品的构建
以1.3.1 中得到的病毒cDNA 为模板,使用gag引物,通过普通PCR 进行扩增。 扩增得到的产物进行DNA 凝胶电泳之后用E.Z.N.ATMGel Extraction Kit 进行纯化和回收,然后利用 pGEM® -T and pGEM® -T Easy Vector Systems 进行片段连接和质粒转染。 利用蓝白斑筛选白色单克隆菌落加入到含有氨苄青霉素的LB 培养液中,在37℃恒温培养振荡仪中180 r/min 培养过夜。 过夜培养得到的菌液用TIANprep Mini Plasmid Kit 提取质粒 DNA,然后测序鉴定。
将测序鉴定正确的质粒DNA 用NanoDrop 2000测定浓度,然后用公式计算出DNA 模板浓度:DNA模板浓度(copies/μL)= [质粒浓度(ng/μL)×10-9×6.02×1023]/[660 g/mol×碱基对数目]。
1.3.3 TaqMan 实时荧光定量PCR 反应体系的建立和优化
以pGEM® -T-SHIVgag质粒作为反应模板,同时设End1/E6E7 细胞DNA 为阴性对照,无RNA 酶水为空白对照。 通过对PCR 反应体系中各种成分(Taq 酶,引物和探针浓度)以及反应程序中的相关条件(退火温度,循环数)进行一系列的优化实验,通过比较检测结果的各相关系数(CT 值,标准曲线的R2等),最终得到该法的最佳检测条件。
1.3.4 检测灵敏度的分析及标准曲线的绘制
取 107~101copies/μL 浓度的 pGEM® -T-SHIVgag质粒标准品作为TaqMan 实时荧光定量PCR 的标准样品进行扩增,每个浓度做3 个平行,同时设End1/E6E7 细胞DNA 阴性对照,无RNA 酶的水空白对照,由定量PCR 仪自动绘制出线性标准曲线。
1.3.5 TaqMan 实时荧光定量PCR 检测方法重复性分析
选择 R2在 0.997 ~ 1.000 之间的 pGEM® -TSHIVgag质粒标准品浓度样本作为检测模板,每个浓度做5 个平行检测样本,通过计算Ct 值的变异系数CV 来评价检测方法的重复性。
1.3.6 TaqMan 实时荧光定量PCR 检测方法特异性分析
除了检测SHIVSF162p3n,SHIVKU-1,SIVmac239,SIVmac251 的cDNA 外,还同时检测了 HCV,EBV,HBV,HSV-1 以及HSV-2 的DNA。 人原代巨噬细胞DNA 为阴性对照,无RNA 酶水作为空白对照。
1.3.7 TaqMan 实时荧光定量 PCR 检测方法的应用
本研究中使用的动物组织样本包括SIV 或SHIV 感染猴和健康猴的血浆(plasma)、外周血单核细胞(peripheral blood mononuclear, PBMC)、淋巴结(lymph node)[13-14]。 血浆为猴静脉全血经过EDTA抗凝处理后所得,PBMC 为猴静脉全血经过Ficoll-PaqueTMPREMIUM 处理分离所得。 淋巴结组织样本为猴安乐死后,直接解剖取材所得。 SIV 感染猴(n= 3)肠系膜 LN,SHIV 感染猴(n= 7)Plasma、PBMC、腋下LN、腹股沟LN、肠系膜LN 和结肠 LN,健康猴(n=7)Plasma、PBMC、腋下 LN、腹股沟 LN、肠系膜 LN 和结肠 LN。 使用 AllPrep DNA/RNA/miRNA Universal kit(美国Qiagen)提取标本的DNA和RNA,RNA 按照1.3.1 的操作步骤获得 cDNA。将cDNA 和DNA 按照1.3.3 中优化好的方法进行检测,同时设人原代巨噬细胞作为阴性对照和无RNA 酶水空白对照。

注:图中阴影部分为引物和探针结合目的片段部位。图1 重组质粒pGEM® -T-SHIV gag 测序鉴定结果Note.The part of primers and probe combined with targeted fragment was indicated.Figure 1 Identification results of recombinant plasmid pGEM® -T-SHIV gag sequencing
2 结果
2.1 质粒标准品的构建
普通PCR 扩增SHIV cDNA 的片段大小为109 bp,克隆到载体中制备质粒标准品,经过氨苄青霉素筛选的阳性单克隆菌株经测序鉴定与GeneBank(AY033146.2)中记录的SHIVgag片段序列一致(图1)。
2.2 TaqMan 实时荧光定量PCR 反应体系的建立
反应结束后,通过Bio-Rad 软件系统分析PCR的结果。 得出最佳反应体系见表1,最佳反应程序为:95℃,10 min;95℃,15 s,60℃,1 min,55 个循环。
2.3 灵敏度及定量标准曲线
将pGEM® -T-SHIVgag质粒标准品进行10 倍倍比稀释,以 107~101copies/μL 稀释度作为 PCR扩增的模板,如图2 所示,SHIVgag质粒标准品在107~102copies/μL 浓度间标准曲线定量线性关系很好。 R2=0.998,slope=-3.304。 因此,我们把该法的检测灵敏度定为102copies/μL。
2.4 TaqMan 实时荧光定量PCR 检测方法重复性分析
以 R2在 0.997~1.000 的 107~102copies/μL 的质粒标准品为模板重复测定5 次,然后计算Ct 值的平均值、标准差s以及变异系数(表2)。 结果表明,该检测方法具有可重复性。
2.5 TaqMan 实时荧光定量PCR 检测方法特异性分析
为了确定该方法的特异性,我们检测了多个SHIV 和SIV 株以及其它无关病毒。 如图3 所示,该法 只 能 扩 增 SHIVSF162p3n、 SHIVKU-1、 SIVmac239、SIVmac251 的 cDNA,而对其它病毒(HCVJFH-1、EBV、HBV、HSV-1 17syn+和 HSV-2 G)无扩增作用。人原代巨噬细胞DNA 阴性对照和无RNA 酶的水空白对照均为阴性。
2.6 TaqMan 实时荧光定量PCR 检测方法的临床应用
TaqMan 实时荧光定量PCR 检测健康猴和感染SIV/SHIV 猴的 Plasma、PBMC、LN,结果见表3。 结果显示,TaqMan 实时荧光定量PCR 检测SIV/SHIV感染猴样本均能检测到SIV/SHIV 的RNA 和前病毒DNA;检测健康猴样本时,所有样本的检测结果都为阴性。
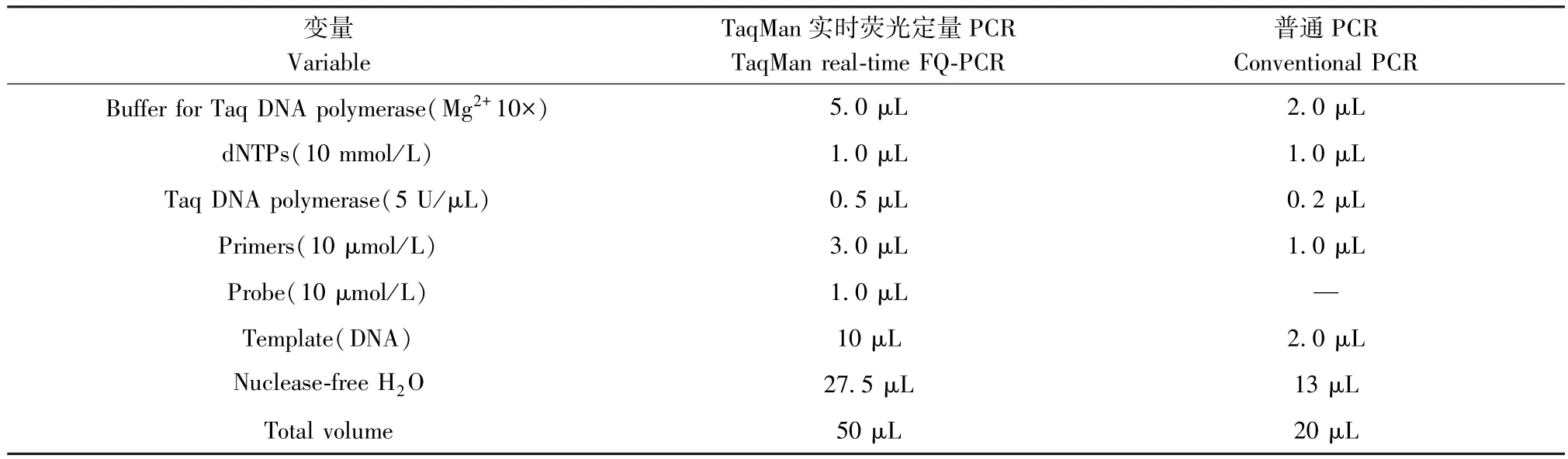
表1 TaqMan 实时荧光定量PCR 的反应体系Table 1 Reaction systems of TaqMan real-time FQ-PCR

表2 TaqMan 实时荧光定量PCR 的重复性实验Table 2 Repeatability evaluation of TaqMan real-time FQ-PCR

注:A:质粒标准品扩增曲线;B:将107-102copies/μL 10 倍倍比稀释的pGEM® -T-SHIV gag 质粒标准品的标准曲线;标准曲线定量线性方程为Y=-3.304x+41.556,R2=0.998, slope=-3.304。图2 pGEM® -T-SHIV gag 质粒标准品标准曲线及扩增曲线Note.A, Fluorescence quantitative amplification plot of 10-fold serial dilutions standard plasmids.B, Standard curve obtained with 10-fold serial dilutions of the pGEM® -T-SHIV gag plasmids from 107-102 copies/μL, the quantitative equation was Y=-3.304x+41.556,R2=0.998, slop=-3.304.Figure 2 TaqMan real-time FQ-PCR quantitative fluorescence amplification plot and standard curve of pGEM® -T-SHIV gag

表3 TaqMan 实时荧光定量PCR 检测猴样本的结果Table 3 Results of samples from monkeys detected by TaqMan real-time FQ-PCR
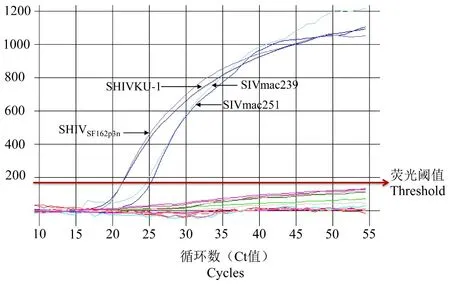
注:SHIV 和 SIV 有特异性扩增,HCV JFH-1、EBV、HBV、HSV-1 17syn+以及HSV-2 G Strain 以及人原代巨噬细胞、无RNA 酶水扩增结果都为阴性。图3 TaqMan 实时荧光定量PCR 检测方法特异性分析Note.To analyze the specificity of TaqMan real-time FQ-PCR for detecting SHIV or SIV gagmRNA.Except for the strains of SHIV and SIV, the method could not amplify cDNA or DNA of other viruses.Figure 3 Specific amplification tests of TaqMan real-time FQ-PCR
3 讨论
SIV 感染猕猴是目前研究HIV/AIDS 的最佳动物模型[15]。 为了获得更接近HIV 感染人类的猴动物模型,研究人员构建了由HIV 和SIV 嵌合的病毒,被称为SHIV 病毒,SHIV 能有效地感染猕猴[16],已被广泛地用于 HIV/AIDS 的研究工作。 由于SHIV 的遗传基因包括了HIV 的逆转录酶基因序列,SHIV 感染的非人灵长类动物模型成为评估抗HIV 药物和疫苗的重要工具[5]。 SHIV 感染后期,由于病毒繁殖受到免疫抑制,血中病毒量下降。 但仍有部分病毒以前病毒(provirus)DNA 或RNA 分子形式潜伏在感染细胞中[17-18]。 在SHIV 感染的潜伏期和平台期,血浆病毒载量降低或消失的情况下,前病毒DNA 载量更能反映感染的状态,与疾病的发展密切相关。
在本研究中我们发现TaqMan 实时荧光定量PCR 能够检测出 SHIV/SIV,而对其它几种病毒(HCV JFH-1、EBV、HBV、HSV-1 17syn+和HSV-2 G)的扩增结果都为阴性(图3),说明该方法检测SHIV/SIV 具有高特异性。 此外,为了能够定量检测病毒,我们还构建了pGEM® -T-SHIVgag质粒标准品,图2 的结果显示,构建的质粒标准品 R2在0.997-1.000 之间,说明该标准品所绘制的标准曲线线性关系良好。 由表2 中所显示的各个浓度梯度的标准品经过5 次独立重复实验扩增得到的CT 值的变异系数在0.6%~1.1%之间,说明该方法具有较好的可重复性。 为了进一步评价该方法的特异性和灵敏度,我们使用该方法检测了SHIV 和SIV感染恒河猴的血浆,外周血单核细胞以及淋巴结中病毒RNA 以及前病毒DNA 的水平。 如图4 所示,所有SIV 或SHIV 感染猴样本的结果都为阳性,而健康猴样本的结果均为阴性,说明该方法能够特异性检测出SHIV/SIV 感染猴不同组织中的病毒RNA以及前病毒DNA。
传统的荧光定量PCR 检测方法是利用荧光染料与双链DNA 结合之后发出荧光信号,通过检测该荧光信号进行定量检测。 而本研究采用的TaqMan探针实时荧光定量PCR 检测的是积累荧光,由于增加了探针的识别步骤,PCR 检测的特异性比传统的荧光定量 PCR 更高[19]。 虽然已有研究运用TaqMan 探针的方法检测猴艾滋病毒[20],但本研究构建的检测方法灵敏度更高,并同时检测了SHIV和SIV 不同毒株的病毒核酸,在特异性评价实验中同时检测了多种RNA 病毒和DNA 病毒核酸,且在实际应用评价中检测了多种猴组织样本(血浆,PBMC 以及淋巴结)中的病毒RNA 和前病毒DNA。
本研究构建的TaqMan 实时荧光定量PCR 检测法的灵敏度为102copies/μL(图2)。 如果样本的病毒量少于102copies/μL,需重复检测避免漏诊,必要时还应动态地检测动物血浆病毒载量的变化。 本法的特异性高,除了能特异性地诊断是否有SIV/SHIV 感染外,还能定量检测SIV/SHIV 的RNA 和前病毒DNA 的水平。 因此,该法具有特异、敏感和快速的优点,适用于 SIV/SHIV 感染猴模型的动物研究。
——一道江苏高考题的奥秘解读和拓展

