Lactacystin对卵巢癌SKOV3细胞作用及机制的研究
秦 瑞,田秀娟,曹 璐
(吉林大学中日联谊医院 妇产科,吉林 长春130033)
卵巢癌是女性生殖系统中最常见的恶性肿瘤,病情进展快,早期诊断较为困难,复发率高,死亡率高,卵巢癌通常发生于绝经期妇女中。卵巢癌的发病率仅次于宫颈癌和子宫内膜癌,在女性癌症中排名第三。大约60%-70%的卵巢癌患者在诊断时已经进入Ⅲ-Ⅳ期或发生腹部转移。卵巢癌通常是在早期和无症状在后期患者将有腹胀,腹部肿块,胃肠道症状和相关的肿瘤浸润或压迫症状。尽管手术,放疗,化疗等治疗方法得到了持续改善,但生存率仍在30%左右,后期效果较差。卵巢癌如果在早期得到及时的诊断,手术治疗作为早期卵巢癌的一种主要的治疗方法,可以取得较好的临床效果,但对于很多复发的患者以及晚期的患者尚不能取得很好的效果,故化学药物治疗尤为重要。然而,传统的化疗药物是日益严重的耐药性的限制和缺乏选择性,因为它是不可能满足的良好的治疗效果的需求,克服了传统化疗的各种缺点的影响它已成为越来越重要的是找到一种替代药物。这种替代药物成为目前实验室研究卵巢癌及临床治疗卵巢癌的新靶点、新方向[1-3]。
1 材料与方法
1.1 主要实验试剂及仪器人卵巢浆液性囊腺癌乳头状(SKOV3)细胞系和蛋白酶体抑制剂乳胞素通过吉林大学白求恩医学药理研究所提供,总RNA提取试剂盒及Taq酶预混液购自Promega公司,cDNA一链合成试剂盒、RT-PCR试剂盒、PVDF膜购自Roche公司,引物合成及测序由上海生工生物工程技术服务公司完成,其它化学试剂均为常规分析纯产品。全自动显微镜数码及光学摄像系统和相差显微镜均购自日本 OLYMPUS公司,流式细胞仪购自美国B.D公司,PCR热循环仪、电泳仪购自日本Takara公司。
1.2 MTT冻存SKOV3细胞复苏后,传代培养,取处于对数生长期细胞,接种上5×104/ml的密度的细胞于96个孔培养板中。培养24 h后,加入0,2.5,5.0,10.0 μmol/ L LAC并继续培养48 h。添加20 μl的MTT到每个孔中作用时间为4 h,除去上清液,加入150 μl DMSO[4]到每个孔中,测定吸光度490 nm处的吸收(A),计算每个组中细胞增殖抑制率,细胞增殖抑制率=(1-实验组值/ A值对照组)×100[4],每组重复6孔,实验重复3次[2]。
1.3 FCM经上述分组及处理后,各组用均胰酶消化处理,制成细胞悬液(浓度为1×106个/ml),吸取1 ml,离心10 min,温度为4℃,转速为1 000转/min,弃上清;加入1 ml已预冷PBS,震荡,使细胞悬浮充分混匀,再次离心10 min,温度为4℃,转速为1000转/min,弃去上清(此两步骤重复两次),将细胞重悬于500 μl的Binding Buffer溶液中,加入 PI染色液5 μl,震荡,充分混匀,在避光室温下反应15 min[5]。使用流式细胞仪检测各组细胞凋亡情况,重复3次,取其平均值[5]。
1.4 Western blot提取总蛋白,测定蛋白浓度,将所得样品的蛋白浓度稀释到1 μg/μl后,SDS-PAGE电泳、转膜、封闭,封闭1 h后,孵一抗、二抗,显色,显色结束后,应对各个显色胶片拍照,用软件分析各组条带的灰度值,根据各组显像的差异,分析每组细胞内Bcl-2及 Bax蛋白表达水平。
1.5 RT-PCR提取细胞总RNA,逆转录合成cDNA,向PCR仪分别加入12.5 μl Takara Taq酶、1 μl模板cDNA、1 μl引物、10.5 μl双蒸水。扩增条件:变性2 min,94 ℃;复性30 s,内参照GAPDH基因扩增引物(扩增片断长617 bp,退火温度57℃),Bcl-2基因扩增引物(扩增片断长723 bp,退火温度64℃),Bax基因扩增引物(扩增片断长468 bp,退火温度58℃),延伸30 s,72℃下,供需约10 min,进行30个循环[3]。各组反应后的PCR反应液进行琼脂糖凝胶电泳,并使用凝胶成像系统AlphaimagerTM 2200,以确认每个组PCR反应产物的含量,拍照并保存,分析电泳带的光密度值,利用靶基因GAPDH作为内部参考图像计算Bcl-2和Bax在不同组的含量,重复每次实验3次,取平均值。

2 结果
2.1 MTT检测结果显示SKOV3细胞的增殖可被LAC有效的抑制,LAC作用浓度升高可明显提高对于SKOV3细胞的增殖的抑制,LAC 2.5 μmol/L 组细胞存活率为(42.5±0.09%),5.0 μmol/L组细胞存活率为(29.2±0.12%),而10.0 μmol/L细胞存活率下降至(18.9±0.13%),与对照组相比,差异有统计学意义,P<0.05。
2.2 流式细胞仪检测结果显示在相同作用时间条件下,LAC可促进SKOV3细胞的凋亡,LAC 2.5 μmol/L组卵巢癌SKOV3细胞凋亡率为(34.5±0.09%),且LAC作用浓度升高可明显提高SKOV3细胞的凋亡率,当LAC 为5.0 μmol/L时,SKOV3细胞凋亡率增加至(52.2±0.10%),LAC为 10.0 μmol/L时,SKOV3 细胞凋亡率达到(68.9±0.11%),与对照组相比,P<0.05。
2.3 不同浓度LAC作用于 SKOV3细胞后Bcl-2、Bax蛋白表达情况分别用浓度为2.5 μmol/L、5.0 μmol/L、10.0 μmol/L的LAC处理SKOV3细胞,Western Blot分析结果,Bax蛋白在卵巢癌SKOV3细胞内的表达水平随LAC作用浓度的升高而逐渐增强,而Bcl-2蛋白的表达水平逐渐减弱,与对照组相比,差异有统计学意义(P<0.05)。 如图1所示。
2.4 不同浓度 LAC作用于SKOV3细胞后Bax、Bcl-2 mRNA表达情况分别用浓度为2.5 μmol/L、5.0 μmol/L、10.0 μmol/L的LAC处理SKOV3细胞,RT-PCR结果显示,Bax mRNA在卵巢癌SKOV3细胞内的表达水平随着LAC浓度的升高而逐渐增强,而Bcl-2 mRNA的表达水平呈递减趋势,与对照组相比,差异有统计学意义(P<0.05)。如图2所示。
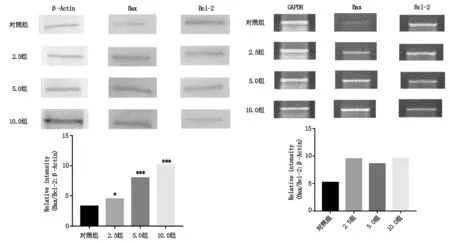
图1 不同浓度LAC组Bcl-2及Bax蛋白表达水平(μmol/L) 图2 不同浓度LAC组Bcl-2及Bax mRNA表达水平(μmol/L)
3 讨论
卵巢癌是女性生殖系统恶性肿瘤中的三种严重癌症之一。当前,外科治疗,化学疗法,放射疗法,生物靶向疗法和其他技术已经得到改善。因此,早期诊断和治疗非常重要。近年来,国内外许多学者探索了通过多种方法早期诊断卵巢癌的方法和指标。
近年来,人们逐渐向细胞水平和分子领域进行探索,分子靶向治疗、基因治疗等已经成为治疗恶性肿瘤的新方向,而Lactacystin作为一种新兴的分子靶向治疗的药物,作为蛋白酶体抑制剂的一种,作为泛素-蛋白酶体通路的抑制剂,是肿瘤治疗中最有前景的研究点[3,6]。在所有真核细胞中大多数蛋白质,包括人遍在蛋白的降解-通过蛋白酶体途径进行的,许多细胞增殖,分化的生长,凋亡与该途径[7]相关联。研究表明Lactacystin能够抑制癌细胞增殖,其抗肿瘤活性取决于对UPS的抑制,UPS可控制细胞蛋白质的更新。同时Lactacystin也可以阻滞一些肿瘤细胞的细胞周期进程。近期的临床研究表明,Lactacystin可有效治疗血液恶性肿瘤。细胞培养和动物模型的临床前研究也已经确定了蛋白酶体抑制剂对包括黑素瘤在内的许多类型癌细胞的抗肿瘤潜力[8-13]。本实验首先体外培养卵巢癌SKOV3细胞,检测了不同浓度LAC对卵巢癌SKOV3细胞增殖抑制率及凋亡率的影响[4],结果表明:SKOV3细胞的增殖可被LAC有效的抑制,LAC作用浓度升高可明显提高对于SKOV3细胞的增殖的抑制,且LAC作用浓度升高可明显提高SKOV3细胞的凋亡率,其机制与上调Bax表达、下调Bcl-2表达有关,Bax及Bcl-2是参与细胞周期调控的、与肿瘤细胞凋亡密切相关的重要蛋白[14],因此,我们推测,LAC抑制SKOV3细胞增殖,并诱导其凋亡的主要机制可能是通过引起Bax、bcl-2等细胞凋亡相关基因及蛋白的表达失衡而抑制泛素-蛋白酶体通路的活性有关。蛋白的抑制剂可阻断泛素-蛋白酶体通道,选择性地杀死肿瘤细胞,有效地防止肿瘤细胞的增殖和诱导肿瘤细胞[15],增加其它化疗药物因敏感性的细胞凋亡和逆转多药耐药性。作为治疗恶性肿瘤的一种新的有效方法[3,16]。

