微小RNA628-5p/Tyrobp对阿尔兹海默病潜在的诊断和治疗价值
张 瑜,吕周艳,李艳冰,王蕾蕾
(吉林大学第一医院 干部病房,吉林 长春130021)
阿尔茨海默病(AD) 是一种严重的神经退行性疾病,并伴有进行性认知功能下降,其发病机制复杂,已经成为了一个全球性的公共健康问题[1]。目前淀粉样蛋白假说是被广泛接受的AD发病机制之一[2],β-淀粉样肽(Aβ)在人脑细胞中的持续积累是AD的核心病理改变。许多抑制Aβ的产生和促进Aβ分解的药物被相继开发出来,然而随着这些靶向药物在三期临床试验中的失败[3],寻找AD新的分子机制变得非常必要,这将有利于对AD的诊断以及新的靶点药物的研发。
1 资料与方法
1.1 AD小鼠核心发病基因分析
搜集GEO数据库获取6例APP/PS1小鼠以及6例正常小鼠海马组织进行RNA测序(GSE113141)。将全部差异表达基因应用DAVID软件进行基因名称转换。然后行蛋白互作网络分析,cytoHubba在线分析,按照评分筛选出分值最高的基因行miRNA预测,将预测的miRNA和GSE138382进行Venn分析,最终筛选出共同表达的miRNA,从而锁定AD的核心发病基因。
1.2 核心基因表达量的验证
天恩泽试剂盒提取3例APP/PS1转基因小鼠和3例正常小鼠海马组织的RNA,应用BaiTeke试剂盒进行RNA的逆转录以及实时定量聚合酶链反应(qRT-PCR),验证核心基因在转基因小鼠以及正常小鼠海马组织中的表达量。其中逆转录过程RNA总量设定为1 000 ng。
1.3 核心基因蛋白电泳
对3例APP/PS1小鼠以及3例正常小鼠海马组织应用碧云天试剂盒提取蛋白质,BCA浓度测定后,按照4∶1的比例加入上样缓冲液,在100℃下煮沸4 min。随后蛋白电泳,应用索莱宝试剂盒配置浓缩胶和分离胶,80伏以及120 V的电压下进行20 min和60 min电泳。对目标蛋白转膜,转膜条件为横流300 A,50 min。5%脱脂牛奶孵育2 h后,一抗蛋白抗体孵育14 h,洗膜,二抗蛋白抗体孵育50 min,洗膜后蛋白显影。
1.4 统计学方法
全部数据应用SPSS20.0进行分析,数据以均数±标准差的形式表示,两组间数据比较采用t检验。以P<0.05 为差异有统计学意义。基因差异表达倍数计算采用2-ΔΔCt算法。
2 结果
2.1 高通量生物信息分析
利用二代测序技术对全部62976个基因进行检测(图1A)。其中存在大量的过高表达和过低表达的测序结果,均一性较差。通过limma数据包对全部数据进行矫正后,数据均一性较好(图1B)。对矫正后的数据进一步筛选,在实验组和对照组之间总共发现153个差异上调表达的基因和197个差异下调表达的基因。蛋白互作网络及CytoHubba显示Tyrobp可能是AD的核心发病基因。
2.2 miR628-5p/Tyrobp在AD小鼠表达量结果
生物信息网络预测以及GSE138382共表达分析结果显示miR628-5p可能通过直接调控Tyrobp的3’UTR影响AD小鼠的发病过程。小鼠海马组织RNA提取结果显示APP/PS1转基因小鼠和正常小鼠海马组织RNA浓度为266.1±11.3 ng/μl,287.4±9.6 ng/μl。qRT-PCR显示miR628-5p在APP/PS1转基因小鼠海马组织中CT值为6.32±0.45,在正常小鼠海马组织中CT值3.18±0.33,差异倍数为8.815(表1),说明miR628-5p在AD小鼠中呈现差异性低表达,表达阳性率为100%。Tyrobp在APP/PS1转基因小鼠海马组织中CT值为2.73±0.23,在正常小鼠海马组织中CT值4.56±0.43,差异倍数为3.556倍,因此Tyrobp在AD小鼠中呈现差异性高表达。
2.3 Tyrobp在AD小鼠蛋白表达量结果
Tyrobp蛋白在APP/PS1转基因小鼠海马组织中较正常小鼠海马组织中呈现高表达。同时Tyrobp蛋白升高的APP/PS1转基因小鼠海马组织中也高表达Aβ蛋白以及APP蛋白(图2),说明Tyrobp蛋白和AD小鼠海马组织退化程度呈现正相关。
表1 海马组织RNA相关参数
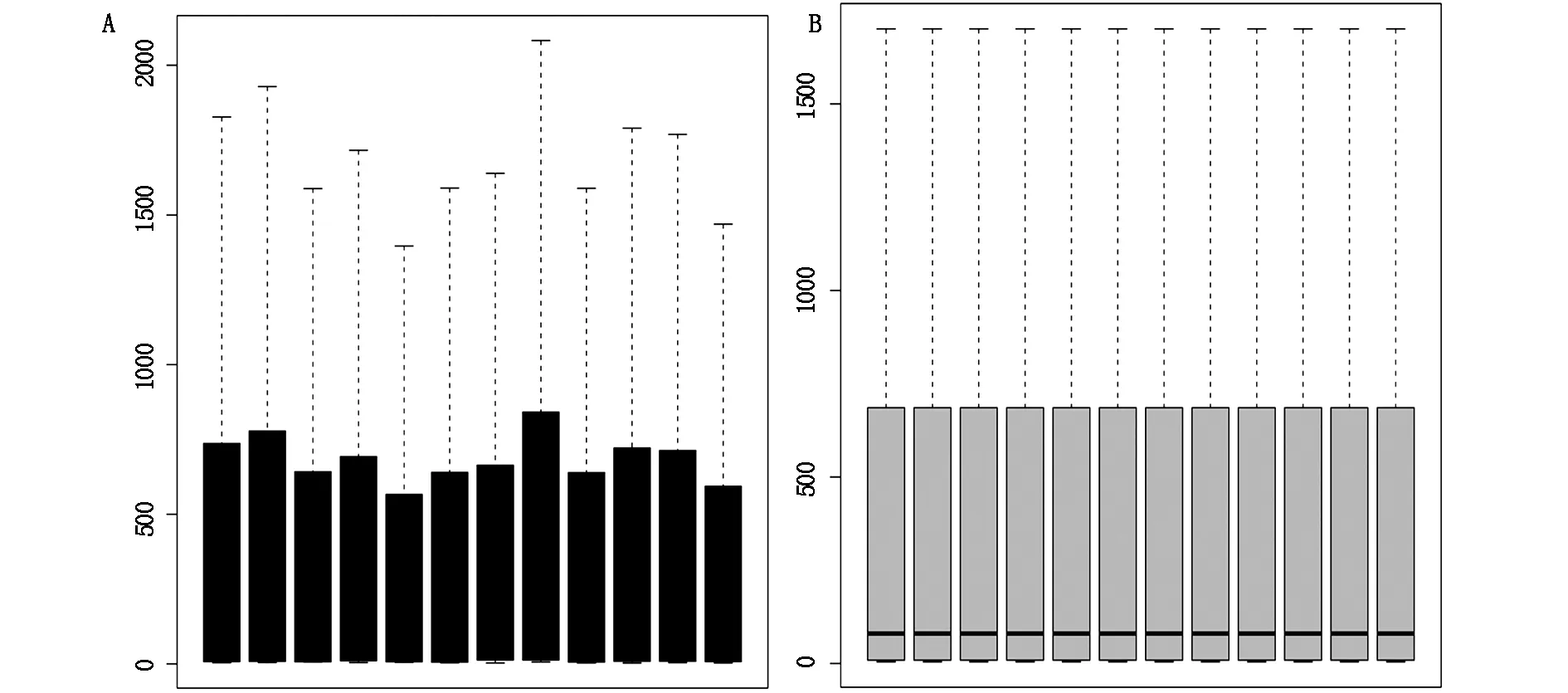
图1 基因芯片原始数据矫正处理
3 讨论
AD是一种进行性认知功能下降的神经退行性疾病。主要的病理特征包括大量老年斑沉积、神经纤维缠结和选择性的特定脑区如大脑皮层和海马神经元及突触的丢失。淀粉样蛋白假说是被广泛接受和认可的发病机制。因此针对Aβ的干预从而治疗AD被给予了巨大的希望[4-6]。但是Aβ的干预似乎未能达到人们预想的效果,故新的AD分子发病机制以及药物靶点需要被重新的研究。微小RNA作为非编码RNA中的一类特殊的基因,其不具备蛋白编码功能,但是可以调控编码基因的转录和翻译,进而参与到疾病的发生和发展中。对RNA表达量的检测以及对应靶点的干预有望成为未来血清学检查标志物以及药物治疗靶点。
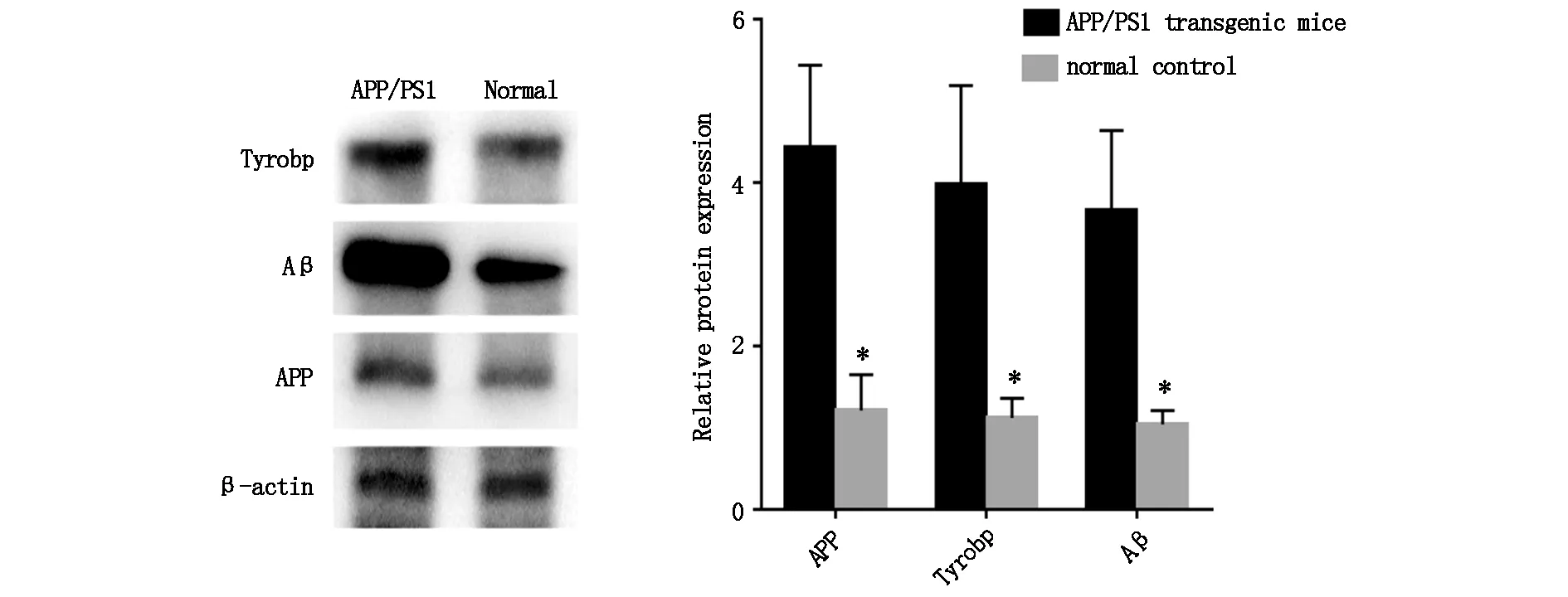
图2 Tyrobp在AD小鼠蛋白表达量
通过对AD的转基因小鼠和正常小鼠海马组织测序结果生物信息学分析,酪氨酸激酶结合蛋白(Tyrobp)可能是AD发病的核心基因。Tyrobp是一种小胶质细胞跨膜标志性多肽,与受体结合后在小胶质细胞表面形成吞噬活性区(吞噬突触)参与免疫反应。Pottier[7]等人在2016年首次报道检测AD患者体内Tyrobp的含量很有可能对早期AD患者具有诊断性作用。随后二代测序的发展以及Tyrobp在动物实验中的开展,不断发现Tyrobp和AD的病理改变密切相关。Tyrobp参与的免疫反应可以介导可溶性Aβ对突触的毒性作用,而AD中免疫反应的过度激活会导致突触过度修剪和突触丢失[8]。但是MA等人认为Tyrobp增高同时能够抑制机体的免疫反应从而抑制小胶质细胞介导的细胞因子的产生和分泌[9]。虽然对于Tyrobp在AD患者发病机制的具体作用尚不清楚,但Tyrobp在AD患者体内升高是大家公认的。本文结果发现在AD小鼠海马组织中Tyrobp较正常小鼠海马组织内高表达3.556倍,说明针对Tyrobp的检测干预很可能成为AD的血清学诊疗标志物。同时Aβ以及APP蛋白与Tyrobp表达趋势一致,说明对Tyrobp 的干预可能成为延缓脑神经元退行性病变的一种手段。而进一步对与Tyrobp有结合位点的miRNA进行分析发现,miR628-5p能够调控Tyrobp的表达参与到AD的发病过程,但目前miR628-5p的报道较少,针对miR628-5p在AD中的作用机制仍需要探索。
综上,本文通过对转基因小鼠海马组织的qRT-PCR验证,证实miR628-5p/Tyrobp可以作为AD的早期诊断血清学标志物。并且miR628-5p和Tyrobp均在小鼠海马组织中呈现差异性表达,其诊断的阳性率几乎为100%。针对miR628-5p/Tyrobp进行靶向治疗及干预有望成为AD治疗的新方法。

