胃肠外科术后切口感染病原菌分布及耐药性分析
孙伯尧,鄢 超,杨雯棋,姜 洋,徐雪松,李 威*
(吉林大学中日联谊医院 1.胃肠外科;2.检验科,吉林 长春130033)
胃肠疾病是临床最常见的疾病,外科手术是胃肠外科患者最常用的治疗手段,随着现代医疗技术的发展,先进的术式也在外科不断的更新,但由于胃肠道的解剖和生理结构,胃肠外科术后感染仍然是临床最常见的并发症之一,而手术创口的感染更是居于各类感染之首[1],严重影响了患者的预后和康复。本研究着重分析了吉林大学第一医院2018年至2019年年间胃肠外科手术后切口感染分离出的143株病原菌分布及其药敏情况,为临床医生对预防感染和进一步干预提供科学依据。
1 材料与方法
1.1 菌株来源收集自2018年1月至2019年12月年间吉林大学第一医院胃肠外科手术患者术后切口感染的创口分泌物,严格按照无菌操作方法采集样本,分离培养出143株病原菌(排除同一患者2次以上相同分离菌株,只统计分析第1株菌)。
1.2 菌株鉴定与药敏试验菌株鉴定使用法国梅里埃公司的VITEK MS飞行质谱仪,药敏采用VITEK-2 Compact全自动微生物药敏分析仪及配套的GP67和GN09药敏卡进行药敏实验。头孢唑林、米诺环素、头孢哌酮/舒巴坦为纸片扩散法(K-B 法)进行补充测试。药敏纸片为Oxoid公司生产,药敏培养基为郑州安图有限公司生产。质控菌株大肠埃希菌ATCC25922、铜绿假单胞菌、ATCC27853金黄色葡萄球菌ATCC29213、粪肠球菌ATCC29212均购于国家卫健委临检中心。
1.3 统计学方法应用微生物WHONET 5.6分析软件统计分析数据。
2 结果
2.1 病原菌种类分布及百分比在术后的创口分泌物中分离到143株病原菌,革兰阴性菌110株,占76.9%,其中以大肠埃希菌和肺炎克雷伯菌为主,分别占52.4%和16.1%;革兰染色阳性菌共32株,占22.4%,其中以金黄色葡萄球菌和肠球菌为主,分别占10.5%和4.9%;念珠菌仅分离出1株,见表1。

表1 创口分离出的143株病原菌分布及百分比
2.2 主要分离出的革兰阴性菌的药敏情况分析分离出的革兰染色阴性菌中以大肠埃希菌和肺炎克雷伯菌为主,肺炎克雷伯菌对各类抗生素均有较高的耐药性,大肠埃希菌对β-内酰胺类抗生素的耐药性略高,未分离出对碳青霉烯类抗生素耐药的菌株,见表2。
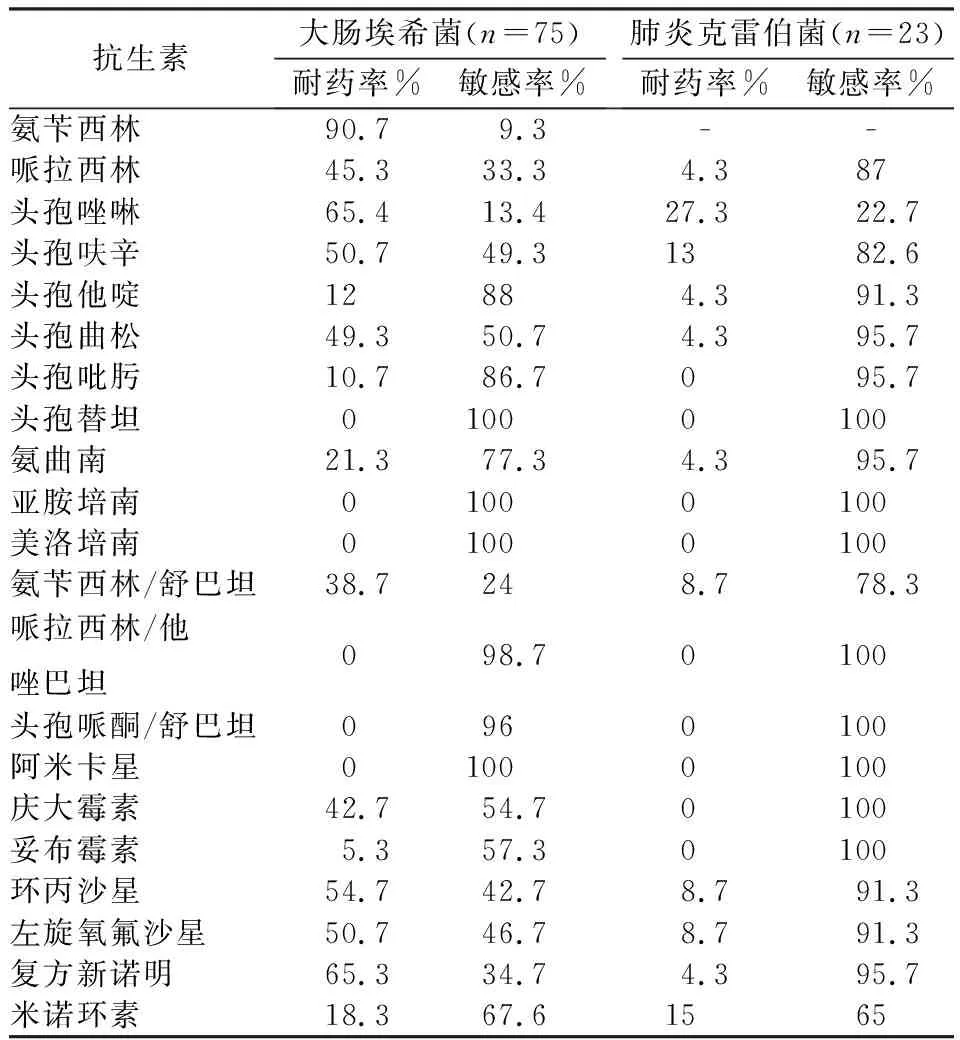
表2 大肠埃希菌和肺炎克雷伯菌药敏情况分析表
2.3 主要分离的阳性病原菌药敏情况分析分离出的金黄色葡萄球菌中,耐甲氧西林的金黄色葡萄球菌占13.3%,而凝固酶阴性葡萄球菌的耐甲氧西林的分离率达到了66.7%;均未检出对万古霉素和利奈唑胺耐药的菌株,见表3。

表3 金黄色葡萄球菌、肠球菌和凝固酶阴性葡萄球菌药敏情况分析表(%)
3 讨论
人体胃肠特殊的生理结构,导致胃肠外科患者术后感染的机会常常高于其他外科术后的患者,术后感染不仅增加了病人的痛苦,延长住院时间,同时也带来经济上的负担。导致术后感染的因素较为复杂,除与患病部位及严重程度相关外,还与患者年龄、有无基础疾病、切口大小等诸多因素有关。而术后切口的感染是胃肠外科术后最常见的并发症之一,其病原菌往往来源于皮肤或胃肠道。近年来,随着广谱抗生素的大量使用,使得病原菌耐药性也在逐渐发生着变化,对于抗生素耐药性的变迁已经引起了全球性的重视[2]。
本研究是依据胃肠手术患者术后感染标准[3],将创口分泌物分离出致病菌的病例纳入研究数据,分离的致病菌中占比在前两位的是大肠埃希菌和肺炎克雷伯菌,分别占分别占52.4%和16.1%,都是肠杆菌科的细菌,为肠道的定植菌,这与胃肠外科的解剖结构相关,与文献报道的结果一致[4];革兰染色阳性菌中的金黄色葡萄球菌分离率为10.5%,但其MRSA仅为13.3%,说明我院的感染以社区获得性为主,在抗生素的选择上仍可以耐青霉素酶的抗生素作为一线用药。而MRSCN的分离率虽然略高,但其致病性较弱[5],在无深部组织感染和全身感染的症状时,可暂不用药。
目前的胃肠外科手术为了避免术后感染的发生,术前会常规给予手术患者科学服用抗菌药物,抑制或杀灭肠道的细菌[4],但研究表明,外科抗生素预防性使用持续的时间与患者的预后没有相关性[6]。因此,合理的术前肠道准备工作和有效的使用抗生素治疗尤为重要,临床医生应根据患者术前和术后的实际情况及微生物学诊断指标来合理应用抗生素,尽量减少或避免经验用药。
本研究结果为临床医生的术前预防、术后明确感染病原菌及合理应用抗生素提供了有利的依据,同时也降低了院内筛选耐药菌的风险,为院感监测工作提供了科学的数据。

