茶多糖的组成及其对糖代谢的作用机制探讨
许陆达 黄苏萍 杨柳媛
(福建中医药大学 福建 福州350122)
多糖是自然界中含量和种类最为丰富的生物大分子之一,具有复杂的结构和多样化的生物活性。茶多糖作为多糖家族的一分子,同样具有多糖类的一些共性,比如复杂的空间结构、生物活性还有理化性质。研究表明茶多糖具有降低血糖,降低血脂,增强机体免疫力,抗凝血和血栓,减慢心率等作用[1]。茶多糖的组成、结构及降血糖、降血脂作用一直是近年来研究的热点,研究茶多糖对糖尿病的防治具有重要意义。
1 茶多糖的组成及其差别
1.1 茶叶中茶多糖的组成成分
茶多糖是一类有活性的复合多糖,其多糖部分主要由葡萄糖(Glu)、半乳糖(Gala)、阿拉伯糖(Ara)、木糖(Xyl)、甘露醇(Man)等组成。茶叶的种类较为繁多,由表1可知,不同茶叶的茶多糖分子量不同,多糖的组成成分也不尽相同,同一类单糖的占比也不相同。
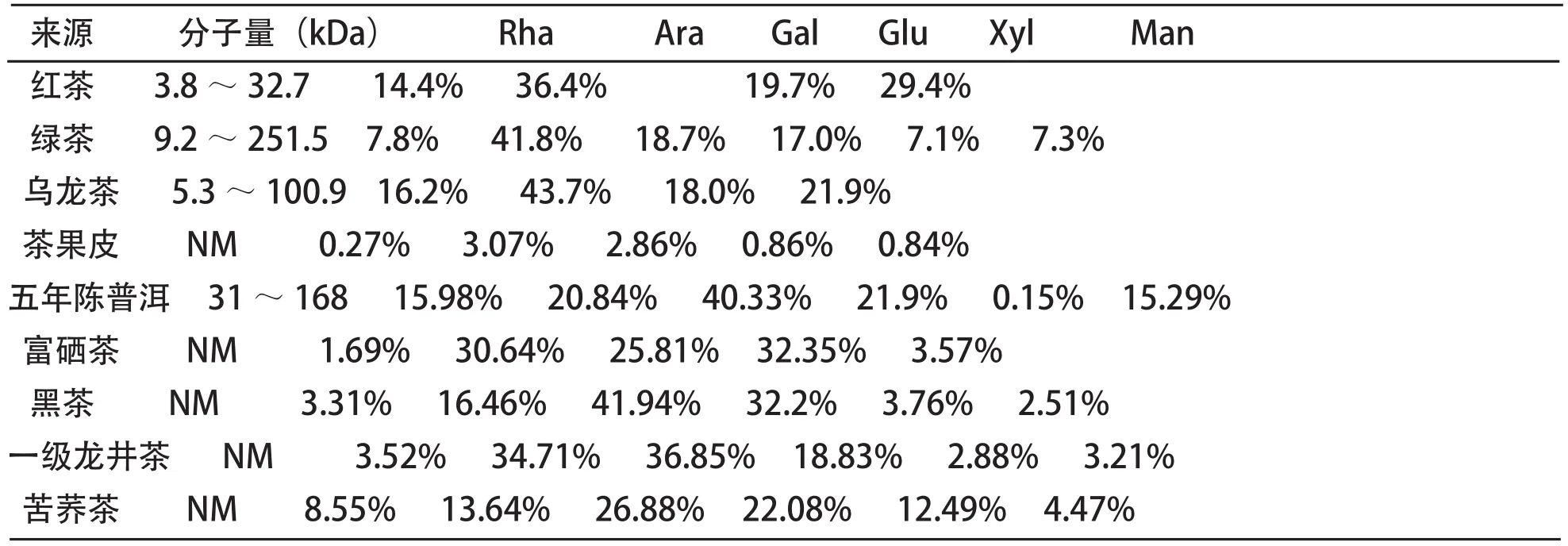
表1 茶多糖的分子量以及单糖的组成[2-7]
茶多糖除了单糖成分,其中还含有一些游离的蛋白质,但含量较少,其作用机制也未见研究报道。茶多糖中的单糖与某些矿物质如镁、钙、锰、铁、锌等呈紧密结合的状态,生物大分子对其结构以及作用机制有一定的影响[4]。
1.2 不同茶叶中茶多糖的差异
茶叶按发酵程度可分为绿茶、红茶、青茶、黑茶、白茶、红茶六大类[8];宋励修[9]通过硫酸酚比色法测量不同类茶叶中的茶多糖含量,结果发现祁门红茶的茶多糖含量相对较低,而云南普洱的黑茶茶多糖含量相对较高,原因可能是红茶是全发酵茶,黑茶为后发酵茶,黑茶的加工工序存在湿热作用和微生物酶解,可能易于多糖复合物的形成,所以茶多糖含量相对较高。相比较而言,茉莉花茶的茶多糖含量相对较低,可能是因为花茶制备中在鲜花吐香环节有复杂的生物化学变化,把其中的糖酶促和氧化成了芳香物质,降低了多糖含量。与绿茶等未发酵茶相比,全发酵茶(如红茶)和后发酵茶(如黑茶)常常选择成熟度较高的茶叶作为原料,且高成熟度叶片中多糖含量普遍高于新叶[10]。
倪德江[11]采用55℃减压浓缩3倍后再用95%乙醇沉淀的方法从茶叶提取茶多糖,以福鼎白茶、玉斗镇水仙茶、云南大叶种无性系茶为三种茶叶为原料,并混匀,按照红茶,绿茶,乌龙茶的制作工艺制成红茶,绿茶,乌龙茶;结果发现TPS的多糖得率从高到低依次是绿茶>乌龙茶>红茶。陈金娥[12]采取常规萃取法萃取茶叶中的茶多糖,以福建寿宁绿茶、浙江狮峰龙井绿茶、云南西双版纳普洱茶、湖南祁门红茶、福建安溪乌龙茶为原料,测定的结果为TPS的多糖得率从高到低为乌龙茶>红茶>普洱茶>龙井绿茶>绿茶(河南信阳毛尖)。两者的实验结果差异明显,倪德江提取的绿茶茶多糖得率最高,而陈金娥提取的绿茶茶多糖得率最低,造成这种差异的原因可能有以下两种:一、倪德江在提取过程中采取了脱蛋白操作,在脱蛋白的同时带走大量的多糖类物质[13],因此会影响实验结果;二、两者采取的提取方法不同,后者的提取方法采用了多次定容提取和超声提取;不同茶叶中的茶多糖单糖的组成比例也存在着差异,如表1。
1.3 同类茶叶中茶多糖的差异
茶叶的产地、质地等因素,也会影响茶叶中茶多糖含量的不同。同样为绿茶,从茶多糖含量上来看,安徽黄山毛峰>河南信阳毛尖[12]。同为红茶,福建政和产的红茶茶多糖含量大于湖南祁门产的红茶[14]。生茶与熟茶中茶多糖的含量也不相同,同为龙润普洱茶,熟茶中茶多糖的含量远远高于生茶。从茶多糖的组成上来看,不同等级的茶叶其各类单糖的组成比例存在差异,如表2[15],
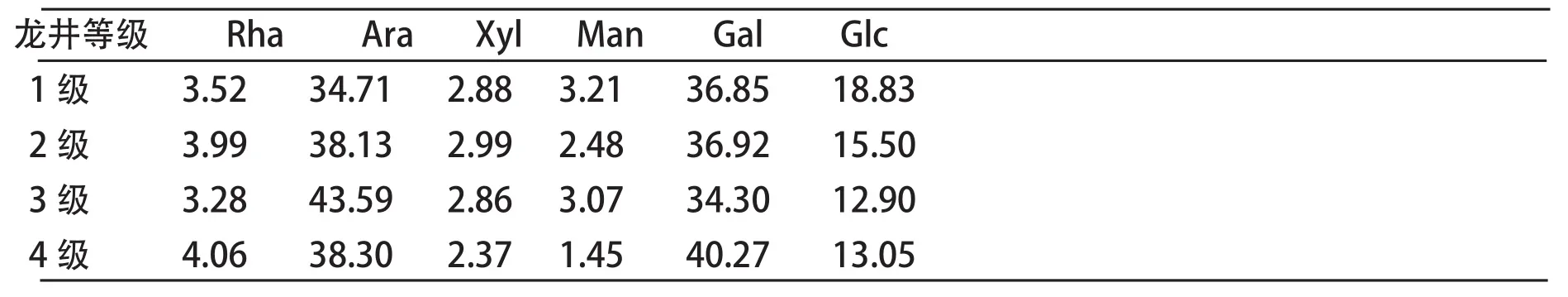
表2 不同等级茶叶各类单糖的组成比例 (mol%)
1.4 不同提取方法对茶多糖的影响
茶多糖较易溶于水,在高温以及化学制剂的作用下易分解。茶多糖的提取方法较多,不同方法对茶多糖的影响也不同;常用的提取方法有水浸法,酶辅助提取法,微波辅助提取法等[16]。杨军国[17]在乌龙茶的提取过程中,采用“先65%醇洗+后水提”和“先水提+后65%醇沉”2种提取方法,最后发现前者的茶多糖提取率更高,但组成上可溶性蛋白最低。陈海霞[18]通过三种提取方法,结果发现采取超滤法较好地保护了茶多糖的活性,但茶多糖提取率不高。Yuanfeng Wang[19]采用热水提取法和酶提取法等方法从绿茶中提取茶多糖,酶提取法更有利于提高绿茶茶多糖中Ara,Gal和GalA(半乳糖醛酸)的占比,且酶的加入和较高的温度能够提高茶多糖的提取率,但对Xyl和Man占比的影响不大。
2 茶多糖的降糖活性及作用机制
茶叶作为我国的日常饮品,有着上千年的悠久历史,在东亚地区如中国和日本,就有人用粗茶治疗糖尿病[20]。现代研究证实,茶叶具有抗氧化,降血糖,抗癌等多种功效[21],而茶叶中的茶多糖具有抗氧化、降糖降脂、抗肿瘤、免疫刺激、抗病毒、抗菌等多种生物活性[22]。多糖是生物大分子的主要类别。它们的生物活性取决于化学结构,其中包括单糖组成,糖残基下方的键和溶液构象[23]。茶多糖作为多糖的一种,其特定的生物活性与其单糖组成、分子量以及高级结构密切相关[10]。宋丽珍[24]用四氧嘧啶诱导小鼠非肥胖型糖尿病,以100 mg/(kg·d)剂量的TPS灌胃干预6周,实验结果为茶多糖组小鼠的血糖由18.98mmol/L降低至正常水平,茶多糖组的胰脏中胰岛素的含量与正常组相当。李淑琴[25]通过对高糖高脂饲料辅以链脲佐菌素(STZ)诱导产生的糖尿病模型小鼠灌喂(200,400,800 mg/kg)剂量的茶多糖溶液(多糖纯度26.11%),结果发现400mg/kg剂量降糖效果最佳。
TPS能够通过保护胰岛β细胞、促进肝糖原的合成、调节代谢酶的活性、调节信号通路、抗炎及抗氧化等作用机制降低血糖。其中茶多糖的抗炎抗氧化作用较弱,且相关研究较少,因此TPS的抗炎抗氧化作用有可能不是其降血糖的主要途径[26]。
2.1 茶多糖保护胰岛β细胞的功能
部分糖尿病患者会出现胰岛β细胞损伤,导致胰岛素分泌减少,机体血糖浓度升高。茶多糖的体外实验表明,茶多糖具有保护胰岛β细胞的作用。陈建国[27]采用H2O2诱导Beta-TC-6细胞损伤,模型组小鼠Beta-TC-6细胞存活率显著下降(P<0.001),茶多糖组中诱导损伤后次日在培养皿中加入一定浓度梯度的茶多糖。结果茶多糖组细胞存活率相比较模型组显著提高(P<0.01)。在实验中,随着TPS浓度的提升,胰岛β细胞内的cAMP(环磷酸腺苷)的含量也随之提高,而胰岛素的分泌与体内cAMP水平呈线性相关,茶多糖保护胰岛β细胞的作用可能是通过提高细胞内cAMP浓度来实现的。王林戈[28]用STZ(链脲佐菌素)诱导MIN6细胞(胰岛β细胞株)的损伤,并将500μg/mL茶多糖提取物加入培养皿中进行干预,发现对受损的MIN6细胞保护作用显著,且可以抑制STZ所致Caspase-3活性升高,进而减缓胰岛β细胞的凋亡,茶多酚(TP)联合TPS效果更为显著。茶多糖保护胰岛β细胞的作用可能与抑制Caspase-3的活性有关。
2.2 茶多糖促进肝糖原的合成
肝糖原是体内血糖的重要来源,肝糖原的合成与分解受体内胰岛素水平的影响。在健康人中机体肝糖原的合成与分解处于动态平衡中,机体一旦出现胰岛素抵抗,这种平衡会被打破,导致糖原的分解异常增多,合成减少,血糖水平提高。芮莉莉[29]用粗绿茶TPS(50,100,150 mg/kg)对糖尿病模型小鼠灌胃8周,发现中高剂量组小鼠肝脏中肝糖原含量较对照组明显升高(P<0.05),推测茶多糖可能通过增加肝糖原的积累来降低小鼠体内血糖水平。东南大学孙佳菊[30]用枸杞多糖、茶多糖混合物饲养STZ诱导的糖尿病小鼠,发现混合物能够增加小鼠胰岛素的敏感性,从而提高小鼠机体转化肝糖原的能力,降低血糖值。茶多糖可能通过增加肝糖原途径来降低血糖。王黎明[31]TPS可以显著增强肝脏葡萄糖激酶和己糖激酶活性,浓度为1 mg/mL的TPS可使己糖激酶和葡萄糖激酶相对活性分别提高99.57 %和82.97 %;10 mg/mL的TPS可使葡萄糖激酶和己糖激酶提高152.09 %和156.10 %,两种酶能通过促进肝糖原的合成,来降低血糖,不同的是己糖激酶在高浓度的葡萄糖下才会发挥作用。茶多糖可能通过影响己糖激酶和葡萄糖激酶的活性来降低血糖。Aschenbach J R发现在肝脏有GLUT1,GLUT2和GLUT8的表达[32],而未发现GLUT5的表达,茶多糖对GLUT2转运糖类物质具有一定的作用,因此茶多糖可能通过下游GLUT蛋白的表达促进肝糖原的合成。
2.3 茶多糖调节代谢酶的活性
2.3.1 茶多糖抑制α-糖苷酶活性作用
α-糖苷酶属于葡萄糖苷酶的一种,其作用是通过水解葡萄糖苷键来获得人体可以直接利用的葡萄糖,该酶处于小肠刷状缘上,它的活性影响着人体对大分子的淀粉、蔗糖等的利用。α-糖苷酶与代谢紊乱失调引起的疾病有着很大的关系,如糖尿病、癌症、病毒感染。西药拜糖平也是通过在肠道内竞争性抑制葡萄糖苷酶,减少多糖和蔗糖分解为葡萄糖,降低餐后高血糖。Qianfei Huang[33]从云南普洱茶中提取茶萃取物,他采用了几种不同的方法提取茶叶混合物中的茶多糖,每一种提取方法萃取物中的茶多糖含量都不同。随后用萃取物50mg/kg作用于用四氧嘧啶诱导的糖尿病小鼠,发现能降低小鼠的餐后血糖。在体外实验中,随着萃取物中茶多糖浓度的提升,对α-糖苷酶活性的抑制作用也随之增强,作用效果低于阿卡波糖,但强于茶多酚。Yuanfeng Wang[19]用热水提取法,沸水提取法,酶提取法从河北产绿茶中提取含有茶多糖的混合物,并在5.0mg/mL浓度的下比较三中方法的提取物对α-糖苷酶活性的抑制作用,发现沸水提取法>酶提取法>热水提取法,而茶多糖的含量每5mg中沸水提取法>酶提取法>热水提取法;另外对糖苷酶的抑制作用随着中性多糖的含量的增加而提高,与酸性多糖的含量没有关联。
2.3.2 茶多糖抑制α-淀粉酶的活性作用
α-淀粉酶(α-Amylase)又称为1,4-α-D-葡聚糖葡聚糖水解酶,存在于人的唾液和胰脏等中,随机切断多糖内部的α-1,4-链,最终产物为葡萄糖,麦芽糖,糊精等混合物。在Ⅱ型糖尿病的治疗过程中, α-葡萄糖苷酶和α-淀粉酶抑制剂发挥着重要作用[34],通过抑制α-淀粉酶活性减少葡萄糖的摄入。何学斌[35]用水提醇沉法从老红茶叶中提取茶多糖,在体外将茶多糖与α-淀粉酶的反应时间分段设为10~40min,结果显示茶多糖的量效曲线接近直线,呈剂量依赖性,并在20min时间段达到最大。通过灌胃途径给予茶多糖(200mg/kg)的糖尿病大鼠餐后2h血糖明显低于糖尿病模型组。其降糖机制可能与抑制α-淀粉酶活性有关。中山大学杨立群从绿茶中分离出酸性茶多糖(TPSA),并在体外与α-淀粉酶进行混合以研究两者的相互作用关系。结果表明在基底TPSA与α-淀粉酶形成了一种稳定的复合物,可能与抑制α-淀粉酶的活性有一定的关联[36]。Yuanfeng Wang[19]发现三种不同提取方法提取出的绿茶茶多糖对α-淀粉酶的活性抑制作用低于对α-糖苷酶的活性抑制作用。
2.4 茶多糖改善肠道菌群微环境
肠道菌群的失衡与糖尿病密切相关,肠道菌群的稳态能够抵御致病菌的入侵,而致病菌的入侵会导致肠道的慢性炎症,过多炎症因子的释放也是造成机体糖脂代谢紊乱的一个因素。现代研究证实,调节肠道菌群的微环境,补充益生菌,能够降低血糖并提高胰岛素的敏感性[37]。肠道菌群通过分解碳水化合物形成短链脂肪酸(SCFAs)和氨类物质,SCFAs不仅可以被氧化为群菌提供能量,还可以维持肠道菌群的平衡[38]。除此之外,胰高血糖素可能是由SCFAs调节,且血糖、胰岛素、SCFAs存在关联[39]。李海珊[40]从江西婺源的绿茶中提取TPS,并用低中高(25,50,100 mg/kg)剂量的TPS来干预正常的小鼠,21d后用气相色谱法检测小鼠肠道内的SCFAs水平,结果表明灌胃TPS能明显增加小鼠肠道内SCFAs的浓度。Chen G J[41]的研究发现茯砖茶多糖(FBTPS)能够大部分到达肠道,且被肠道分解和利用,肠道内的SCFAs也显著增加。
2.5 茶多糖调控糖代谢信号通路
磷脂酰肌醇3激酶(PI3K)/蛋白激酶B(Akt)信号通路是胰岛素信号转导的主要途径,是调节血糖的主要信号通道。IR(胰岛素受体)与INS(胰岛素受体底物)结合后,使受体底物磷酸化,激活PI3K/Akt通路,上调GLUT以调节糖原合成和葡萄糖的摄入。Shuqin[42]从黄山绿茶中提取TPS,并用溶解于生理盐水中的茶多糖对2型糖尿病(T2DM)大鼠以中高剂量(400,800mg/kg)进行灌胃处理,结果发现实验组的大鼠餐后血糖水平下降,TPS的摄入提高了GLUT4的水平,从而一定程度上恢复了葡萄糖的动态平衡。3种剂量的茶多糖组的Atk水平分别比糖尿病对照组的Atk水平分别提高了55.05%、166.53%和226.83%(p<0.05),同时PI3Kp85/p-Akt/GLUT4的表达增加。茶多糖降低血糖的作用机制可能是通过上调PI3K/Akt信号通路来实现的。杨新河[43]提取普洱茶TPS,并用50μg/mL的TPS刺激前脂肪细胞的分化,结果发现能明显上调GLUT4 mRNA的表达,使GLUT4蛋白数量增多。GLUT4数量的增加会提高机体对葡萄糖的转运能力[44]。芮莉莉[29]发现高剂量组的茶多糖能升高GLUT4在小鼠脂肪组织中的表达(P<0.05),但低剂量组和中剂量组无统计学意义。
cAMP(环磷酸腺苷)/PKA(激酶A)信号通路是胰高血糖素信号转导的主要途径,由G蛋白偶联受体将信号首先传至腺苷酸环化酶(AC),由它控制cAMP的含量,cAMP又激活PKA,从而产生生物学效应[45]。Huijun Wang[46]将绿茶TPS(浓度为200μg/mL)作用于胰岛细胞,经过TPS的治疗后,胰岛细胞分泌胰岛素的功能增加,且在mRNA水平上能显著上调PKA、GLUT2(葡萄糖转运蛋白2)的表达。
2.6 抗炎及抗氧化作用
2.6.1 茶多糖清除氧自由基的作用
茶多糖有一定的抗氧化活性,但其抗氧化活性不如茶多酚(Tea Polyphenols)显著[33];研究表明,氧化应激是二型糖尿病致病和疾病发展的一个因素[47];氧化应激反应,是由于活性氧(ROS)/活性氮物质(RNS)与细胞抗氧化防御机制之间的不平衡,产生细胞内的氧化应激。反过来,过量的ROS/RNS物质介导对蛋白质和核酸的损害,从而对机体造成损害。氧化应激反应可以直接引起β细胞的损伤,也可以影响β细胞胰岛素的合成与分泌,且诱导胰岛素抵抗[48]。茶多糖的抗氧化活性可能对血糖有一定的调控作用。浙江大学c从五年陈普洱茶中提取茶多糖,通过灌胃40mg/kg剂量的五年陈普洱茶多糖能将糖尿病组小鼠血清以及肝脏组织中的MDA(丙二醛)含量和SOD(超氧化物歧化酶)活性改善至和正常组小鼠无差异水平,GSH-Px(谷胱甘肽过氧化物酶)活性甚至显著高于正常组的小鼠(p<0.05)。此外,连续灌胃40mg/kg剂量的五年陈普洱茶多糖的小鼠血糖水平明显下降,说明普洱茶多糖能通过抗氧化作用来调节小鼠体内的血糖水平。应乐等人以六堡茶为原料,利用水提醇沉法制得茶多糖粗品,通过检测ABTS自由基清除能力、FRAP铁离子还原能力等,对HUVEC损伤模型的还原能力,发现茶多糖的抗氧化活性可能与其相对分子质量密切相关,低分子量的组分含量越高,其生物活性越高[50]。
2.6.2 茶多糖的抗炎作用
TNF-α(肿瘤坏死因子-α)与糖与脂质的代谢密切相关,TNF-α mRNA在各种糖尿病小鼠模型中均有过度表达[29];TNF-α能够通过抑制胰岛素来减少机体对葡萄糖的摄取和抑制相关蛋白的表达[51],也可以通过GLUT4 mRNA和GLUT4蛋白抑制葡萄糖的转运。Luna-Vital D[52]在对花青素的研究中发现,GLUT4和TNF-α存在很强的关联,通过增加GLUT4蛋白的表达能够对TNF-α诱导的炎症细胞产生修复作用。华南理工大学胡婷[53]从苦丁茶中分离TPS,并优化了提取工艺,发现茶多糖可能通过过调节TNF-α、IL-6、IL-1β的表达,来影响免疫活性。茶多糖可能通过减轻肝脏的炎症反应来降低小鼠机体血糖水平。
3 讨论
茶文化是中国传统文化的一部分,而丰富的茶叶种类又使茶文化独具魅力;茶叶的类别繁多,常见的如绿茶,红茶,乌龙茶,粗老茶等等。TPS作为茶叶中的一种活性成分,种类颇为繁多;不同茶叶中的TPS存在差异,不同提取方法会造成茶多糖组成上的差异,这也导致了不同研究者的实验结果存在一定程度的差别;无法对TPS定量分析,且TPS大分子结构尚未明确,这为TPS的研究造成了一定的困扰。
TPS有较为明显的降血糖作用,明确的作用机制如下(1)保护胰岛β细胞;(2)促进肝糖原的合成;(3)调节代谢酶的活性(4)调控PI3K/Akt通路(5)抗炎及抗氧化(6)改善肠道菌群环境;TPS的降血糖机制部分与茶多酚类似,原因可能与TPS和茶多酚调节糖代谢的通路一致有关;大部分的研究只表明TPS在某一通路、某一作用机制上对血糖产生影响,但尚未有研究者研究TPS降血糖主要的作用机制或者主要作用途径,甚至有些作用机制尚不明确;TPS多糖成分中哪一成分对血糖的影响最大,及其成分的理化作用和性质,都是TPS研究中的盲区;这些因素制约了茶多糖的医用价值和实用价值。
TPS的提取工艺尚未完善,一方面在提取过程中会损失较多的TPS,提取率较低,另一方面,茶多糖的结构在提取过程中由于提取工艺的影响会发生变性,从而影响其部分活性,TPS的提取工艺也是制约其发展的一个因素。虽然对TPS的现阶段研究尚不完善,但TPS的医药、保健潜力巨大,一旦运用,可以减少糖尿病患者对药物的依赖,用TPS制品作为临床用药的补充。健康人可以每日服用TPS来降低患糖尿病的风险。TPS的前景十分广阔,关于茶多糖的研究应更加深入,更加全面。

