电化学方法制铁研究的进展
许 茜 黎阿巧 孙晨藤 程红伟 邹星礼 鲁雄刚
(1.省部共建高品质特殊钢冶金与制备国家重点实验室,上海 200444; 2.上海市钢铁冶金新技术开发应用重点实验室,上海 200444; 3.上海大学材料科学与工程学院,上海 200444)
钢铁的生产与使用是人类文明发展的里程碑,对现代社会产生了深远的影响。铁及其合金在未来很长时间内也将是工业生产和生活中应用最广泛的材料。目前,主要采用铁矿石通过高炉还原、转炉吹炼和炉外精炼高效率生产钢铁,但一直采用焦炭作还原剂和燃料。焦炭是由不可再生资源煤炭经炼焦获得的,随着煤炭资源的消耗,碳还原制铁的方法将受限于化石燃料枯竭。此外,用焦碳作还原剂生产钢铁还伴随有大量CO2气体的排放。每生产1 t钢铁约产生1.9 t CO2,按每年钢铁产量13亿t计算,每年产生的CO2量可达24.7亿t[1- 2]。据国际能源局统计,钢铁行业排放的CO2量约占世界CO2总释放量的4%~5%,对全球气候变化带来了极大的负面影响。欧盟钢铁业于2004年成立了ULCOS(超级二氧化碳炼钢)协会,旨在开发突破性的钢铁生产工艺,减少钢铁生产过程中CO2气体的排放[3]。
为降低钢铁行业的CO2排放量,可从碳的输入层面减少甚至不用碳作还原剂。目前有两种可能的选择:一是用氢还原制铁[4- 6],另一种是电化学方法炼铁。虽然两种方法的工业化进程都面临着巨大的挑战,但与氢还原炼铁技术相比,电化学冶金可直接利用电能还原铁的氧化物,是一种反应过程易于调控且具有较高能效的生产技术[7]。随着核能、风能、太阳能等新能源技术的完善与成熟[8],绿色高效的电化学冶金技术将起到越来越重要的作用。将绿色电能用于钢铁生产是变革性技术的研发热点之一。本文从高温和低温电化学两方面回顾和总结目前有关电化学法制铁技术的研究,阐述不同电化学方法的基本原理,分析比较用不同方法冶炼铁的优势和存在的主要问题,并展望了未来的发展方向。
1 高温电化学法炼铁
熔盐和熔融氧化物均为离子熔体,属于第二类导体,具有高温稳定性好,高温下传质及反应速率快等优点。目前研究高温电化学炼铁技术的方法大致有3种:(1)熔融氧化物电解(molten oxide electrolysis, MOE)法,(2)熔盐电解法,(3)熔盐电脱氧法,即剑桥法(fray farthing chen, FFC)。
1.1 熔融氧化物电解法
熔融氧化物电解法炼铁是以氧化铁为原料,采用含二氧化硅和二氧化钙等成分的熔融氧化物作电解质,以液态铁为阴极,惰性材料为阳极,分别在阳极析出氧气,阴极沉积金属铁,根据虹吸原理,铁液可自行流出。电解过程示意图见图1,该过程可实现连续生产。电化学反应式如下:
阴极反应:
4Fe3++12e→4Fe
(1)
阳极反应:
6O2--12e→3O2
(2)
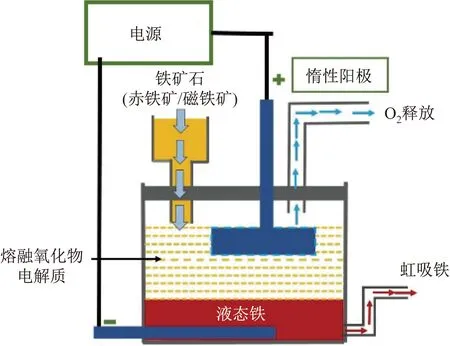
图1 电解熔融氧化物制备液相铁的示意图[9]Fig.1 Illustration of fabrication of liquid iron by electrolyzing molten oxide[9]
总反应:
4Fe3++6O2-→4Fe+3O2
(3)
为揭示MOE法炼铁的电极反应动力学与反应机制,Kvalheim等[10]采用循环伏安法与计时电位法等研究了溶解在SiO2- CaO- MgO- Al2O3体系中的Fe2O3在1 400、1 500和1 550 ℃的电解行为,发现有Fe3+→ Fe2+的单电子转移阴极反应峰,表明Fe3+分步还原成铁。Zhang等[11]采用循环伏安法与方波伏安法等研究了溶解在SiO2- CaO- MgO- Al2O3- NaF体系中的Fe2O3在1 673 ℃的电解进程,指出了用MOE法电解Fe2O3制备Fe的分步还原机制;电解质中的NaF作为助熔剂可提升电解质的性能,降低电解质的黏度、提高离子导电率[12- 13]。用熔融氧化物作电解质,金属氧化物的溶解度大,并且电极反应速率快;此外,用该方法生产的铁为液态铁,氧含量较固态细粉状铁的低[14]。但MOE法炼铁操作温度高达1 600 ℃,能耗大,电流效率仅60%左右[15]。
此外,MOE法还需要经久耐用的惰性阳极材料,该材料必须具有耐高温、抗阳极极化、抗氧化等特性[16]。Wang等[17]采用贵金属铱作阳极,在1 575 ℃电解含FeO的MgO- CaO- SiO2- Al2O3氧化物熔体,分别在阴极与阳极制得液态铁和氧气。研究发现,铱阳极的溶解速率约为7.7 mm/y,可作为MOE法炼铁的惰性阳极材料。但金属铱的价格昂贵,地壳中的储存量极低,无法满足大规模钢铁生产的需求。同时研究[18]发现,铱只适合在SiO2含量高的酸性电解质中使用,提高电解质中CaO含量会加速铱的损耗;而SiO2含量高的熔融氧化物电解质黏度大、离子电导率低,导致Fe3+的传输及氧气的析出速率小。Allanore等[19]采用难熔合金Cr1- xFex作为MOE法炼铁的阳极材料,阳极表面形成的Cr2O3与Al2O3混合氧化物膜引起的欧姆降在可接受范围内,且阳极具有良好的导电性,并在数小时的电解过程中保持稳定,可确保氧气析出。难熔金属合金扩大了MOE法炼铁阳极材料的选用范围,但合金阳极的使用寿命还有待提高。
1.2 熔盐电解法
熔盐电解法制铁通常采用金属卤化物或碳酸盐等熔融盐作电解质。氧化铁是含铁原料,将氧化铁溶解在熔融盐中,在阴极上析出铁,在惰性阳极上析出氧,或在碳阳极上析出CO和CO2。相较于熔融氧化物电解制铁,熔盐电解法制铁的电解温度低。但氧化铁在熔盐中溶解度低,导致电解过程极限电流密度小,铁的生产效率低,电解效率低。此外,熔盐电解的产品通常为粉末状铁,难以与熔融电解质分离[20],很难实现连续化生产。
如何提高含铁原料在熔盐中的溶解度是人们关注的问题。有研究者尝试采用FeCl2作原料[21],但制备FeCl2需经铁矿石氯化,工艺流程长、设备要求高。为解决铁氧化物在卤化物熔盐中溶解度有限的问题,国内外研究者研究了铁氧化物在熔盐中的溶解度和溶解机制。Wang等[22]研究了Fe2O3在CaCl2- NaCl熔盐中的电化学行为,发现AlCl3、AlF3和MgCl2能增加Fe2O3的溶解度,但电解过程会有Fe(Ⅱ)及氯气产生。Licht等[23]则发现,Fe2O3在较高温度下可溶解于熔融Li2CO3,升高温度可增大Fe2O3的溶解度。电解温度的提高可增加熔盐的离子导电率,并降低Fe2O3的分解电压。根据该研究成果,Licht提出了零碳排放的Hy- STEP炼铁工艺,工艺流程及原理如图2[24]所示。该工艺利用风能提供电解用电,太阳能则用于维持电解槽所需热量。

图2 零碳排放的Hy- STEP炼铁工艺的流程图[24]Fig.2 Flow chart of Hy- STEP for ironmaking free from carbon dioxide emission[24]
Xie等[25]以石墨坩埚底部作为阴极,在660 ℃将坩埚中含水的LiCl熔化,作为电解质。该温度下形成的水蒸气与部分熔融LiCl反应生成HCl溶解于电解质中,以0.97 V电压电解,可在阴极产生H2。H2将坩埚底部的Fe2O3粉末还原为Fe。还原过程中无需溶解Fe2O3。该方法解决了原料的溶解度限制及氢气运输与存储的难题,且电解所需电压低,电解过程的能耗小。但是,如何将产物与熔盐有效分离和实现连续生产仍需进一步研究。
1.3 熔盐电脱氧法
属于熔盐电脱氧法的FFC法是由剑桥大学Fray等提出的[26- 28]。该工艺的阳极一般为石墨电极,阴极为对应金属氧化物的预制电极。通过在低于熔盐分解的电压下直接电解还原金属氧化物制备金属,电解形成的氧离子溶解在熔盐电解质中,并从阴极扩散到阳极。电极反应式[29]:
阴极反应:
2MexO+4e=2xMe + 2O2-
(4)
阳极反应:
C+2O2-=CO2+ 4e
(5)
总反应:
2MexO + C = 2xMe + CO2
(6)
通过熔盐电脱氧法可直接电解还原固态铁氧化物阴极,在阴极获得金属铁。为避免电解过程中产生CO2,也有研究者尝试采用镍及其合金作惰性阳极[30- 32],在阳极上生成O2。熔盐电脱氧法也可用于生产镍铁合金[33]。熔盐电脱氧法制铁具有流程短、产物生长过程中无枝晶等优点,但电化学转化所涉及的反应与离子迁移步骤复杂,且固相还原速率较低[34]。
Li等[35]将Fe2O3粉末烧结制成阴极片,在800 ℃的CaCl2熔盐中以1.8~3.2 V电压电解2~20 h,可获得铁粉。在2.2 V的电压下,能量密度高于90%,能耗仅约3.0 (kW·h)/kg。但若电压过高(大于2.4 V),熔盐中的Ca2+会在阴极沉积获得金属钙,且施加的电压还影响产物铁的形态。该研究还指出,Fe2O3的还原步骤为Fe2O3→ FeO → Fe。Li等[36]还研究了在800 ℃的NaCl- CaCl2熔盐体系中Fe2O3的电脱氧行为,发现Fe2O3还原有3个过程:Fe2O3→ Fe3O4→ FeO → Fe。熔盐电脱氧制铁的研究大多采用CaCl2基熔盐体系,这是由于氯化钙熔盐在900 ℃的分解电压高达3.2 V,热力学稳定性好,且对氧化钙的溶解度大,即对氧离子的溶解度大。但氯气与氧气的析出电压接近,氯气析出以及氯化物熔盐对电解装置具有较强的腐蚀性。Gibilaro等[37]曾在LiF- NaF熔盐中以Au作阳极,通过电解还原Fe3O4阴极制铁。但氟化物熔化温度高,且有毒性,更难以达到环保要求。
近年来,也采用熔融氢氧化钠和碳酸盐作电解质电脱氧制铁。Cox等[38]将Fe2O3颗粒压入镍篮中作阴极,在熔融NaOH中以1.7 V电压电解1 h得到金属铁。该过程的电流密度为0.5 A/cm2,生产1 kg铁消耗的电能为2.8 kW·h。Yin等[32]以Ni10Cu11Fe合金作阳极,在K2CO3- Na2CO3熔盐中电解固态氧化铁,电流效率高达95%,生产1 kg铁消耗的电能为2.87 kW·h,该镍基合金惰性阳极可在熔盐中连续稳定地使用。Tang等[30]研究了该体系的电还原过程,发现Fe2O3首先在熔盐中形成NaFe2O3,然后被还原成NaFeO2和Fe,最后NaFeO2也转变成Fe。
目前,熔盐电脱氧制铁仍需要较纯净的氧化铁原料,电负性比铁负的金属很难通过电脱氧去除。同时,阴极过程涉及到固相扩散,电脱氧制铁生产效率也需提高。此外,电脱氧制铁得到的产品是由微小铁颗粒组成的团块,难以有效分离其中凝固的熔盐和降低产物的氧含量。
2 低温电化学法制铁
低温电化学制铁迄今已有一百多年的历史,具有一定的工业规模,所用的电解质为亚铁离子水溶液或氢氧化钠碱性水溶液[39]。低温电化学法制铁所用的电解液成本低,对环境要求简单。但水溶液中的传质速度慢,电解电压过高,产品铁的含氧量高且易形成枝晶[40]。
2.1 亚铁离子水溶液电解质体系
亚铁离子水溶液电解质可通过黄铁矿(FeS2)煅烧后酸浸获得。黄铁矿在800 ~ 900 ℃的惰性气氛中煅烧可失去第2个硫原子而形成FeS,FeS溶解在FeCl3溶液或H2SO4溶液中分别生成FeCl2或FeSO4溶液,净化后得到FeCl2- H2O[41]或Fe2SO4- H2SO4- H2O[42],铁可在铁片或钛板阴极上电解沉积。以黄铁矿作原料在Fe2SO4- H2SO4- H2O体系中电解沉积铁的示意图如图3所示,电极反应式:
阴极反应:
Fe2++2e=Fe
(7)
2H++ 2e=H2
(8)
Fe3++e=Fe2+
(9)
阳极反应:
(10)
Fe2+-e=Fe3+
(11)
在上述电极反应中,只有反应(7)和(10)是水溶液电解沉积制铁需要的电极反应,其余是电极过程的副反应,需抑制。反应(9)和(11)会降低电解的电流效率;反应(8)会消耗电解液的氢离子,使电解液的pH值升高。

图3 以黄铁矿作原料在FeSO4- H2SO4- H2O溶液中电解沉积铁的示意图[43]Fig.3 Schematic diagram of electrolytic deposition of iron in FeSO4- H2SO4- H2O solution using pyrite as raw material[43]
在亚铁离子水溶液电解质中,还可通过电解沉积的方法获得高纯铁产品[44]。高纯铁具有优异的物理化学性能,被广泛应用于航空航天、电子工业等领域,具有极高的应用价值和市场价值[45]。曹为民等[46- 47]以工业废铁屑为原料配置氯化亚铁电解液,使用隔膜以防止阳极液中的Fe3+形成的胶状物进入阴极区。同时配合使用预电解以及在阴极区放置纯铁等方法在钛片上电解沉积铁,制备的铁产品纯度(质量分数,下同)达99.98%。刘琼等[48]以钛作阴极板、钛涂钌材料作阳极,电解经P204萃取得到的高纯硫酸亚铁溶液制备高纯铁,结果表明:在电解液初始pH值为3~4、Fe2+质量浓度为90~100 g/L、电解液温度为80 ℃左右、阴极电流密度为15.0~15.5 A/dm2的条件下,可保持较高的电流效率,获得了纯度接近4N、表面质量较好的高纯铁产品。
此外,还可将铁原料制成可溶性阳极,通过电解精炼在亚铁离子水溶液中制备高纯铁。黄红兵等[49]以工业纯铁作阳极,在FeSO4电解液中电解沉积制备高纯铁,运用正交试验以沉积速率、电流效率、电解铁纯度为指标确定了制备高纯铁的最佳工艺条件,铁的纯度达到了99.98%。再生铸铁也曾被用作电解制备纯铁的可溶性阳极[50- 51],将废铁再生熔炼并浇铸成再生铸铁,以不锈钢为阴极,将废铁屑溶解在稀盐酸中制成电解液,通过直流电解制备纯铁。生产过程中要定期刷洗阳极泥,并有残余阳极。
2.2 碱性水溶液电解质体系
在碱性水溶液电解质中制铁,是在100~120 ℃通过恒定电流电解还原悬浮在电解质NaOH溶液中的赤铁矿颗粒制备金属铁[52- 59],反应式:
阴极反应:
Fe2O3+3H2O+6e→2Fe+6OH-
(12)
阳极反应:
4OH-→O2+2H2O+4e
(13)
总反应:
2Fe2O3→4Fe+3O2
(14)
赤铁矿颗粒的吸附是电解还原过程中的重要步骤。研究表明,赤铁矿颗粒的浓度及电解液pH值对吸附值的影响很小[54]。悬浮的赤铁矿颗粒与阴极直接接触可形成磁铁矿,磁铁矿分布在赤铁矿颗粒的孔隙间[60],导电相磁铁矿可通过改变阴极的电流分布提高反应的电流效率。在1 000 A/m2的电流密度下,通过赤铁矿在110 ℃、质量分数为50%的NaOH溶液中还原制备金属铁的电流效率约为80%[55]。除固- 固电化学反应机制外,部分赤铁矿溶解在电解液中形成的Fe(Ⅲ)也可直接还原成金属铁。但通过该反应机制得到的铁量远低于固- 固反应机制得到的铁量。Yuan等[43]以旋转石墨电极作阴极,在114 ℃电解还原氧化铁,电流效率为90%~95%,铁的纯度高于98%,但在高速旋转的阴极上,铁明显呈树枝状生长。Zou等[61- 62]将烧结的多孔Fe2O3球团用镍网包裹制成阴极,以环形Pt片作阳极,在110 ℃以1.7 V电压在质量分数为50%~70%的NaOH溶液中电解还原制铁,如图4所示。氧化铁的还原过程为Fe2O3→ FeO → Fe。
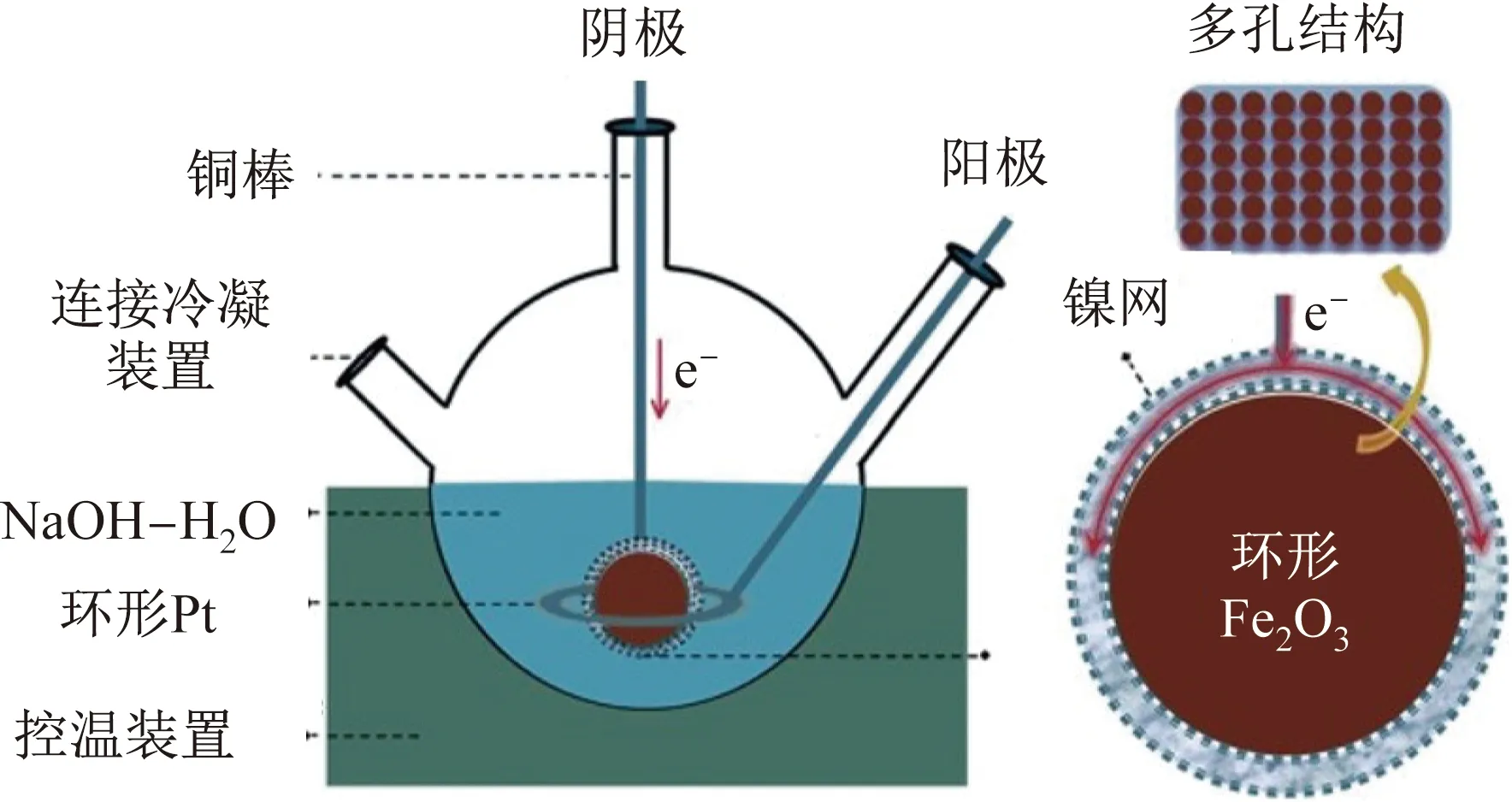
图4 在NaOH溶液中电解还原球形Fe2O3制铁的示意图[61]Fig.4 Schematic diagram of ironmaking by an electrolytic reduction of spherical Fe2O3 in NaOH solution[61]
除赤铁矿外,其他铁氧化物[63- 64]及富铁原料也可用作在NaOH溶液中电解还原制铁的原料。在电解液成分、温度和电解电压相似的情况下,以赤铁矿作原料的阴极电流效率最大;针铁矿次之,二者均远大于以磁铁矿为原料的阴极电流效率。Maihatchi等[65]以富铁赤泥为铁源,在NaOH电解液中电解还原制铁。结果表明:氧化钛和氧化硅等杂质会影响赤泥的表面活性,降低赤泥颗粒在阴极表面的吸附效率,阻碍赤泥的电化学反应。在NaOH溶液中,用电化学方法从赤泥中提取铁的电流效率低,难度大。
3 结语
(1)在低温水溶液介质中电化学制铁已被工业应用,但其生产规模较小,生产的纯铁价格也较高;用该方法制得的铁中氧含量较高,为得到更高纯度的铁还需进行后续处理,电解液稳定性也需提高。目前高温电化学法制铁大多处于实验室研究阶段。为加快其工业应用,尚需开发惰性阳极材料、确定最优熔盐电解工艺及研发连续工业化生产的工序和设备。
(2)随着清洁能源技术的发展,电化学制铁将大幅度降低钢铁行业的CO2排放量,减少对全球气候变化的负面影响;电化学法制铁具有高效、可控等特点,因而具有很强的竞争力。此外,电化学法制备的高纯铁、超高纯铁基合金等产品具有重要的实用价值。

