地西他滨联合CAG方案治疗老年初治急性髓系白血病的效果
田雪姣,徐颖
(河南科技大学第一附属医院 血液科,河南 洛阳 471000)
急性髓系白血病(acute myeloid leukemia,AML)是一种恶性血液肿瘤,骨髓内、外周血原始细胞增殖为其主要表现,可继发出血、感染、贫血等[1]。阿糖胞苷联合阿克拉霉素、粒细胞集落刺激因子(CAG方案)是目前常用治疗AML的措施,能有效杀灭肿瘤细胞,降低病死率,但由于老年患者体能差,个体差异大,恢复慢,因此单独采用CAG方案无法达到理想治疗效果。地西他滨是常用化疗药物,可激活抑癌基因表达,诱导癌细胞凋亡、分化,被广泛应用于治疗骨髓增生异常综合征。本研究选取河南科技大学第一附属医院收治的65例老年初治AML患者,分析地西他滨联合CAG方案的应用价值。
1 资料与方法
1.1 一般资料选取2017年10月至2019年5月河南科技大学第一附属医院收治的65例老年初治AML患者,按随机数表法分为联合组(33例)与对照组(32例)。联合组男18例,女15例;年龄61~78岁,平均(69.85±3.92)岁;FAB分型为7例M2,6例M4,11例M5,9例M6。对照组男19例,女13例;年龄62~79岁,平均(70.14±3.81)岁;FAB分型为6例M2,5例M4,13例M5,8例M6。两组一般资料比较,差异无统计学意义(P>0.05)。本研究经河南科技大学第一附属医院医学伦理委员会审核批准。
1.2 选取标准(1)纳入标准:①年龄>60岁,确认为初治AML;②患者及家属签署知情同意书。(2)排除标准:①合并心肺疾病、肝肾功能异常、其他恶性肿瘤;②合并病毒感染、过敏体质、精神疾病。
1.3 治疗方法对照组接受CAG方案治疗,第1、3、5、7天,阿克拉霉素(扬州奥赛康药业有限公司,国药准字H20060196)20 mg,静脉滴注;第1~14天,阿糖胞苷(瀚晖制药有限公司,国药准字H20054694)10 mg·m-2,每12 h皮下注射1次;第1~14天,粒细胞集落刺激因子(成都蓉生药业有限责任公司,国药准字S20013036)300 μg,静脉注射,若白细胞计数(white blood cell count,WBC)>20×109L-1,停用粒细胞集落刺激因子。联合组接受地西他滨联合CAG方案治疗,CAG方案同对照组,地西他滨第2、4、6天,20 mg·m-2,静脉滴注。14 d为1个疗程,两组均持续治疗2个疗程。
1.4 观察指标(1)疗效。疗效评估标准:临床症状消失,血常规检查血小板(platelet,PLT)>100×109L-1,中性粒细胞(neutrophil,NEUT)>1.5×109L-1,血红蛋白(hemoglobin,Hb)>90 g·L-1,骨髓像幼稚细胞、原始细胞<5%为完全缓解(complete remission,CR);血常规检查、临床症状、骨髓像未达CR标准≤2项,骨髓像幼稚细胞、原始细胞为5%~20%为部分缓解(partial remission,PR);血常规检查、临床症状、骨髓像未达CR标准,骨髓像幼稚细胞、原始细胞>20%为未缓解(non-remission,NR)。将PR、CR计入总有效,计算总有效率。(2)取3 mL静脉血,离心(10 min,3 000 r·min-1),分离血清,以双抗体夹心酶联免疫吸附法测定患者血管内皮生长因子(vascular endothelial growth factor,VEGF)、碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)水平。(3)不良反应(血小板减少、呕吐、发热、肺部感染)发生情况。
2 结果
2.1 疗效联合组19例CR,11例PR,3例NR;对照组13例CR,9例PR,10例NR。两组总有效率比较,联合组[90.91%(30/33)]较对照组[68.75%(22/32)]高(χ2=4.986,P=0.026)。
2.2 VEGF、bFGF治疗前,两组血清VEGF、bFGF水平对比,差异无统计学意义(P>0.05);治疗后,两组血清VEGF、bFGF水平下降,且联合组VEGF、bFGF水平较对照组低(P<0.05)。见表1。

表1 两组治疗前后血清VEGF、bFGF水平比较
2.3 不良反应联合组血小板减少发生率低于对照组,肺部感染发生率、发热发生率、呕吐发生率高于对照组(P<0.05)。见表2。
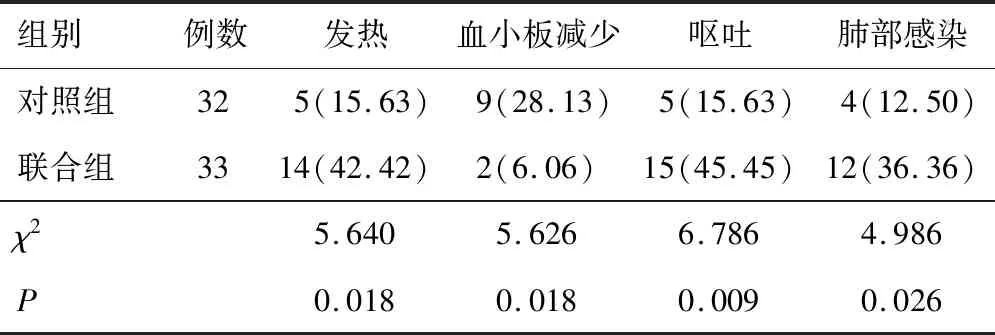
表2 两组不良反应发生情况比较[n(%)]
3 讨论
随着社会的发展,生活水平的提高,人口老龄化加快,老年AML发生率逐渐上升,调查显示,年龄为 65~80岁者AML发生率约为17.6/10万,>80岁者AML发生率约为23/10万,但老年AML患者存活率较低,约为10%,严重威胁患者生命安全[2]。因此临床应及时采取措施,以缓解病情,改善预后。CAG方案是目前临床常用治疗方式,其中粒细胞集落刺激因子能结合AML细胞表达的粒细胞集落刺激因子受体,加快粒细胞集落形成,增强药物敏感性,提高化疗药物杀伤效果,且其可加快粒细胞成熟,释放到外周血中,缩短骨髓抑制时间,减轻不良反应。阿糖胞苷可结合细胞DNA,破坏DNA结构,阻滞复制、转录过程,进而抑制肿瘤细胞恶性增殖,促进肿瘤细胞凋亡。阿克拉霉素能够快速穿过磷脂双分子层,进入癌细胞细胞核,嵌入DNA中,抑制DNA复制、转录,使细胞分裂周期停滞在S晚期、G1期,进而阻滞癌细胞增殖[3]。有研究指出,DNA甲基化异常是AML发生重要表现遗传修饰,能预测预后情况[4]。DNA甲基化异常包括基因启动子区GpG岛高、低甲基化,低甲基化激活原癌基因,而高甲基化致使抑癌基因沉默,例如p15基因,继而可导致细胞增殖调控功能丧失[5]。地西他滨为去甲基类药物,可抑制DNA甲基转移酶,促使基因组产生去甲基反应,以重新活化抑癌基因,调控细胞凋亡、分化,达到抗癌作用,已成为治疗AML、骨髓增生异常综合征等血液学肿瘤的常用药物。同时,低水平的地西他滨能促进抑癌基因表达,而高水平时具有细胞毒性作用,研究表明,其能诱导癌细胞基因CD80表达,发挥细胞毒性作用,进而达到治疗效果[6]。本研究结果显示,联合组总有效率高于对照组,可见地西他滨联合CAG方案治疗效果显著。VEGF、bFGF水平上升会加快血管新生,进而促进肿瘤细胞生长、浸润,因此其水平变化有助于临床判断患者病情。本研究结果显示,联合组治疗后血清VEGF、bFGF水平较对照组低,可见地西他滨联合CAG方案能抑制血管生成,进而缓解病情。此外相关报道指出,MDS患者接受地西他滨治疗可发生呕吐、恶心、肝衰竭、皮疹、腹泻等并发症,而剂量较高时可引发骨髓抑制等血液系统并发症,故联合地西他滨治疗会增加出血、感染、死亡风险[7]。本研究发现,联合组肺部感染、发热、呕吐发生率高于对照组,血小板减少发生率低于对照组,提示地西他滨联合CAG方案会增加不良反应发生风险。分析原因在于地西他滨可刺激巨核细胞系L8057分化,调控血小板表面整合素Ⅱb亚单位表达,故具有升高血小板的作用,且老年人心、肾、肺衰退,药物耐受性差,因此肺部感染等发生风险较高[8]。
综上所述,老年初治AML患者接受地西他滨联合CAG方案治疗效果确切,可抑制新血管形成,但联合治疗不良反应明显,需视病情酌情用药。

