新生儿先天性右侧膈疝的临床诊治*
关茜思, 何秋明, 钟微, 王哲, 吕俊健, 夏波, 颜斌, 余家康
广州市妇女儿童医疗中心新生儿外科(广东广州 510623)
先天性膈疝(congenital diaphragmatic hernia, CDH)是腹腔脏器经膈肌缺损疝入胸腔的先天畸形,发生率为1/3 000~1/2 400[1],可导致肺发育不良、出生后肺动脉高压等一系列病理生理改变,是新生儿急危重症之一。随着近年产前诊断的完善、围手术期管理的规范化和手术技术的发展,患儿的存活率有所提高,但病死率仍高达40%~60%,其致死的主要原因仍是肺发育不良和肺动脉高压[2]。CDH主要发生于左侧,右侧先天性膈疝(RCDH)发生率较低,约为10%~15%,但RCDH的产前诊断更困难,漏诊率较高,生后需要体外膜肺氧合(ECMO)支持的概率更高,病死率也更高[3]。因此对于RCDH,早期准确评估患儿病情的危重程度,制定适宜的诊疗方案,对疾病的预后起着至关重要的作用。本研究通过回顾2013年1月至2019年6月单个医疗中心收治的23例RCDH患儿的临床资料,分析RCDH的产前诊断情况、临床特点及预后。
1 资料与方法
1.1 一般资料 2013年1月至2019年6月广州市妇女儿童医疗中心收治的RCDH患儿。所有患儿均在生后行胸片或CT确诊为右侧膈疝,均行膈肌修补术,术后确诊为胸腹裂孔疝。排除双侧膈疝患儿。所有病例均有完整的临床资料。
1.2 观察指标 回顾并统计RCDH患儿的产前诊断率、围产期复苏情况、出生时胎龄、出生体重、生后需机械通气率、需ECMO支持率、手术例数、手术日龄、补片应用率、胸腔镜应用率、术后并发症发生率、存活率、术后复发率。
依据是否产前发现并诊断RCDH,将病例分为产前诊断组和生后诊断组,比较两组之间以上指标有无统计学差异。产前通过磁共振评估胎肺体积,计算实测/预测总胎肺容积比值(observed-to-expected total fetal lung volume,o/eTFLV),并按照左侧膈疝胎肺发育不良评估标准对本组病例进行分级:(1)中-重度,o/eTFLV≤35%;(2)轻度,o/eTFLV>35%[4]。
ECMO支持指征:(1)不能维持导管前经皮血氧饱和度>0.85,或导管后经皮血氧饱和度>0.7;(2)足够的呼吸支持情况下,二氧化碳分压持续上升伴呼吸性酸中毒(pH<7.15);(3)吸气峰压>28 cmH2O或平均气道压>17 cmH2O才能维持血氧饱和度>0.85;(4)缺氧和代谢性酸中毒,乳酸>5 mmol/L且pH<7.15;(5)对液体疗法及血管活性药物治疗无效的体循环低血压,尿量<0.5 mL/(kg·h)治疗12~24 h;(6)氧合指数≥40至少3 h[5]。
膈肌修补的时机及方式:(1)手术时机:生后临床状况稳定时进行,包括:①平均动脉压在同胎龄新生儿正常范围;②吸氧浓度<50%且导管前血氧饱和度在0.85~0.95;③血乳酸<3 mmol/L;④尿量>2 mL/(kg·h)[6]。(2)微创手术适应证:①体重>2 kg;②无肝脏疝入;③无肠梗阻;④无肺动脉高压或严重心脏畸形;⑤无需高频振荡通气或ECMO支持[7]。近期更改为:①无肺动脉高压;②无需ECMO支持[8]。

2 结果
2013年1月至2019年6月广州市妇女儿童医疗中心收治RCDH的患儿23例,随访中位数为38个月(8~90个月),总体存活率为83%(19/23)。产前诊断12例,出生后诊断11例,产前诊断率为52.1%。
2.1 产前诊断组 产前诊断12例,肝疝入9例次,肠管疝入6例次。9例接受磁共振评估胎肺体积,其中中-重度(o/eTFLV≤35%)2例,轻度(o/eTFLV>35%)7例。11例在我院分娩、出生后转入监护室,1例在外院出生后转运至我院。产前评估为中-重度病例中,1例因生后出现持续性肺动脉高压需要ECMO支持、家长拒绝使用ECMO后患儿死亡,1例术后因无法撤离呼吸机、于134日龄时家长放弃治疗后死亡。7例轻度病例中,2例生后因出现持续性肺动脉高压而需ECMO支持(均接受了ECMO辅助治疗),7例均行手术治疗,均存活。见图1。
2.2 生后诊断组 生后诊断11例,其中产前在三甲医院规律产检3例,2例漏诊,1例误诊为肺囊性腺瘤样畸形并隔离肺;均因生后呼吸急促或呼吸困难,拍X线片或CT诊断。1例需ECMO支持、但家长拒绝使用ECMO后患儿死亡。其余10例均手术治疗,均存活。见图1。
2.3 统计分析及随访 产前诊断组与生后诊断组中,出生胎龄、出生体重、生后需机械通气率、需ECMO支持率、手术例数、手术日龄、胸腔镜应用率、存活率等指标的差异均无统计学意义(表1)。胸腔镜总应用率为65%(15/23),39%(9/23例)需补片修补。总体存活率为83%(19/23),随访中位数为38个月(8~90个月),1例于术后3个月复发、再行手术治疗后恢复。见图1。
3 讨论
3.1 产前诊断及漏诊 尽管CDH的产前诊断率总体上有了显著的改善,但RCDH在产前的检出率似乎低于左侧先天性膈疝(LCDH)[9]。Akinkuotu等[3]研究显示RCDH的产前诊断率为40.3%,明显低于LCDH(73.5%),差异有统计学意义。有研究也显示,RCDH的产前诊断率明显偏低[10],然而也有文献报道,RCDH的产前诊断率高达81.5%[11]。RCDH中产前诊断率低的原因,可能与疝入物的类型相关,LCDH的疝内容物多为胃或肠管,产前超声诊断较容易。而RCDH的疝内容物多为肝脏,由于肝脏回声和肺实质回声相近,产前超声容易漏诊,或者误诊为胸腔占位[12-13]。相比超声检查,MRI 可清晰显示疝入胎儿胸腔的内容物,有助于依据疝入胸腔的内容物对胎儿CDH作出正确诊断。本中心的产前诊断率为52%,与目前大多文献报道的数据相似。75%(9/12)患儿均在产前行磁共振检查,通过磁共振进一步测量了o/eTFLV,依据该指标对其进行严重度分级,2例重度均死亡,7例轻度中1例死亡,这可能说明o/eTFLV对RCDH的预后也是有一定预测价值的,但在轻度病例中有2例需要ECMO支持,或许 LCDH常用的预测指标并不能完全适用于RCDH,的确有研究表明RCDH同LCDH表现不同,使LCDH致命的因素(低o/eTFLV,高容量的肝脏疝)可能不适用于RCDH的胎儿[14]。
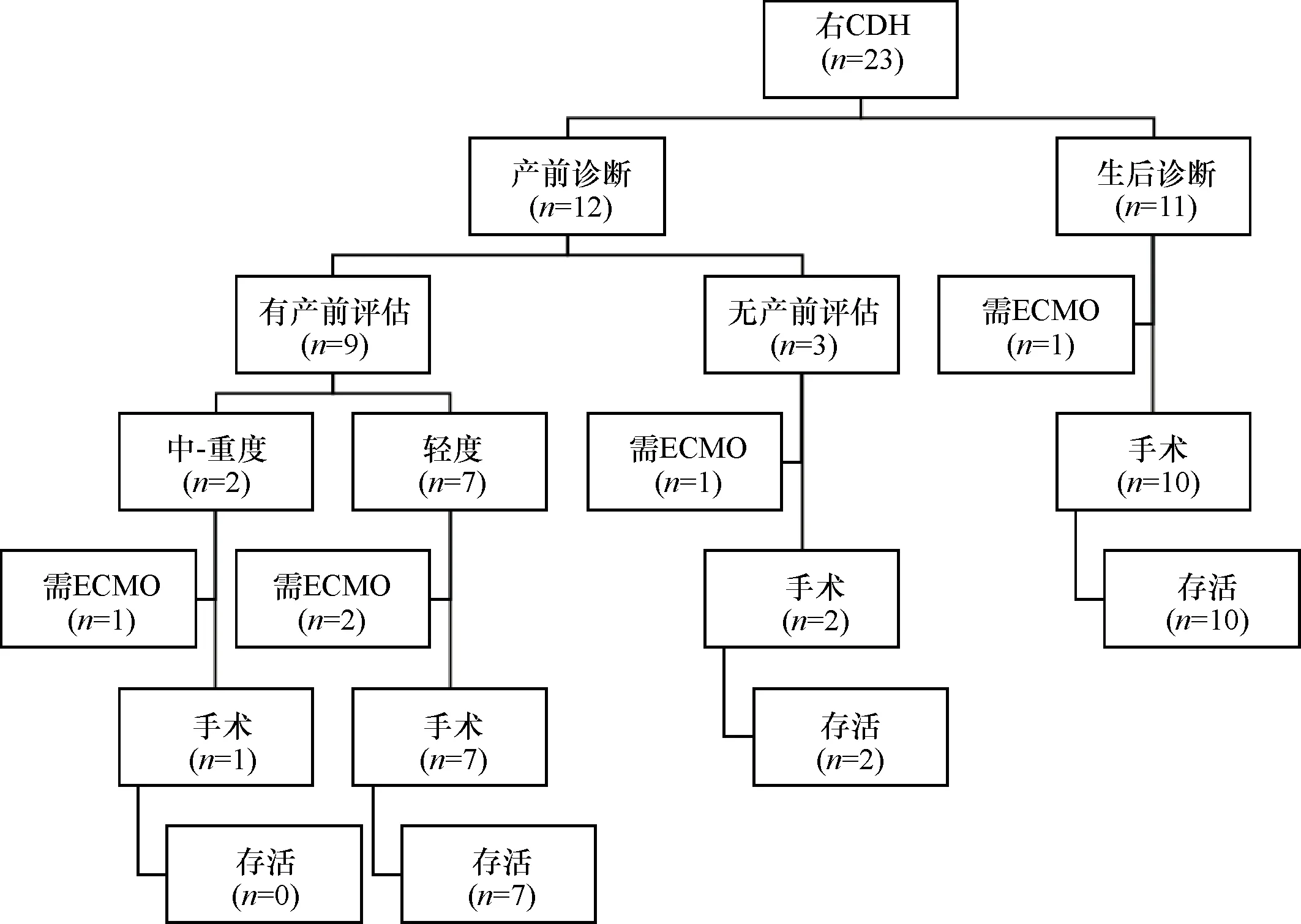
图1 23例RCDH患儿诊治过程
表1 产前诊断组和出生后诊断组临床资料对比
3.2 生后诊断 Jani等[15]回顾分析25年单中心RCDH病例,生后诊断组的生存率明显高于产前诊断组,他们认为可能与产前诊断组往往存在较大的肝脏疝入和明显的肺发育不良有关。本研究中,生后诊断RCDH有11例,占47.8%。生后诊断组生存率为90.9%,比产前诊断组的生存率83.3%稍高。生后诊断组需要ECMO支持的概率为9%(1/11)明显低于产前诊断组33.3%(4/12),虽然差异并没有统计学意义。可能是因为一些严重的右侧膈疝在出生后因无法存活而未进行相关检查来确诊为膈疝,从而导致生后诊断组的患儿总体上其严重程度低于产前诊断组。
3.3 生后治疗 在本研究中,生后即需要气管插管辅助通气的病例有12例,其中8例存活,生存率为66.7%。Midrio等[13]的研究显示,产前诊断的RCDH或生后6 h需要呼吸机辅助的RCDH生存率较低,仅为35.2%。
有学者回顾了其中心10年的CDH病例,其中20.4%为RCDH,RCDH的术后有创通气时间(中位数)为9 d,住院时间(中位数)为41 d,72%合并肺动脉高压,48%需要ECMO支持,平均支持时间为(14.1±5.2)d,以上数据与其中心LCDH相比,差异均无统计学意义[3]。
在国外其他中心的研究中,RCDH患者的ECMO利用率也很高[11,16]。然而也有文献[17]报道,若把患者与胎儿肺容积匹配时,RCHD和LCDH的ECMO使用率是基本一致的,这也许说明,胎儿肺容积可能是CDH患儿生后需要使用ECMO的预测因子。
Duess等[18]报道RCDH手术年龄中位数为5 d,手术需要补片修补的概率为40.6%,但与LCDH的补片使用率比较,并没有统计学差异。本研究中,产前诊断组手术的平均日龄为(5.4±1.3)d,生后诊断组手术的平均日龄(14.5±5.6)d,需补片修补比率为39%,与其他中心的研究结果基本一致。
3.4 预后 近些年,CDH的整体存活率已经显著提高,但大多数研究表明,RCDH的病死率仍较高,这可能与较低的产前诊断率和较大的相对肺发育不全有关,因为右肺占总肺容积的比例更大[19]。然而也有文献报道其中心的RCDH存活率为76%,并不低,而且与其之前报道[11]的 LCDH的总生存率相似。本研究中的存活率较高(83%),原因首先可能是在产前诊断的病例中中-重度仅占2例,并且本中心的产前诊断率并不低,可以做出较为合理的围产期复苏策略。
虽然部分CDH患儿随着术后肺发育成熟而未表现出呼吸系统异常,但部分患儿术后在婴幼儿期及儿童期早期常常反复发生呼吸道感染, 影响生活质量[20]。有研究显示,超过50%的CDH患儿术后存在慢性肺部疾病[21]。而产前MRI可通过测量o/eTFLV和肝脏疝入百分比预测CDH肺疾病的发病率,o/eTFLV<35%和肝脏疝入百分比>20%与长期肺后遗症指标高度相关[22]。国内也有研究提示,右侧膈疝和肝脏疝入可能是影响CDH患儿术后肺功能异常的主要危险因素[21]。
本研究病例数较少,仅来源于单个医院,存在一定局限性,在接下来的研究中会继续增大样本量,进一步探讨RCDH的临床特点。因RCDH的发病率低,因此对RCDH的研究及报道有限,但结合国内外现有的报道来看,RCDH的产前诊断中仍存在漏诊误诊,缺乏有效的肺发育评估指标,生存率有所提高,总体预后可期。

