茶树油提取物粉对大鼠免疫功能的影响
陈 昕,韩玲玲,韦芊含,朱新宇,陈 新,3,张雨梅,3
(1.扬州大学兽医学院,江苏 扬州 225009 ; 2.无锡市晨芳生物科技有限公司,江苏 无锡 214000;3.江苏省动物重要疫病与人兽共患病防控协同创新中心,江苏 扬州 225009)
茶树油(Tea tree oil,TTO)是从桃金娘科白千层叶中提取的无色至淡黄色油状液体,具有怡人的芳香。茶树油的成分有松油烯-4-醇、1,8-桉叶素、对伞花烃等,其中发挥抑菌作用的主要是松油烯-4-醇。研究报道,松油烯-4-醇具有抗菌谱广、抗菌活性强、抗病毒的特点。其机制在于破坏细菌的细胞膜,改变细胞形态学结构[1-3],阻止病毒进入宿主细胞[4]。有研究发现,正是松油烯-4-醇的抗炎活性在其治疗口腔念株菌病中起关键作用[5]。
茶树油在医药、动物生产、洗浴及化妆品等方面具有较多应用。临床中可应用于局部治疗侵袭性真菌感染[6]。饲粮中添加不同剂量的茶树油对育肥猪的生长性能、器官指数和肉品质有不同程度的影响,其中基础饲粮中添加200 mg/(kg·bw)茶树油对育肥猪生长性能和肉质的改善效果较好[7]。王淑楠等[8]报道茶树油可作为饲料添加剂促进断奶仔猪生长、降低腹泻,促进肝脏和胸腺的发育,在一定程度上可替代抗生素类饲料添加剂。但茶树油促进动物生长的机制目前尚不清楚。茶树油提取物粉是从澳洲茶树油原油中提取的新产品,拟作为饲料添加剂用于畜禽生产,本试验探讨茶树油提取物粉对大鼠的免疫作用影响,可增加对茶树油提取物粉作用机制的了解,为该产品作为饲料添加剂的临床应用提供理论依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 Wistar大鼠,体重180~200 g,雌、雄各半;豚鼠,体重250~300 g,由扬州大学比较医学中心提供。动物生产许可证号为SCXK(苏)2017-0004,使用许可证号为SYXK(苏)2017-0044。饲喂经60Co照射饲料,环境温度为(24±2)℃,湿度为(60±20)%,饮水为符合城市饮用水标准的自来水。试验开始前于试验环境中适应3 d,灌胃前禁食12 h,自由饮水。
1.1.2 试验药品 20%茶树油提取物粉,批号20160922,由江苏无锡晨芳生物技术公司提供。
1.1.3 主要试剂及配制 大鼠淋巴细胞分离液、MTT,均购自生工生物工程(上海)股份有限公司;用pH 7.2~7.4的PBS配成5 mg/mL的MTT溶液,微孔滤器过滤除菌,现配现用。RPMI 1640培养基、胎牛血清,均购自HyClone公司。100×青霉素链霉素溶液,购自碧云天生物技术有限公司。RPMI 1640完全培养液:于200 mL RPMI 1640培养基中加入100×青霉素链霉素溶液2 mL和胎牛血清20 mL。 刀豆蛋白A Ⅳ(ConA,Ⅳ),购自Sigma公司;10 μg/mL ConA用RPMI 1640完全培养液配制,0.22 μm微孔滤器过滤除菌,现配现用。
1.1.4 主要仪器 多功能酶标仪,美国Bio Tek公司;Leica倒置显微镜,德国Leica公司;可调微量移液器,日本Nichiryo公司;岛津UV-2600型紫外-可见光分光光度计;CELL-DYN3700全自动血细胞分析仪,美国雅培公司;Unicel Dxc 800型全自动生化分析仪,美国Becokman公司。
1.2 方法
1.2.1 大鼠急性毒性试验 根据预试验结果,茶树油提取物粉剂量达5 000 mg/(kg·bw)时,大鼠未出现死亡。根据急性毒性试验技术规范,对茶树油提取物粉进行最大给药量试验。
大鼠10只,雌、雄各半,以0.8 mL/(100 g·bw)给药容积灌胃,剂量为5 000 mg/(kg·bw)。连续观察2周,并记录动物中毒症状及死亡情况。
1.2.2 试验分组 Wistar大鼠,随机分成4组,每组10只,雌、雄各半。试验组分组为茶树油提取物粉高剂量875 mg/(kg·bw)、中剂量175 mg/(kg·bw)、低剂量组35 mg/(kg·bw),1%羧甲基纤维素钠为对照组。茶树油提取物粉以1%羧甲基纤维素钠溶液配制成混悬液,灌胃给予,连续10 d。
1.2.3 大鼠脏器指数测定 将大鼠处死,称重,取出肝脏、脾脏和胸腺,分别称重,计算肝脏指数、脾脏指数和胸腺指数。
脏器指数=脏器重量(mg)/大鼠体重(g)×100%
1.2.4 腹腔巨噬细胞吞噬活性的测定 大鼠灌胃10 d 后,于第11天,向大鼠腹腔内注射RPMI 1640营养液5~8 mL,轻捏大鼠腹部,抽取部分腹腔洗液,1 000 r/min离心10 min,弃上清;沉淀用RPMI 1640营养液洗涤、悬浮,离心;将沉淀定容至1 mL,细胞计数。将细胞浓度稀释至2×106~ 5×106个/mL,100 μL/孔铺至96孔细胞培养板,每个样本6个重复,于37 ℃、5%CO2培养4 h后加入MTT溶液10 μL/孔,继续培养1 h后加入10% SDS-0.04 mol/L HCl 液10 μL/孔,2 h后以双蒸水调零,在酶联检测仪上读取OD570 nm值。将试验组与对照组OD值比评价巨噬细胞吞噬活性。
1.2.5 血清溶血素含量测定 首先制备补体溶液和鸡红细胞悬液。取2只豚鼠血清混合,用生理盐水稀释10倍,即为10%的补体溶液。采取未免疫鸡的翼下静脉血,与等量抗凝剂混匀。离心后弃去上清,加PBS适量,洗涤离心3次(前2次1 500 r/min离心5 min、第3次2 000 r/min离心8 min),所得的红细胞用PBS稀释20倍,即成5%的鸡红细胞悬液。
于灌胃第7 天,每只大鼠腹腔注射0.2 mL 的5%鸡红细胞进行免疫,免疫后7 d,眼眶下静脉采血、离心,取血清用生理盐水稀释100倍。取稀释血清1 mL与5%鸡红细胞悬液0.5 mL混合,在低温下加10%补体0.5 mL,37 ℃恒温水浴箱中保温30 min 后,在0 ℃冰箱中止反应,离心,取上清液于分光光度计上540 nm处测定吸光度(OD)值[9-10]。另设不加血清的空白对照,作为分光光度测定的调零。
1.2.6 脾淋巴细胞增殖的测定 各组5只大鼠进行无菌取脾,将取下的脾剪成碎块并研磨,过200目不锈钢网,用RPMI 1640完全培养液制成单细胞悬液。在10 mL离心管中加入3 mL大鼠淋巴细胞分离液,然后小心加入单细胞悬液,悬于大鼠淋巴细胞分离液上层,1 200 r/min 离心25 min后,收集中间云状薄层即脾淋巴细胞。分离到的脾淋巴细胞再用RPMI 1640完全培养液洗涤离心(1 000 r/min 离心25 min)3次,用台盼蓝据染法检测活性,活细胞率>95%时,方可用于淋巴细胞转化试验。
以RPMI 1640完全营养液将淋巴细胞浓度稀释至2×106~5×106个/m L,转移至96孔细胞培养板,100 μL /孔,阴性对照孔加入RPMI 1640完全培养液100 μL;加入50 μL ConA液(相当于5 μg/mL)。放入体积分数5% CO2,37 ℃细胞培养箱培养48 h。培养至44 h时每孔加入5 mg /mL MTT溶液10 μL,继续培养4 h;3 000 r/min离心10 min,弃掉上清,每孔加入100 μL DMSO。在酶联检测仪上读取OD570 nm值,按以下公式计算刺激指数SI。
刺激指数(SI)=试验孔OD值/阴性对照孔OD值

2 结果
2.1 大鼠急性毒性试验 5 000 mg/(kg·bw)剂量的茶树油提取物粉给予大鼠后,大鼠精神状态均良好、毛色光洁、活动自如,呼吸、饮食欲、粪便正常,口鼻内无异常分泌物,亦未发现与给药相关的异常反应,无动物死亡。第14天后,对所有动物进行剖检,未见明显的眼观异常。茶树油提取物粉对大鼠经口LD50>5 000 mg/(kg·bw)。根据世界卫生组织(WHO)对化学物急性毒性分级标准,茶树油提取物粉属于实际无毒级别。
2.2 茶树油提取物粉对大鼠免疫功能的影响
2.2.1 脏器指数比较 不同剂量茶树油提取物粉对大鼠免疫器官指数的影响见表1。由表1可以看出,与对照组相比,茶树油提取物粉3个剂量组的脾脏指数显著升高,35 mg/(kg·bw)和175 mg/(kg·bw)剂量组对大鼠脾脏指数的影响极显著(P<0.01);875 mg/(kg·bw)剂量组对脾脏指数的影响显著(P<0.05)。875 mg/(kg·bw)组大鼠的肝脏指数极显著增加(P<0.01),35 mg/(kg·bw)和175 mg/(kg·bw)剂量组差异不显著(P>0.05)。茶树油提取物粉3个剂量组胸腺指数无显著性差异(P>0.05)。

表1 茶树油提取物粉对大鼠免疫器官指数的影响Table 1 Effect of tea tree oil extract powder on immune organ index of rats (%)
2.2.2 腹腔巨噬细胞吞噬活性比较 不同剂量茶树油提取物粉对大鼠巨噬细胞吞噬活性的影响结果见表2。由表2可以看出,与对照组相比,茶树油提取物粉3个剂量组巨噬细胞的吞噬活性显著提高,35 mg/(kg·bw)剂量组差异显著(P<0.05);175 mg/(kg·bw)和875 mg/(kg·bw)剂量组差异极显著(P<0.01)。茶树油提取物粉3个剂量组巨噬细胞的吞噬活性分别是对照组的1.4、1.6倍和1.8倍。
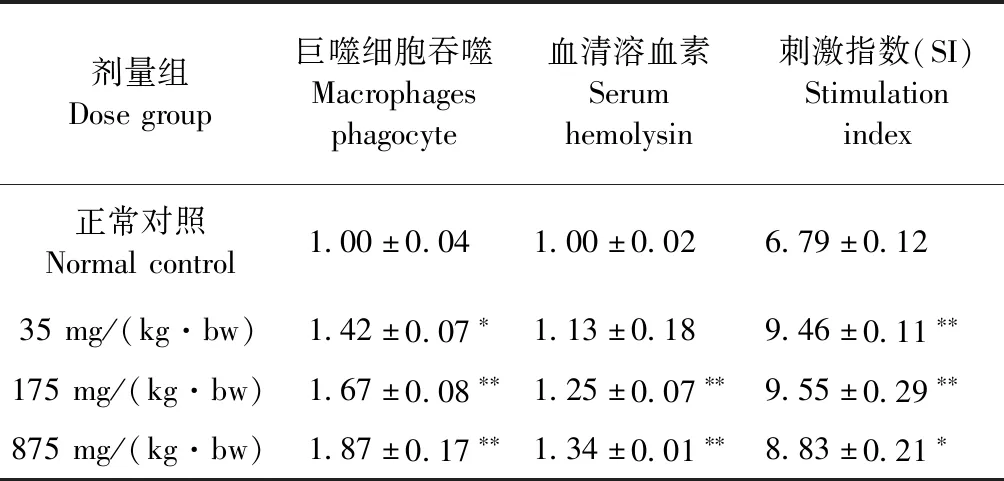
表2 茶树油提取物粉对大鼠巨噬细胞吞噬活性、血清溶血素和淋巴细胞增殖的影响Table 2 Effects of tea tree oil extract powder on macrophage phagocytosis,serum hemolysin and proliferation of spleen lymphocytes on rat
2.2.3 血清溶血素含量比较 血清溶血素能反应机体的体液免疫。不同剂量组茶树油提取物粉对大鼠血清溶血素的影响结果见表2。可知茶树油提取物粉3个剂量组血清溶血素均增加,175 mg/(kg·bw)和875 mg/(kg·bw)剂量组极明显增加(P<0.01),但35 mg/(kg·bw)剂量组与对照组相比无明显差异(P>0.05)。
2.2.4 脾淋巴细胞增殖比较 脾淋巴细胞增殖和分化是机体免疫应答的一个重要阶段。不同剂量组茶树油提取物粉对大鼠脾淋巴细胞增殖的试验结果见表2。由表2可以看出,与对照组相比,茶树油提取物粉3个剂量组对大鼠脾淋巴细胞SI显著增加,35 mg/(kg·bw)和175 mg/(kg·bw)剂量组差异极显著(P<0.01),且35 mg/(kg·bw)和175 mg/(kg·bw)剂量组的大鼠脾淋巴细胞增殖是对照组的约1.4倍;而875 mg/(kg·bw)剂量组差异显著是对照组的约1.3倍(P<0.05)。
3 讨论
茶树油提取物粉经口LD50>5 000 mg/(kg·bw),根据世界卫生组织(WHO)对化学物急性毒性分级标准,茶树油提取物粉属于实际无毒级别。
茶树油提取物粉可显著增加脾脏指数、增强腹腔巨噬细胞吞噬活性和脾淋巴细胞增殖、增加血清溶血素水平,表明茶树油提取物粉对大鼠免疫功能具有明显的增强作用,可为茶树油作为饲料添加剂在畜禽生产中的使用提供依据。但茶树油提取物增强免疫的机制还有待进一步深入研究。
机体免疫系统主要由免疫器官、免疫组织、免疫细胞及免疫分子等组成,可分为特异性免疫和非特异性免疫两大类。而特异性免疫又分为细胞免疫和体液免疫。如糖尿病、类风湿性关节炎、慢性肝病等都与机体免疫系统有很大的关联。
脏器指数可在一定程度上反应脏器功能的强弱[11]。茶树油作用于多种免疫活性细胞,可引起免疫球蛋白和细胞因子谱的改变,未影响肝、肾功能[12]。本试验中,与对照组相比,茶树油处理组的肝脏指数和脾脏指数明显提高,表明茶树油可在一定程度对机体肝脏和脾脏的生长有促进作用。可能与茶树油富含萜烯类等多种活性成分有关,这些成分具有促进细胞代谢和免疫作用。
巨噬细胞在固有免疫和适应性免疫反应中具有重要作用,是主要的炎性反应调节细胞,在炎性反应过程中分泌细胞因子、趋化因子等,参与各种炎症性疾病过程[13]。大鼠的巨噬细胞吞噬试验表明,茶树油提取物粉处理组巨噬细胞吞噬功能增强,并促进脾淋巴细胞的转化,提高分泌细胞因子,最终增强机体的免疫功能[14]。
血清溶血素是B淋巴细胞受到外来抗原(鸡红细胞)刺激后,产生的一种抗体[15],能间接反应体液免疫的功能状态。本试验发现,茶树油提取物粉的中、高剂量组对大鼠的血清溶血素有着极显著提高作用,茶树油提取物粉对大鼠的体液免疫有着促进作用。
脾脏是成熟淋巴细胞定居场所,与细胞免疫和体液免疫都密切相关。而脾免疫活性细胞的增殖,尤其是淋巴细胞的增殖是其免疫功能增强的重要基础。本体外试验结果表明,茶树油提取物粉具有明显诱导体外培养大鼠脾淋巴细胞增殖的作用。

