氨肽酶基因anp-1在秀丽隐杆线虫生长发育中的生物学功能
苏山春,汪 明
(中国农业大学动物医学院,北京 海淀 100193)
氨肽酶是一类外切蛋白酶,广泛参与调控生物体的多肽修饰、蛋白质转运、细胞周期发育、信号转导等一系列生理过程[1]。根据同源性和催化机制,氨肽酶可以分为12个家族。嘌呤霉素敏感氨肽酶1(Purinomycin-sensitive aminopeptidase 1,Pam-1)是M1氨肽酶家族的成员,Pam-1 突变破坏了减数分裂和有丝分裂染色体的有效分离以及胚胎早期极性决定因素的不对称定位,最终阻碍胚胎活力和整体孵化率[2]。包括Pam-1在内,秀丽隐杆线虫(Caenorhabditiselegans,C.elegans)中有17个基因编码氨肽酶。RNA干扰敲低Y67D8C.9、T16G12.1和T12E12.6等氨肽酶基因的表达水平,导致C.elegans产卵总数降低,而抑制C42C1.11、R03G8.4、ZC416.6和ANP-1等氨肽酶的表达,C.elegans产卵总数无显著降低[3]。系统进化分析结果显示,ANP-1、C42C1.11、R03G8.4、ZC416.6与Y67D8C.9、T16G12.1和 T12E12.6位于不同的进化分支,它们在C.elegans生长发育中可能发挥着不同的生物学功能。GFP报告基因结果表明,ANP-1在C.elegans肠道、咽部、尾部神经元和其他分泌细胞均表达[4],推测anp-1基因在C.elegans生长发育中具有其他生物学功能。
RNA干扰(RNA interference,RNAi)是由双链RNA诱导的特异基因沉默现象。C.elegans以细菌为食物,因此,在C.elegans基因功能研究中,通过饲喂表达双链RNA的细菌沉默特定基因是一种有效的策略[5-7]。本试验通过构建anp-1 RNAi菌株,饲喂C.elegans,观察分析C.elegans表型变化,初步揭示氨肽酶基因anp-1在C.elegans生长发育中的生物学功能。
1 材料与方法
1.1 主要材料和试剂E.coliHT115(DE3)菌株和DH5α-L4440菌株由河北大学柳峰松教授馈赠,由本实验室冻存。质粒小量提取试剂盒(DP103,离心柱型)和PCR产物回收试剂盒(DP204),均购自天根生化科技有限公司;TransScript II Green One-Step qRT-PCR Super Mix,购自北京全式金生物技术有限公司(TransGen Biotech);TRIzol,购自Life Technologies Corporation;TaqDNA Polymerase和T4 DNA Ligase,均购自大连宝日医生物技术有限公司(TaKaRa);限制性内切酶XbaⅠ和Hind Ⅲ,购自NEB公司;DNA Marker和Gold View,均购自中科瑞泰生物科技有限公司;琼脂粉、蛋白胨、胰蛋白胨、酵母粉、异丙基-β-D-硫代半乳糖苷(Isopropyl-β-D-thiogalactopyranoside,IPTG)和氨苄青霉素(Ampicillin,Amp)等试剂为进口分装产品;5-氟脱氧尿苷(5-fluorodeoxyuridine,5-FUDR),购自SIGMA-ALDRICH公司;其他常规试剂均为国产分析纯。
1.2anp-1 RNAi载体构建 根据anp-1(WBGene-00011587)全长序列设计特异性引物,序列如下:anp-F:5′-TGCTCTAGACACTTCGTACTGACATGTCGG-3′;anp-R:5′-CCCAAGCTTTCCATAGCACCAGCTGAGAA-G-3′,预测产物大小为499 bp。斜体为保护碱基,斜体下划线为酶切位点:上游XbaⅠ;下游:Hind Ⅲ。按照 TRIzol 说明书提取混合生长期C.elegans总 RNA,反转录后收集 cDNA作为模板进行PCR。反应程序如下:94 ℃ 5 min;94 ℃ 30 s,56 ℃ 45 s,72 ℃ 35 s,30 个循环;72 ℃延伸 10 min,16 ℃保温。PCR产物经琼脂糖凝胶电泳鉴定,并用PCR产物回收试剂盒收集。上述回收的PCR产物经XbaⅠ和Hind Ⅲ双酶切后,克隆到L4440质粒。菌落PCR鉴定的HT115-L4440-anp-1阳性克隆送至生工生物工程(上海)股份有限公司进行测序。测序正确的单克隆-80 ℃冻存备用。
1.3C.elegans食物准备 从-80 ℃冰箱取出冻存的E.coliOP50、HT115-L4440(空载体)和HT115-L4440-RNAi菌株,快速解冻,分别取50 μL加入到新鲜的LB液体培养基中(有抗性的菌加入氨苄青霉素100 μg/mL),做好标记,37 ℃、200 r/min培养12~16 h进行活化。取活化好的细菌培养物3 mL, 滴加到线虫生长基质(Nematode growth media,NGM)培养基上(含或不含IPTG 和Amp),用无菌L棒涂布,正置静置至液体被完全吸收,做好标记,倒置,37 ℃恒温箱静置培养12~16 h,菌苔即可作为食物用于饲喂C.elegans。
1.4C.elegans同步 参考Yu等[8]报道的方法进行C.elegans虫卵同步化处理。将裂解虫体得到的虫卵用适量的M9 Buffer重悬,加入到50 mL三角瓶中,加入15 mL M9 Buffer,将三角瓶置于摇床,37 ℃ 200 r/min孵育16~20 h。吸取少量的溶液,显微镜下观察孵育到L1期幼虫的数量。将三角瓶取出,将培养基转移至50 mL离心管中,静置,使L1期幼虫沉降,尽量吸取上清并弃去,用适量的M9 Buffer重悬L1期幼虫。根据饲喂菌株的不同将同步的L1期幼虫分为4个试验组,分别为E.coliOP50组、HT115-L4440(未经IPTG诱导)组、HT115-L4440(1 mmol/LIPTG 诱导)组和HT115-L4440-anp-1组,在文中分别用OP50、IPTG 0 mmol/L、IPTG 1 mmol/L和RNAi表示。
1.5C.elegans总产卵数计数、体长和寿命分析 将同步的L1期幼虫分别置于不同菌株的9 cm NGM培养基上(含或不含抗生素和IPTG),做好标记,20 ℃ 恒温箱静置培养48 h左右至L4期幼虫。用酒精灯灼烧的挑虫针调取1条L4期幼虫转移至新的3 cm NGM培养基上(含或不含IPTG和抗生素),每8 小时转移1次,转移到新的3 cm NGM培养基上,直到不再产卵,统计每条C.elegans的总产卵数,分析结果。每组10条L4期幼虫,试验重复3次。用酒精灯灼烧的挑虫针调取30条L4期幼虫转移至滴加有叠氮钠(50 μL 20 mmol/L)的载玻片,室温静置,使C.elegans虫体僵直,Ziss Discovery v12拍摄照片,用显微镜自带软件测量C.elegans虫体长度,统计分析结果。试验重复3次。用酒精灯灼烧的挑虫针调取50条L4期幼虫转移至新的涂布不同菌株的9 cm NGM培养基上(含有5-氟脱氧尿苷,含或不含抗生素和IPTG),每12 小时观察1次,将死亡的C.elegan移除。每24 小时将活着的C.elegans转移至新的NGM培养基上,直到C.elegans全部死亡。C.elegans死亡判断标准:挑虫针轻轻触碰虫体无反应。试验完成后统计并绘制死亡曲线。试验重复3次。
1.6 荧光定量PCR 选取在C.elegans寿命调节中发挥重要作用的基因 (daf-2、age-1、daf-16、daf-28、glp-1、unc-62、ins-1和ins-7),利用Primer Primer 5设计特异性引物。引物序列见表1。荧光定量PCR反应程序如下:50 ℃ 5 min;94 ℃ 30 s,94 ℃ 5 s,60 ℃ 10 s,72 ℃ 10 s,40个循环;95 ℃ 10 s,65 ℃ 60 s,97 ℃ 1 s。以GAPDH为内参,采用2—△△CT法计算不同基因在以不同细菌为食物的C.elegans中的相对表达量。
1.7 数据统计与分析C.elegans体长、总产卵数和生存曲线数据采用GraphPad Prism 5软件统计分析。试验数据用平均值±标准差(Mean±SD)表示。体长、总产卵数和不同饲喂组mRNA相对表达量采用单因素方差分析(One-way analysis of variance,ANOVA)进行统计学分析。C.elegans生存曲线采用log-rank 法(Mantel-Cox)进行统计学分析。
2 结果
2.1 RNAi沉默anp-1基因效率验证 菌落PCR琼脂糖凝胶电泳结果表明,成功构建HT115-L4440-anp-1 RNAi菌株(图1A)。为了验证anp-1沉默效率,提取以不同株细菌为食物的L4期C.elegans的总RNA,逆转录后进行荧光定量PCR试验。结果显示,RNAi 组anp-1基因mRNA相对表达量比OP50组减少了约85%,差异极显著(P<0.001)(图1B),表明构建的RNAi菌株可以用于后续的anp-1基因沉默试验。
2.2 RNAi 敲低anp-1基因导致C.elegansN2株总产卵数(Brood size)变化 为了观察沉默anp-1基因对C.elegans总产卵数的影响,分别以E.coliOP50、HT115-L4440(未经IPTG诱导)、HT115-L4440(1 mmol/L IPTG诱导)和HT115-L4440-anp-1(1 mmol/L IPTG诱导)菌株饲喂野生型C.elegans,每天将C.elegans转移到新的NGM平板上,直到其不再产卵,记录并统计总产卵数(n=10):OP50组为203±30;IPTG 0 mmol/L组为213±33;IPTG 1 mmol/L组为210±26;RNAi组为169±32。图2可见,抑制anp-1基因表达,C.elegans总产卵数减少,但与OP50组无统计学差异(P>0.05)。

表1 荧光定量PCR引物Table 1 Primers for real-time PCR
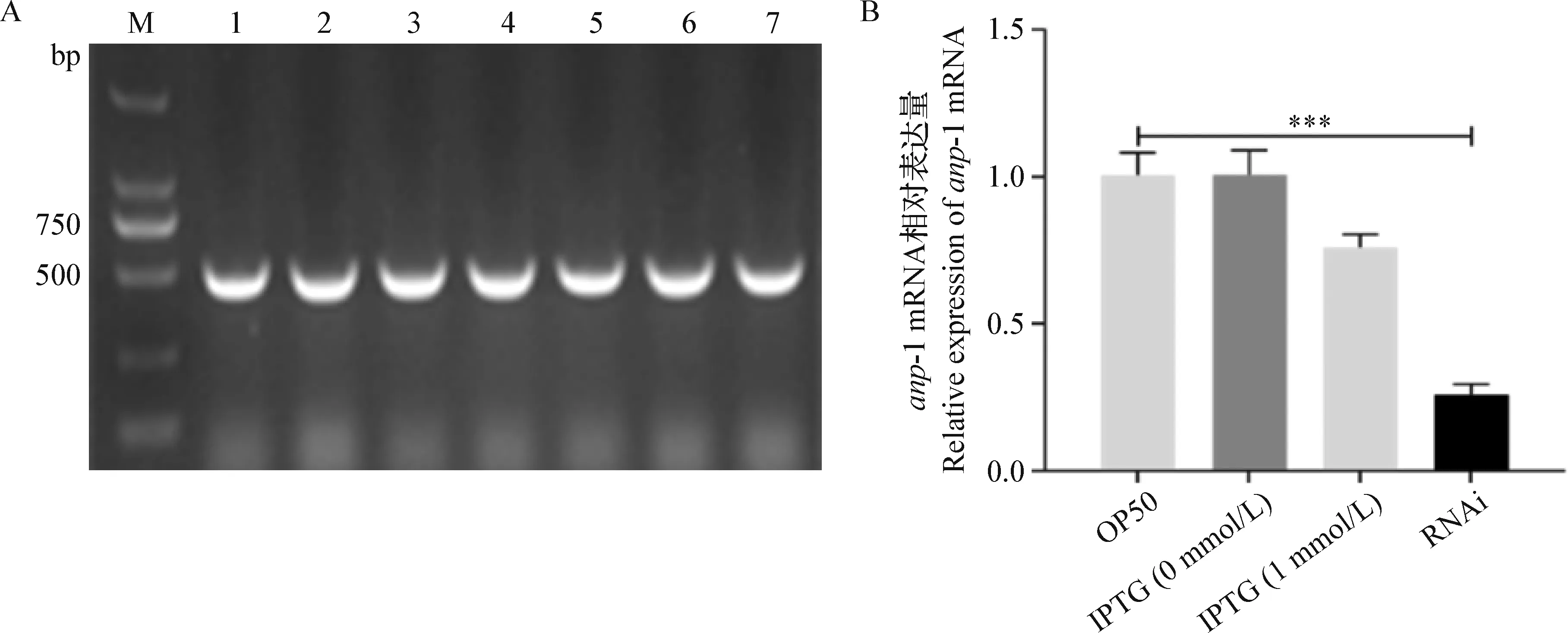
图1 anp-1 RNAi阳性克隆鉴定及其干扰效率验证Fig.1 Identification of anp-1 RNAi clone and RNAi efficiencyA:M:DL-2 000 DNA marker; 1~7:anp-1 RNAi 克隆鉴定琼脂糖凝胶电泳结果; B:qRT-PCR验证anp-1基因沉默效率***:P<0.001; 下图同A:M:DL-2 000 DNA marker; 1~7:Agarose gel electrophoresis analysis of anp-1 RNAi clone; B:Identification of RNAi efficiency using qRT-PCR***: P<0.001. The same as below
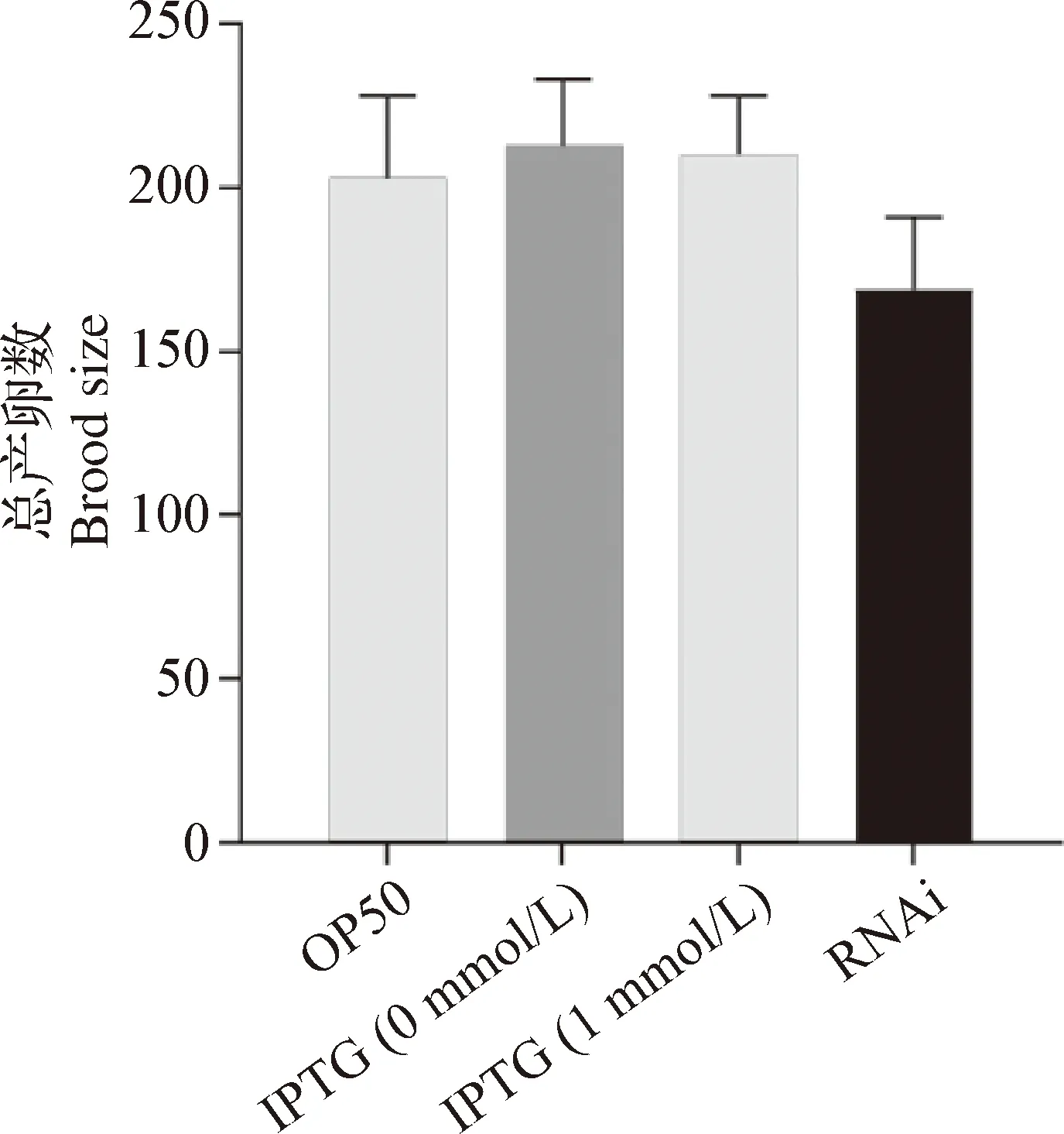
图2 RNAi沉默anp-1导致C. elegans N2株产卵数变化Fig.2 Knocked down anp-1 gene using RNAi changed the brood size of C. elegans N2 strain
2.3 沉默anp-1基因导致C.elegansN2株体长(Body zise)变化 以不同细菌为食物饲喂同步的C.elegansL1期幼虫,测定其生长至L4期(或青年成虫期)的体长(n=50),验证沉默anp-1基因对C.elegans生长发育的影响。结果显示:OP50 组体长为(627.2±44.5)μm;IPTG 0 mmol/L组、IPTG 1 mmol/L组和RNAi组体长分别为(653.2±46.8) μm、(667.8±31.6)μm 和(573.7±39.7)μm。ANOVA分析表明,OP50 组L4期幼虫体长大于RNAi 组,差异极显著(P<0.001)(图3)。
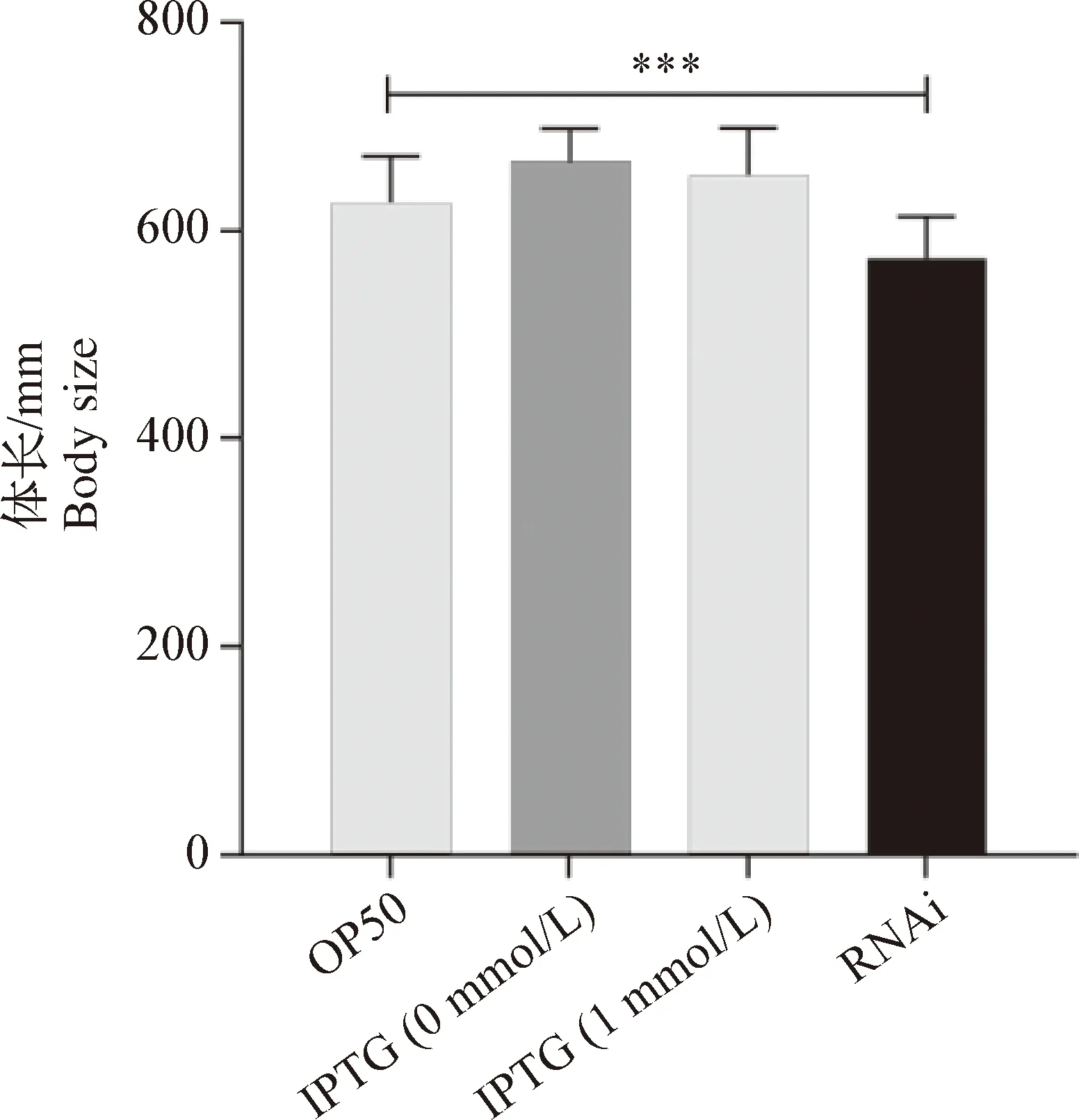
图3 RNAi沉默anp-1导致C. elegans N2株L4期幼虫体长变化Fig.3 Knocked down anp-1 gene using RNAi changed the body size of C. elegans N2 strain (L4 larve)
2.4 RNAi沉默anp-1基因导致C.elegansN2株寿命(Lifespan)变化 挑取同步的L1期C.elegans幼虫50条置于长有不同菌苔的NGM(3 cm,含或不含抗生素和IPTG)平皿上,每天观察记录并移走死亡的C.elegans,直到所有C.elegans死亡,统计死亡率并绘制生存曲线。各个组的死亡中位数(Median survival)分别为OP50 组18 d,IPTG 0 mmol/L组20 d,IPTG 1 mmol/L组18 d,RNAi 组 16 d。统计分析结果显示,与OP50 组相比,RNAi组的死亡中位数时间减少了11%,差异极显著(P<0.001)(图4)。
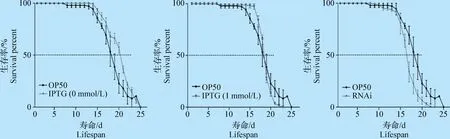
图4 RNAi沉默anp-1导致C. elegans N2株寿命变化Fig.4 Knocked down anp-1 gene using RNAi changed the lifespan of C. elegans N2 strain
2.5C.elegans寿命调节相关基因表达量变化 沉默anp-1基因导致C.elegans寿命显著缩短,为探究anp-1基因与寿命调控相关基因之间的调控关系,选取在C.elegans寿命调控中发挥重要作用的相关基因,例如daf-16、daf-2、daf-28、age-1等进行荧光定量PCR试验。如图5所示,沉默anp-1基因,daf-2和daf-28基因的相对表达量在RNA干扰组和OP50组无显著差异(P>0.05);RNAi组age-1基因的相对表达量显著上调(P<0.05);RNAi组daf-16基因相对表达量显著下调(P<0.05)。
此外,还选取肠道调控基因以及其他信号通路中可能受到肠道基因调控的基因,验证沉默anp-1基因后其表达量变化。荧光定量PCR结果表明(见图5),沉默anp-1基因,ins-1和glp-1基因的相对表达量在RNAi组和OP50组无显著差异(P>0.05);ins-7基因在RNAi组相对表达量显著下调(P<0.05);unc-62基因在RNAi组相对表达量显著上调(P<0.05)。
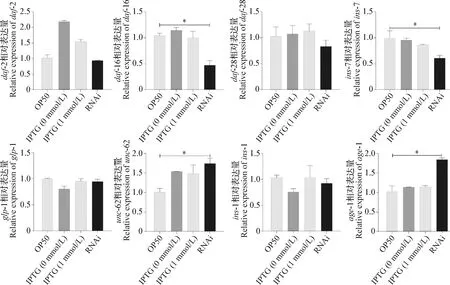
图5 RNAi 沉默anp-1介导的寿命调节相关基因表达量变化Fig.5 Knocked down anp-1 gene using RNAi changed relative expression of genes regulating longevity*:P<0.05
3 讨论
氨肽酶在C.elegans等生物体生长发育中发挥着重要作用[9]。Joshua G W等和 Malagon D等分别报道了氨肽酶在C.elegans和其他线虫中的生长、食物消化、蜕皮等生理过程中的功能[9-12]。先前的研究多聚焦于C.elegans氨肽酶家族在生殖中的作用。本试验中,沉默anp-1基因后,C.elegans总产卵数无显著降低,说明anp-1基因可能不参与C.elegans生殖过程调节,这与前人报道的结果一致[3]。
本试验体长分析结果表明,沉默anp-1基因导致C.elegansL4期幼虫体长显著变短。ANP-1是PAM-1的同源蛋白,PAM-1参与C.elegans肠道细胞对多肽的摄取,有研究表明氨肽酶P(Aminopeptidase P,APP)和 亮氨酸氨肽酶(Leucine aminopeptidase,LAP)也可能与PAM-1有同样的功能[9,13-15]。因此,推测沉默anp-1基因导致C.elegans消化和吸收障碍,从而造成C.elegans发育缓慢。
C.elegans胰岛素/胰岛素样生长因子(Insulin/IGF-1 signaling,IIS)信号通路跟代谢、生长发育、长寿、“dauer”期形成、天然免疫和行为密切相关[16]。IIS信号通路相关基因突变会介导C.elegans寿命变化。age-1是第1个被鉴定出来的IIS信号通路成员,其突变会延长C.elegans寿命[17]。沉默anp-1基因时,age-1基因 mRNA相对表达量明显上调,表明沉默anp-1基因导致C.elegans寿命缩短有可能是通过激活和上调age-1的表达有关,沉默anp-1基因导致C.elegans寿命缩短的机制需要更深入的研究。
此外,沉默anp-1基因导致C.elegans寿命缩短有可能是通过调控胰岛素样多肽(Insulin-like peptides,ILPs)的表达。ILPs调控C.elegans“dauer”期形成、长寿以及发育。对daf-28、ins-1和ins-7等ILPs的研究已经深入到一定程度,但是其在C.elegans生长发育中的功能仍不明了[16]。unc-62是ILPs其中一员,其主要在C.elegans肠道发挥功能并调节C.elegans寿命,RNAi沉默unc-62导致大量C.elegans肠道基因上调并缩短C.elegans寿命[18]。本试验中,沉默anp-1基因导致unc-62基因上调,表明anp-1基因有可能受到UNC-62转录因子的调控。但目前未见关于氨肽酶与ILPs调控的相关报道,因此,深入研究anp-1与ILPs的相互关系,有助于进一步阐明ILPs参与调节C.elegans寿命的机制,并为揭示氨肽酶基因anp-1在C.elegans生长发育中的生物学功能提供参考。

