广谱拮抗菌株的筛选诱变及抗菌物质分离鉴定
高兆建,王秋芬,丁飞鸿,许 祥,赵宜峰,焦 魏,陈 腾,*
(1.徐州工程学院食品(生物)工程学院,江苏 徐州 221018;2.海滨林场,河北 秦皇岛 066100;3.长江桂柳食品睢宁有限公司,江苏 徐州 221000;4.邳州市金大地肥料有限公司,江苏 徐州 221300)
近年来,化学农药和传统抗生素及防腐剂过量使用带来的食品安全、环境问题以及细菌耐药性问题越来越受关注[1]。对病原菌具有显著抗性的脂肽类抗生素成为人们研究的焦点。芽孢杆菌属的细菌自然界中分布广泛,具有极强的抗逆能力,生长代谢过程中能产生多种抑菌物质[2],如抗菌蛋白、抗菌脂肽和挥发性抑菌物质等,其中部分环脂肽类抑菌物质具有较好的抗菌活性,它是芽孢杆菌通过非核糖体合成途径产生的具有抗菌作用的脂肽类化合物,主要包括表面活性素(Surfactin),伊枯草菌素(Iturin)和芬芥素(Fengycin)3大类[3]。这些脂肽类物质由脂肪酸链和肽环两部分构成,7 个(Surfactin和Iturin)或10 个(Fengycin)α-氨基酸链接到一个独特的β-氨基(Iturin)或β-羟基(Surfactin,Fengycin)脂肪酸链上[3]。这种脂肪酸链的长度不一,Surfactin为C13~C16,Iturin为C14~C17,Fengycin为C14~C18[4]。其特殊的化学结构赋予这些脂肽类抗菌物质具备抗细菌、抗真菌[5]、抗肿瘤、抗病毒[6]、抗支原体、溶血栓等功能,其广谱、高效、低毒、耐热、耐酸、对蛋白酶稳定[7]、不易产生耐药性、易被生物降解等优势使得其在农业[8]、食品[9]、医药、化妆品、环保[10]、畜牧业等[11]领域备受关注[12-13]。因此,继续挖掘新型高效的脂肽类物质,使其充分发挥其多元化的功能,具有重要的科学意义和实际应用价值。
目前,很多研究者致力于芽孢杆菌产生脂肽的研究,已经从植物、土壤、海洋等各种环境中连续筛选出新的产脂肽菌株[14],并从其发酵液中分离出不同结构类型的脂肽化合物。Aktuganov等[15]从爱媛类芽孢杆菌IB-X-b发酵液中鉴定了1 种Fengycin同系物,对麦根腐德氏霉(Drechslera sorokiniana)具有很强的抑菌作用;Cao Yun等[16]发现生防枯草芽孢杆菌SQR 9对抑制尖孢镰刀菌(Fusarium oxysporum)导致的黄瓜枯萎病有显著效果,并通过高效液相色谱和质谱技术从其发酵液中检测到Fengycin和Bacillomycin。Hentati等[17]研究发现海洋细菌同温层芽孢杆菌(Bacillus stratosphericus)FLU5在对石油污染土壤修复中具有重要作用,采用基质辅助激光解析电离飞行时间串联质谱(matrix-assisted laser desorption/ionization time of flight-tandem mass spectrometry,MALDI-TOF-MS/MS)技术确定了菌株分泌的Surfactin的存在。石举然等[9]从野生蜂蜜中筛选出1 株产广谱抗菌活性物质的芽孢杆菌LZ-5,利用柱层析及高效液相色谱等技术确定LZ-5产生的抗菌物质为IturinA2、IturinA3和IturinA6的混合物。
研究表明,不同种属芽孢杆菌分泌的抗菌脂肽类别有显著不同,其抗逆性及生物学功能也会有很大差异[18]。而且,即使是同一类菌株,发酵条件不同,也可能会产生不同结构的环脂肽变异体,进而发挥不同的生物学功能。有关地衣芽孢杆菌所产抗菌物质的研究也有报道,但抗菌特性与本研究有显著差异。本研究从自然界中分离1 株广谱抗性的菌株,进一步通过物理化学复合诱变选育提高抗菌物质产量,并从发酵液中分离纯化抗菌物质,通过质谱分析其可能的与抑菌活性有关的脂肽类化合物组成及成分,以期为抗菌脂肽的研究和应用提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 样品与菌种
本研究筛选土样取自江苏省徐州市云龙区徐州工程学院周边菜地及泉山区云龙山。
供试菌株为本实验室从土样中自行分离的菌株;用于检测抑菌活性的参考菌株部分购自中国普通微生物菌种保藏管理中心,部分由徐州工程学院江苏省重点建设实验室保存,菌种如下:大肠杆菌(Escherichia coliCGMCC 1.1850)、伤寒沙门氏菌(Salmonella typhi)、金黄色葡萄球菌(Staphylococcus aureusCGMCC 1.128)、志贺氏菌(Shigella Castellani,本实验室保存)和铜绿假单胞和芽孢杆菌(Pseudomonas aeruginosaCGMCC 1.1785)、蜡样芽孢杆菌(B. cereus,本实验室保存)、枯草芽孢杆菌(B. subtilis,本实验室保存)、酿酒酵母(Saccharomyces cerevisiaeCGMCC 2.3973)、尖孢镰刀菌(Fusarium cusarium,本实验室保存)、深绿木霉(Trichoderma cerevisiae,本实验室保存)、黑曲霉(Aspergillus nigerCGMCC 3.6469)。
1.1.2 培养基
营养肉汤(nutrient broth,NB)培养基:蛋白胨1 g/100 mL,牛肉膏0.5 g/100 mL,氯化钠0.5 g/100 mL,琼脂粉1.5 g/100 mL,pH 7.2~7.4,121 ℃灭菌15 min,用于指示菌培养。
发酵培养基:葡萄糖4.0 g/1 0 0 m L,牛肉膏0.5%,酵母提取物0.5 g/1 0 0 m L,蛋白胨1.5 g/100 mL,NaH2PO4·2H2O0.02 g/100 mL,Na2HPO4· 2H2O0.05g / 100 mL ,Mg2SO4·7H2O 0.05 g/100 mL,CaCl20.02 g/100 mL,MnSO40.02 g/100 mL,pH 7.4,121 ℃灭菌15 min。
1.2 仪器与设备
Sigma3k15型冷冻离心机 德国Sigma公司;GeneAmp 9700型聚合酶链式反应(polymerase chain reaction,PCR)仪 美国应用生物系统公司;JS-680D型凝胶成像系统 上海培清科技有限公司;1100型高效液相色谱仪 美国安捷伦科技有限公司;QexactiveOrbitrap型高分辨质谱仪 美国Thermo Fisher公司;CascadaTMAN型超纯水系统 美国PALL公司;UV-2450紫外-可见光分光光度计 日本岛津公司。
1.3 方法
1.3.1 菌株筛选
将土样悬浊液80 ℃水浴处理20 min,系列稀释并于NB平板涂布,37 ℃恒温培养2~3 d,将单菌落转接于另一块平板。培养2~3 d后的培养皿,在皿盖中倒入1 mL氯仿,倒扣于超净工作台熏蒸50 min,倒掉多余氯仿并加稀释5 倍的指示菌菌液1 mL,平板全部浸润后倒掉多余菌液,晾干平皿,室温培养12 h后,观察并记录抑菌效果。
初筛得到菌株接种于发酵培养基,37 ℃培养3 d。发酵液经4 ℃、12 000 r/min离心5 min得发酵上清液。分别用大肠杆菌、金黄色葡萄球菌、黑曲霉为指示菌进行抑菌活性复筛,选择抑菌谱最广、抑菌圈最大的菌株进一步研究。
1.3.2 拮抗菌株分类鉴定
参照文献[19]对拮抗菌株进行形态特征观察和生理生化实验。
拮抗菌株16S rDNA序列测定与分析:提取总DNA进行16S rDNA序列PCR扩增。扩增的引物设计如下:上游引物5’-AGAGTTTGATCCTGGCTCAG-3’,下游引物5’-CTACGGCTACCTTGTTACGA-3’。PCR扩增条件:94 ℃预变性5 min;94 ℃变性45 s,55 ℃退火30 s,72 ℃延伸90 s,30 次循环;最后72 ℃延伸10 min。引物的合成和PCR产物的测序由南京金斯瑞生物科技有限公司完成。测序结果运用BLAST软件进行序列比对,选取各不同属的一些代表菌株的16S rDNA序列,用ClustalX1.83与MEGA5.1软件,采用NJ(Neighbor-Joining)法构建系统发育树。
1.3.3 脂肽粗提物抗菌谱的测定
固体培养基打孔琼脂扩散法测定发酵滤液抑菌活性。固体培养基灭菌后倒平板,待其凝固后,加入200 μL活化培养好的指示菌菌液,涂布均匀并晾干后,用无菌打孔器打孔,孔中加入100~200 μL发酵上清液,正面放置,培养1~3 d,观察抑菌效果,并用游标卡尺测量抑菌圈直径,以无菌水作阴性对照。其中细菌选用NB固体培养基,37 ℃恒温培养24 h,真菌选用马铃薯葡萄糖琼脂固体培养基, 28 ℃恒温培养2~3 d,然后观察抑菌圈的有无,并采用十字交叉法测量抑菌圈直径,各处理重复 3 次。
1.3.4 菌株诱变
紫外线-硫酸二乙酯(diethyl sulfate,DES)复合诱变:取对数生长期菌液10 000 r/min离心5 min后,沉淀用生理盐水稀释成浓度为108个/mL的菌悬液。将装有5 mL菌悬液的无菌平皿置于磁力搅拌器上,在实验前打开紫外灯预热10 min,在距离15 W紫外灯30 cm处进行诱变。分别照射6、9、15、30、45 s,每个照射时间各取0.1 mL处理后的菌液涂布于筛选平板上,30 ℃避光培养5 d,将致死率在95%以上平板上的菌株检测抗菌活性。将活性高的菌株选为出发菌株,进一步采用DES化学法诱变。菌悬液加入到体积为25 mL的三角瓶中,再加入0.2 mL体积分数50%的DES溶液,振荡不同时间,再加入0.5 mL 85%的硫代硫酸钠溶液终止反应。取不同梯度的菌悬液稀释涂布平板。37 ℃培养2~3 d。以金黄色葡萄球菌为指示菌,检测菌株抑菌活性,选取抑菌活性最强的菌株。
遗传稳定性实验:为分析突变菌的遗传稳定性,在固体板上活化菌,转移到液体进行一级培养。连续转移10 次,分别发酵培养48 h,然后分析比较突变株抑菌能力的遗传稳定性。
1.3.5 脂肽分离与分析
1.3.5.1 脂肽Sephadex G-10凝胶层析分离
采用酸沉淀法进行提取。诱变获得的优良菌株发酵液4 ℃、10 000 r/min离心10 min后,去除菌体,收集发酵上清液,用6 mol/L盐酸调节pH 2.0,轻微搅动,4 ℃静置24 h后于10 000 r/min离心15 min,收集沉淀,加入甲醇后用1 mol/L NaOH溶液调节pH 7.0,用甲醇抽提沉淀3 次,合并抽提液,于40~45 ℃减压蒸发,得到固体粗提物。
用Sephadex G-10色谱柱对脂肽粗提物纯化。10 mmol/L Tris-HCl缓冲液(pH 8.0)平衡层析柱,固体抗菌物质粗提物缓冲溶液溶解后上Sephadex G-10柱(1.6 cm×100 cm),用相同缓冲液洗脱,流速为0.4 mL/min,自动收集器每管收集0.8 mL。将每管测定其对金黄色葡萄球菌的抑菌活性。
1.3.5.2 脂肽粗提物反相高效液相色谱纯化与鉴定
将经过Sephadex G-10收集到的有抑菌活性的洗脱液用半制备高效液相色谱系统进一步纯化并检测活性物质的纯度,以确保样品的纯度达到结构鉴定的要求。样品上柱前经0.22 μm微孔滤膜过滤,洗脱剂经抽滤装置脱气。高效液相色谱条件:色谱柱Agilent XDB-C18柱;紫外检测器;检测波长215 nm;以体积分数5%~30%的乙腈线性梯度洗脱;柱温25 ℃;流速0.5 mL/min。检测收集管抗菌活性。
利用MALDI-TOF-MS对抑菌活性组分进行分析鉴定,α-氰基-4-羟基肉桂酸基质溶解在含0.1%三氟乙酸的30%乙腈溶液中,采用正离子反射模式获得谱图。
1.4 数据统计分析
2 结果与分析
2.1 广谱拮抗菌株的筛选

表1 筛选菌株发酵上清液抑菌谱Table 1 Antimicrobial spectrum of the fermentation supernatant of the screened strains
从土壤中共筛选出67 株具抑菌圈的菌株,其中抑菌活性强的菌株有8 株,结果如表1所示。7 种供试菌对沙门氏菌和金黄色葡萄球菌具有抑菌效果;6 种供试菌对枯草芽孢杆菌、蜡样芽孢杆菌及大肠杆菌具有抑制作用;对铜绿假单胞菌及志贺氏菌可抑制的供试菌较少,仅3 种供试菌可对铜绿假单胞菌抑制;对酿酒酵母有抑制作用的有4 株,对霉菌黑曲霉和深绿木霉有抑制作用的菌株有7 株。可以看出菌株XF32与其他菌株的相比有显著抑菌差异,对所选用的10 种指示菌都具有良好的抑制效果,菌株XF32发酵上清液对部分霉菌、酵母菌及细菌的抑菌情况如图1所示。选择菌株XF32进一步实验。

图1 菌株XF32抗菌物质对真菌和细菌的抑菌活性Fig. 1 Antifungal and antibacterial activities of antibacterial substances produced by strain XF32
2.2 拮抗菌株鉴定
2.2.1 菌落形态及生理生化鉴定
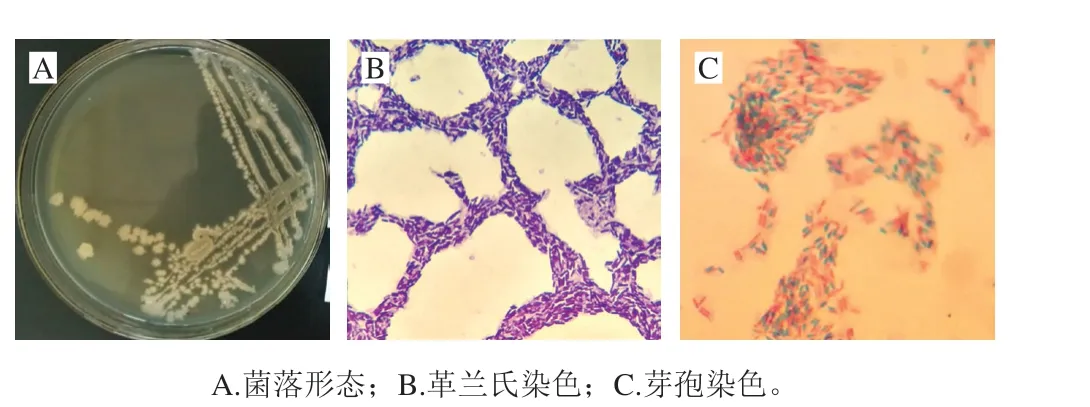
图2 地衣芽孢杆菌形态Fig. 2 Morphological characteristics of strain XF32
菌株XF32在NB固体培养基上培养24 h后,菌落形态如图2所示。菌落为圆形,乳白色,边缘不整齐,且表面粗糙不透明、有皱褶,中间有突起,具有芽孢杆菌典型的生长特征。染色后显微镜下观察,产芽孢,革兰氏染色阳性,呈直杆状,单个菌体,两端钝圆,芽孢椭圆中生。

表2 菌株XF32的生理生化特性Table 2 Physiological and biochemical characteristics of strain XF32
生理生化特征见表2。菌株XF32接触酶阳性,VP阳性,厌氧生长,能使明胶液化。不能够利用吲哚和阿拉伯糖醇。能够利用蔗糖、葡萄糖和木糖产酸,利用葡萄糖产气。能够在pH 5.5和pH 9.0的条件下生长,耐受7%的盐环境。
从菌株的形态以及生理生化特性看,本实验中分离筛选的菌株XF32与文献[19]中标准菌株的相关指标比较分析,可初步认为菌株XF32属于芽孢杆菌属的地衣芽孢杆菌(B. licheniformis)。
2.2.2 菌株的分子鉴定
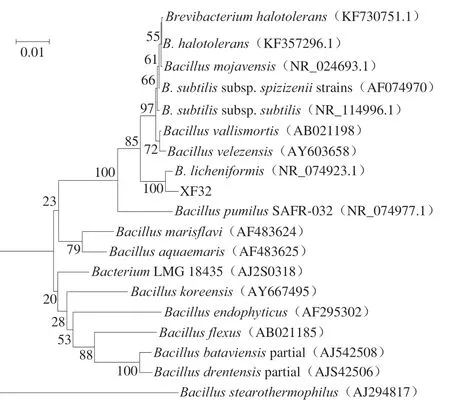
图3 基于16S rDNA序列的系统发育树Fig. 3 Phylogenetic tree based on 16S rDNA sequences of strain XF32
为了进一步确定XF32的种属,经16S rDNA分子生物学鉴定测序,菌株XF32 16S rDNA序列长1 452 bp,与GenBank中所有已测定的原核生物的16S rDNA序列进行比对,与之相似度达99%的菌株为地衣芽孢杆菌。选择11 株相似性较高的标准菌株构建系统发育树。由图3可见,XF32与地衣芽孢杆菌自然聚为一支。因此,结合形态及生理生化特征,XF32鉴定为地衣芽孢杆菌。
2.3 拮抗菌株诱变结果

表3 诱变后复筛结果Table 3 Re-screening results after mutagenesis
测定复合诱变后不同筛选菌株的抑菌情况,由表3可知,抑菌圈直径在10~15 mm和15~20 mm区间内占大多数,比例分别为30.15%和33.09%。突变菌株XF32-22抑菌圈直径27.8 mm,比诱变前的菌株抑菌圈直径提高了52.7%。说明菌株的诱变获得了较好效果。进一步对突变株XF32-22生长及抑菌活性的遗传稳定性进行考察,如图4所示。XF32-22连续传代10 次,其抑菌圈直径大小稳定在19~22 mm,这与复筛的抑菌圈直径大小一致。表明,XF32-22突变株具有较好的遗传稳定性。结合上述结果,紫外线-DES化学诱变的复合诱变方法在高产菌株的诱变选育中值得广泛应用。
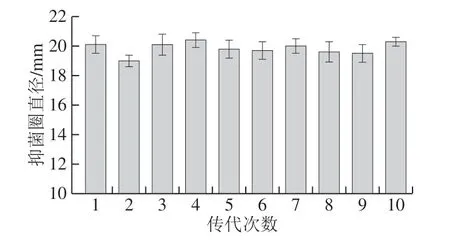
图4 遗传稳定性结果Fig. 4 Genetic stability of mutants
2.4 脂肽分离纯化
2.4.1 脂肽Sephadex G-10凝胶层析
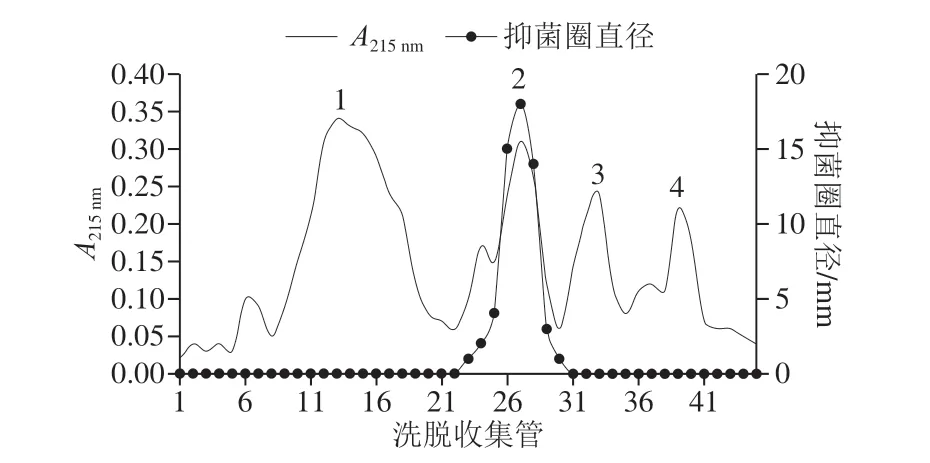
图5 Sephadex G-10分离抗菌物质Fig. 5 Elution profile of antifungal substances on Sephadex G-10
地衣芽孢杆菌XF32-22发酵液抗菌粗提物经Sephadex G-10洗脱,215 nm波长处紫外吸收检测,出现4 个大的洗脱峰,分别表示为峰1~4。如图5所示,对每支收集管检测抗菌活性,结果显示有抗菌活性的收集管主要集中在23~30号管,同吸收峰2相重叠。而其他吸收峰没有检测出抑菌性。将有活性收集管合并,进一步分离纯化。
2.4.2 脂肽半制备高效液相色谱分析

图6 地衣芽孢杆菌XF32-22抗菌物质的半制备高效液相色谱分离Fig. 6 Semi-preparative RP-HPLC profile of antimicrobial substance produced by XF32-22
经Sephadex G-10纯化后的抑菌活性物质再经过半制备高效液相色谱纯化,结果如图6所示。经半制备高效液相色谱分离后,得到多个组分峰,由此说明前期纯化的抗菌物质中含有较多的杂质成分。通过对各洗脱峰的抑菌活性检测发现,只有在出峰时间26 min的组分具有明显的抑菌活性,说明经过一系列的分离纯化步骤,本研究已经成功的获得纯度较高的抑菌活性物质,将该组分收集后用于MALDI-TOF-MS鉴定。
2.4.3 抗菌物质鉴定
芽孢杆菌的拮抗活性物质主要为非核糖体途径合成的脂肽类化合物。MALDI-TOF-MS分析广泛应用于芽孢杆菌脂肽类化合物的检测。采用MALDI-TOF-MS对有抑菌活性的收集峰组分进行分析,一级质谱显示,菌株XF32-22在m/z1 477.36、1 491.52和1 505.67处有离子峰(簇)出现(图7),这3 个离子峰均对应于Fengycin的质量。3 个离子峰的相对分子质量依次相差14,即恰好1 个CH2,推测其属脂肪酸链上差1 个亚甲基所导致,该物质与已报道的脂肽类化合物Fengycin的相对分子质量一致。目前,关于Fengycin化合物的鉴定主要是依据其质谱分子峰。综上所述,质谱分析证明抗菌物质主峰中主要成分为脂肽类化合物Fengycin,且含量较纯,根据峰面积可计算出纯度达90%以上。同时也证明了该脂肽粗提物分离后的活性较高产物主要成分为Fengycin。由此推断分离筛选的具有广谱抗菌活性的XF32菌株拮抗活性可能与其脂肽化合物的合成与分泌有关。
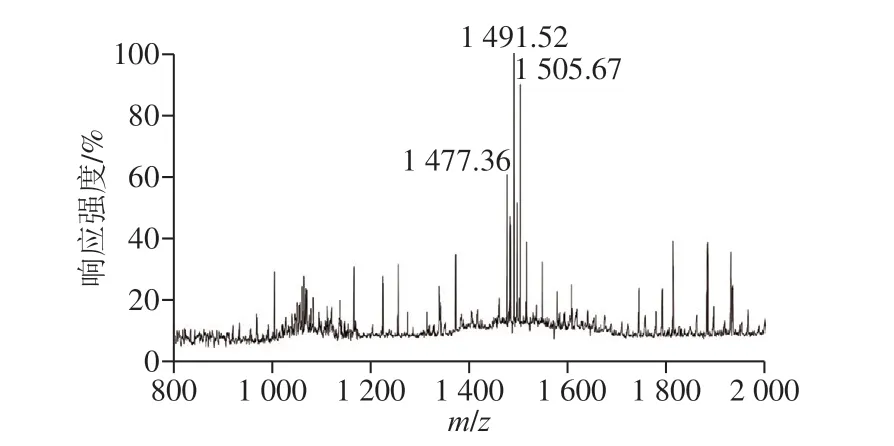
图7 地衣芽孢杆菌XF32-22脂肽类化合物的MALDI-TOF-MS分析Fig. 7 MALDI-TOF-MS of lipopeptides produced by strain XF32-22
3 讨 论
芽孢杆菌是一类产生抗菌脂肽的重要微生物资源,目前对于芽孢杆菌抗菌脂肽的报道较多,有枯草芽孢杆菌(B. subtilis)[18]、莫海威芽孢杆菌(B. mojavensis)[18]、甲基营养型芽孢杆菌(B. methylotrophicus)[20]、解淀粉芽孢杆菌(B. amyloliquefaciens)[7,21-22]等,这些研究主要集中在抗菌脂肽在分离纯化、抑菌活性及植物保护方面的应用,因产量较低、抑菌谱窄,抗菌脂肽的应用范围受到极大限制。本研究筛选到1 株广谱抗菌菌株,通过菌落形态、生理生化测定及16S rDNA进一步分析,菌株鉴定地衣芽孢杆菌,进一步丰富了产抗菌脂肽的微生物资源。目前已有多篇文献报道地衣芽孢杆菌分泌脂肽,Batrakov等[23]从深井热水中分离的地衣芽孢杆菌603所产脂肽对棒状杆菌属(Corynebacterium variabilis)菌株有抑菌活性,对不动杆菌(Acinetobactersp.)抑菌活性很弱。Rivardo等[24]研究发现单独使用地衣芽孢杆菌V9T14所产脂肽对大肠杆菌的抑制作用效果远低于其和多种抗生素协同作用。Lawrance等[25]从岛上分离了产生抗菌脂肽的地衣芽孢杆菌NIOT-AMKV06,其脂肽具有强热稳定性和显著降低表面活性的特征,对致病菌粪肠球菌、伤寒沙门氏菌以及枯草芽孢杆菌有显著抑菌活性,但对大肠杆菌无抑菌活性,抑菌谱较窄。与已报道文献对比,本研究分离的地衣芽孢杆菌XF32菌株所产抗菌物质抑菌谱广,对本实验的革兰氏阳性菌、阴性菌及真菌均具有显著的抑菌活性,这为其后续开发应用提供基础。
为进一步提高菌株脂肽产量,本研究采用紫外线和DES 2 种诱变技术,通过抑菌圈法筛选到了脂肽产量显著提高的菌株XF32-22,其抗菌脂肽产量与野生菌XF32相比显著提高。且遗传稳定性良好,为其工业化发酵和实际应用提供了可行性,为利用多种诱变技术遗传选育高产抗菌肽菌株提供了新的研究方法和思路。
芽孢杆菌属菌株最大优点是繁殖速度快、营养要求简单,具有抗逆性芽孢,能产生数十种次生代谢产物,脂肽是非常重要的一类,包括Surfactin、Fengycin、Iturin三个最重要的家族[7],脂肽一般是由羟基脂肪酸和氨基酸连接成的环肽,Iturin主要抑制真菌生长[5],Surfactin主要抑制细菌、病毒、支原体生长[26],Fengycin对丝状真菌有强烈的抑制作用[27]。目前已有许多芽孢杆菌菌株用于控制植物病害[14,16],特别是用于真菌病,例如灰霉病菌(Botrytis cinerea)、辣椒疫霉菌(Phytophthora capsici)[28-31]。本研究筛选的地衣芽孢杆菌菌株发酵液中获得脂肽粗提物,抑菌结果显示对革兰氏阳性菌、阴性细菌和真菌均有显著抑制作用,由此推测菌株XF32-22在发酵中除主要产生Fengycin类脂肽外,还可能同时产生多种类型的抗菌物质,如Surfactin、Iturin等,这些抗菌脂肽在抑菌过程中可能协同发挥作用[31],增强整体抑菌效果。Ongena等[32]报道枯草芽孢杆菌S499产生的Surfactin和Fengycin类脂肽两者协同作用增强了抑菌能力。张荣胜等[22]发现从解淀粉芽孢杆菌Lx-11发酵液中提取的粗提物中含有Surfactin、Bacillomycin D和Fengycin 3 种脂肽类抗生素,协同发挥较强的生防特性。
本研究对产脂肽的地衣芽孢杆菌XF32-22的发酵液进行酸沉淀处理,再过Sephadex G-10柱层析,上步的活性组分经过半制备高效液相色谱分离,将抗菌活性组分进行MALDI-TOF-MS鉴定,确定为Fengycin。Fengycin是芽孢杆菌产生的抑菌脂肽中的一大类[4],对多种植物病原真菌,尤其是丝状真菌有较强的拮抗作用,低浓度时可导致病原菌细胞膜通透性改变,进而起到抑菌作用,高浓度时则以表面活性剂的方式作用于生物膜,破坏病菌细胞膜结构[33]。因脂肽具有稳定性好、不易产生抗药性、高效抗真菌等优点,因而成为生物防治、食品防腐、医药等领域研究的热点。如Hentati等[17]研究了1 株枯草芽孢杆菌FLU5所产生的有Surfactant脂肽类化合物,在环境修复中具有重要意义;Aktuganov等[15]报道了菌株Paenibacillus ehimensisIB-X-b可以产生多种Fengycin/Plipastatin A-C16类型的环状脂肽。
国内外对芽孢杆菌抗菌脂肽的研究越来越深入,已从菌株分离、抗菌肽纯化、鉴定深入到遗传、代谢和机理改造等方面。本研究分离筛选并诱变选育了地衣芽孢杆菌菌株XF32-22,分析了菌株分泌的脂肽类化合物的种类及抑菌特性,并为进一步采用基因工程的手段改良芽孢杆菌菌株,大幅度提高脂肽的发酵产量,为以后开发推广抗菌脂肽的应用范围打下了理论基础。
4 结 论
本研究针对目前抗菌脂肽生产菌株在生产能力利用上的不足,从自然界中分离到1 株广谱抗菌效果的菌株,生理生化指标结合16S rDNA序列测序结果表明XF32是地衣芽孢杆菌。进一步采用紫外-DES法诱变育种技术选育出了1 株脂肽生产性能优良的高产菌株XF32-22。和传统单纯使用紫外诱变以及利用菌株自发突变获取抗性突变株相比,采用紫外诱变结合DES复合诱变可以提高菌株的突变率,加快菌株选育的进程,更有效地提高脂肽产量,适合产抗菌脂肽菌株地衣芽孢杆菌XF32的诱变。利用酸沉淀、Sephadex G-10凝胶层析和半制备高效液相色谱获得了高纯度的抑菌活性物质,经MALDI-TOF-MS分析,确定抗菌物质为脂肽类Fengycin。该脂肽对本研究使用的指示菌革兰氏阴性细菌、阳性细菌及酵母菌和丝状真菌均具有显著的抑菌活性,有潜力在植物生防、食品防腐及医药等行业生产应用。研究为寻找新的具有广谱抗菌活性的代谢产物奠定了理论基础。

