基于MnO2纳米片类氧化酶特性的有机磷农药荧光分析方法建立
罗 林,邓楚瑶,贾宝珠,林豪红,廖彩霞,吴卓裕,何镇熹,王 弘,徐振林,*
(1.广东省食品质量安全重点实验室,华南农业大学食品学院,广东 广州 510642;2.广东第二师范学院生物与食品工程学院,广东 广州 510303)
农药的广泛应用已成为确保现代农业丰收高产的必要条件之一,但是,由此产生农药残留所引发的生态环境污染、食品安全问题也日益严重[1]。有机磷农药是一类含3 个磷酯键、当前应用最为广泛的农药杀虫剂。在我国,有机磷农药的用量约占农药杀虫剂总量的70%[2]。世界各国从本国的利益和食品安全的角度出发,对有机磷农药的残留要求和限制日益严格,这也要求有机磷农药检测技术不断更新,向更快、更准的方向发展[3]。
检测农药残留的技术目前较为常见的有色谱法、免疫法、酶抑制剂法等[4-8]。色谱法如气相色谱、液相色谱及其与质谱联用的方法灵敏度、准确度高,但需要昂贵仪器、检测时间较长、需要专业操作人员、检测成本高,不适合现场大批量样品的筛查;免疫法对抗体的性能要求较高,有些农药小分子由于结构简单,免疫特性差难以获得满意的抗体;酶抑制法具有检测快、成本低、操作简便等优势,但是传统酶抑制法是基于可见光吸收比色测定,存在灵敏度差(mg/kg级别),假阴性风险高,难以满足检测需求等问题[2]。因此,开发高灵敏度、快速简便检测有机磷农药残留的新方法显得尤为重要。
过渡金属硫化物是一类由IV、V和VI族元素的过渡元素与硫属元素组成类石墨烯纳米材料,具有超薄的二维平面结构、高比表面积及突出的电子传递特性,已成为当前材料科学及传感分析领域的研究热点之一[9-11]。MnO2纳米片作为过渡金属硫化物家族重要的一员,在紫外-可见光有宽的吸收范围(300~600 nm)和较高的摩尔吸光系数,因此具有荧光猝灭特性可作为荧光猝灭剂[12]。与此同时,MnO2纳米片具有类氧化酶特性,可氧化多种还原剂,如抗坏血酸、半胱氨酸、谷胱甘肽。鉴于此,研究者们利用MnO2纳米片构建了多种检测这些还原剂的荧光分析方法。Deng Renren等[13]首次将MnO2纳米片作为荧光纳米猝灭剂构建了快速检测谷胱甘肽的荧光分析方法。在该方法中MnO2纳米片同时作为谷胱甘肽的识别材料及上转换纳米粒子的猝灭剂。基于类似机理,Yan Xu等[14]以石墨烯量子点-MnO2纳米片作为荧光探针构建检测活细胞内谷胱甘肽的荧光传感平台。Liu Juanjuan等[15]设计了基于MnO2纳米片修饰的荧光碳点的混合体系,并将其用于食品中抗坏血酸检测。此外,MnO2纳米片作为氧化酶类似物,还可以用于建立检测酶联免疫分析方法及快速检测碱性磷酸酶活性的荧光分析方法[16-18]。总之,利用MnO2纳米片构建新型传感分析平台方面引起了越来越多的关注[19]。
本研究利用MnO2纳米片的优异类氧化酶特性及荧光分析方法的高敏感性结合酶抑制原理构建一种快速、准确、高灵敏检测有机磷农药的荧光分析方法,其原理如图1所示:邻苯二胺(o-phenylenediamine,OPD)可被MnO2催化氧化生成荧光物质2,3-二氨基吩嗪(2,3-diaminophenazine,DAP)。乙酰胆碱酯酶(acetylcholinesterase,AChE)可催化水解底物硫代乙酰胆碱(acetylthiocholine,ATCh)生成硫代胆碱(thiocholine,TCh),产物TCh可还原降解MnO2纳米片生成Mn2+,而Mn2+对OPD没有氧化能力。当有机磷农药存在时AChE酶活性受到抑制,从而阻止TCh的生成及MnO2纳米片的分解。因此,通过测定体系荧光强度变化,可以检测有机磷农药的含量。
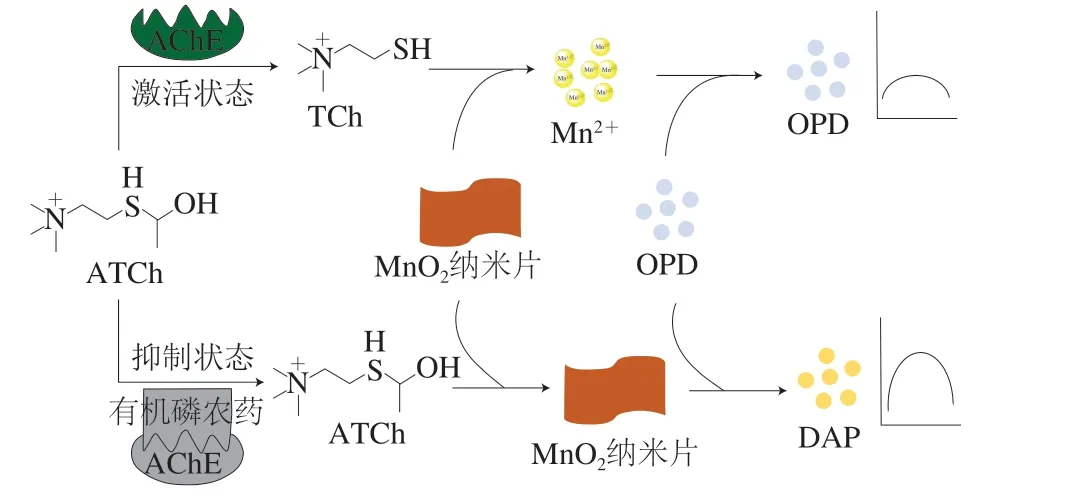
图1 有机磷农药荧光分析方法原理图Fig. 1 Schematic diagram illustrating the principle of fluorescence analysis of organophosphorus pesticides
1 材料与方法
1.1 材料与试剂
AChE、对氧磷标准品溶液 广州齐湘生物科技有限公司;碘代ATCh 上海源叶生物科技有限公司;OPD 上海易恩化学技术有限公司。所用化学试剂均为分析纯。
1.2 仪器与设备
OSB-2200型旋转蒸发器、CA-1116AS型循环装置EYELA东京理化器械株式会社;SpectraMax i3x多功能微孔板检测平台 美谷分子仪器有限公司。
1.3 方法
1.3.1 MnO2纳米片的合成
参照文献[20]的方法制备MnO2纳米片,将0.1 mol/L十二烷基硫酸钠(sodium dodecyl sufate,SDS)溶液32 mL和0.1 mol/L的H2SO4溶液1.6 mL加入到283.2 mL蒸馏水中,并首先在95 ℃加热15 min。然后将0.05 mol/L的KMnO4溶液3.2 mL迅速加入到SDS溶液中,开始反应,将反应混合物加热60~90 min,直到反应液变无色透明并有棕色沉淀生成,停止加热待自然冷却后,4 000 r/min以上离心10~15 min,并用超纯水和乙醇重复洗涤2~3 次沉淀。纯化后的MnO2纳米片加入超纯水重新悬浮并超声30 min得到MnO2纳米片胶体悬浮溶液,并稀释至质量浓度为1 mg/mL备用。
1.3.2 检测体系的优化
AChE及ATCh浓度对检测性能的影响:将浓度分别为150、75、37.5、18.75、9.375、4.687 5、2.343 75、1.171 88 U/L和0 U/L的AChE与浓度分别为12、10、8、5、2 mmol/L的ATCh构建不同反应体系,并测定体系荧光强度。采用荧光抑制率与AChE浓度的关系评价不同条件下体系的灵敏度,抑制率按下式计算:
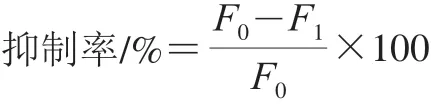
式中:F0为体系MnO2-OPD时荧光强度;F1为体系存在不同浓度AChE时荧光强度。
OPD与MnO2纳米片作用时间对检测性能的影响:以上述优化的AChE及ATCh质量浓度及1 mg/mL的OPD与0.5 mg/mL的MnO2纳米片构建反应体系,测定荧光抑制率与OPD与MnO2纳米片作用时间的关系。
1.3.3 对氧磷的检测
取50 μL样品或不同浓度的对氧磷标准品溶液和50 μL AChE(9.375 mU/mL)混合,38 ℃孵育30 min。然后,在该温度下加入40 μL的ATCh(10 mmol/L)和60 μL的磷酸缓冲盐溶液(phosphate buffer saline,PBS)(pH 8.5,10 mmol/L)38 ℃孵育20 min,接着加入40 μL的MnO2纳米片(0.5 mg/mL)与50 μL的OPD溶液(1 mg/mL),振荡混匀11 min后,利用多功能微孔板读数平台,荧光分析模块,在波长430 nm激发下,测定反应体系在波长570 nm处荧光发射强度,激发光狭缝宽9 nm,发射光狭缝宽15 nm。
1.3.4 样品前处理及加标回收实验
自来水样品:自来水样品取自本实验室。取10 mL水样经过微孔滤膜(0.22 μm)过滤,后加入10 mL PBS(20 mmol/L,pH 8.5),并分别添加2、10、50 ng/mL对氧磷标准品,然后通过建立的荧光分析方法进行检测,计算添加回收率。
燕麦与蔬菜样品:取1 g样品用研钵研碎,并按2、10、20 ng/g 3 个水平添加对氧磷标准品,过夜后与20 mL乙腈混合并超声提取10 min,然后以4 000 r/min离心10 min。将上清液(10 mL)通过无水硫酸钠过滤并旋蒸。将剩余物用10 mL含10%甲醇的PBS溶解,然后通过建立的荧光分析方法进行检测,计算添加回收率。
1.4 数据处理
每组数据均重复3 次,采用Excel 2016软件进行数据统计分析,使用Origin 2017软件绘制结果图。
2 结果与分析
2.1 MnO2纳米片的合成与表征
本研究以KMnO4和SDS为原料,通过氧化还原反应合成超薄MnO2纳米片。如图2A所示,MnO2纳米片的横向平均长度在100 nm左右,表明MnO2的纳米结构提供了很大的表面积供OPD反应。图2B显示MnO2纳米片的紫外-可见光谱一般以宽吸收带(300~600 nm)为特征,其特征吸收位于380 nm左右。图2C可以看到,在529.6 eV和641.9 eV有2 个明显峰,表明样品中存在O1s与Mn2p。Mn2p的精细谱显示有2 个分别属于Mn2P3/2和Mn2P1/2峰,分别位于642.0 eV和653.9 eV(图2D)。这些结果与文献[20]得出的MnO2纳米片图像基本一致,表明MnO2纳米片制备成功。
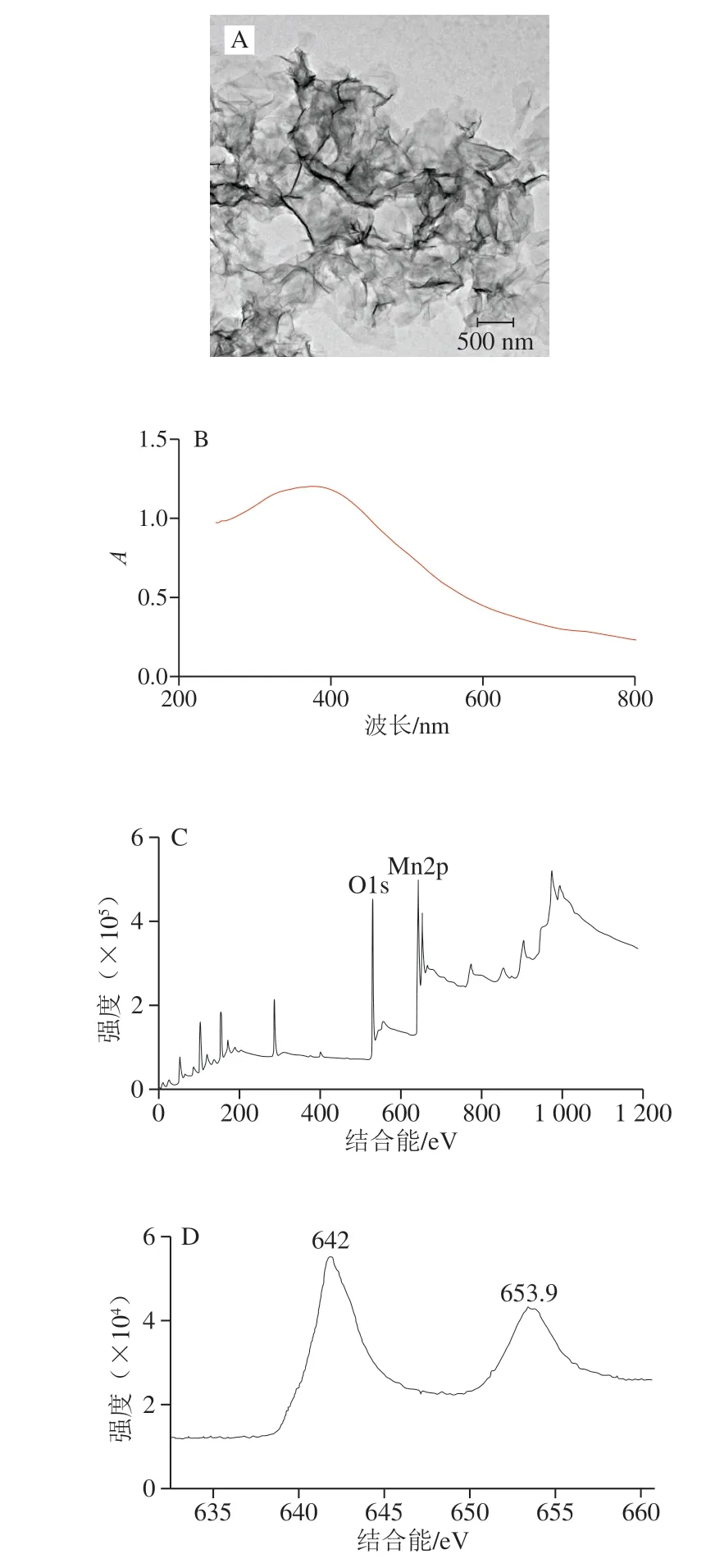
图2 MnO2纳米片的透射电镜图(A)、紫外吸收光谱(B)、X射线能谱全谱(C)和Mn2p谱(D)Fig. 2 TEM image (A), UV absorption spectrum (B), high-resolution XPS spectrum (C), and Mn2p spectrum (D) of MnO2 nanosheets
2.2 方法可行性验证
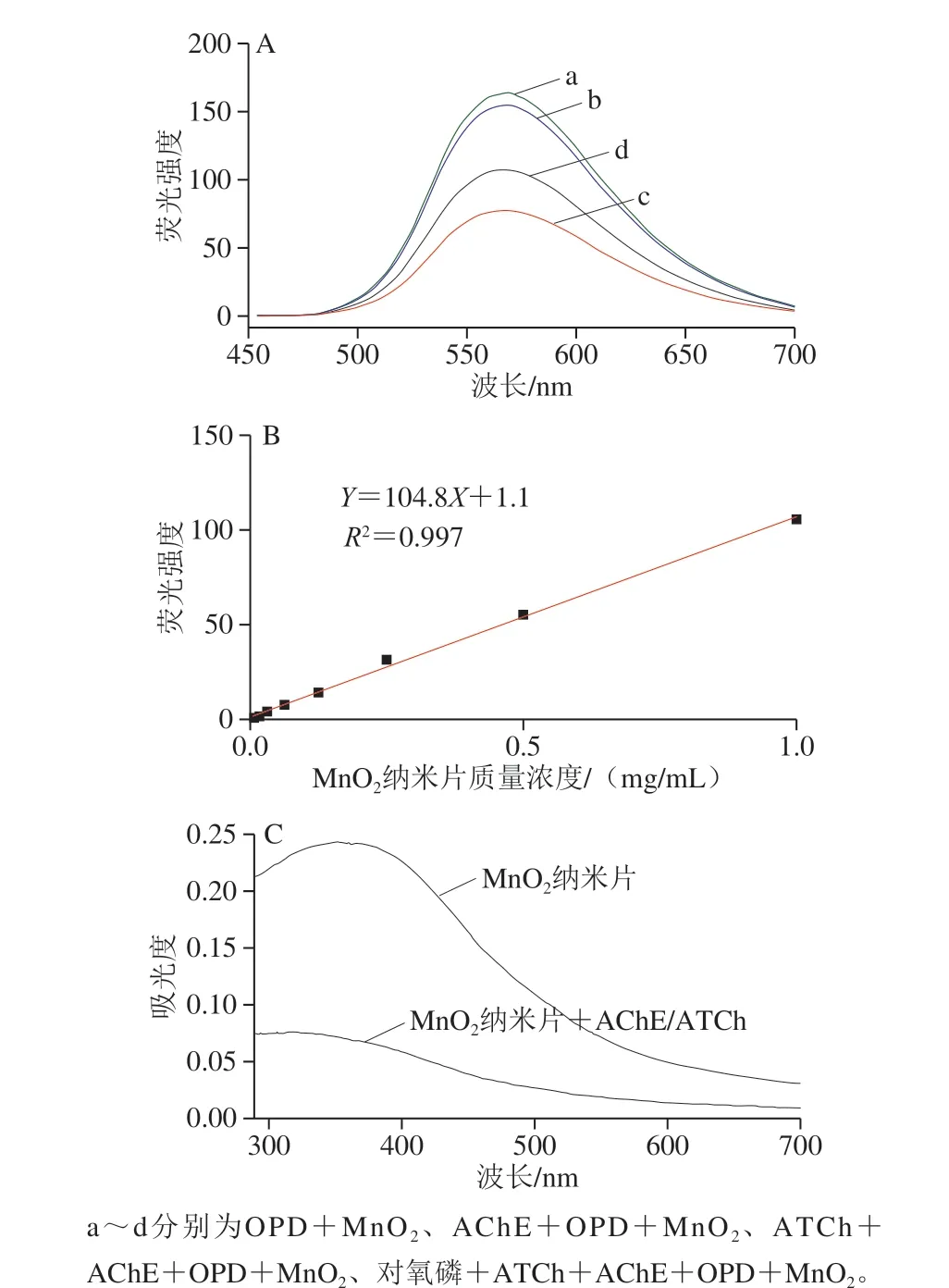
图3 不同成分下反应体系的荧光光谱图变化情况(A)、不同质量浓度MnO2纳米片与OPD反应生成DAP荧光强度的关系(B)和MnO2纳米片在与AChE/ATCh作用下紫外-可见光谱变化情况(C)Fig. 3 Fluorescence spectra of reaction systems with different compositions (A), relationship between fluorescence intensity and concentration of manganese dioxide nanosheets (B), and UV absorptionspectra MnO2 nanosheets under the action of AChE/ATCh
MnO2纳米片具有类氧化酶特性可氧化常见氧化酶底物四甲基联苯胺显色已有报道[17,21]。本研究将MnO2纳米片和另一种常见氧化酶底物OPD混合后生成在波长570 nm处出现强特征峰荧光物质(如图3A a线所示),这与氧化酶催化OPD生成的荧光物质DAP的发射峰一致[12],再一次验证MnO2纳米片的类氧化酶活性。并且MnO2纳米片质量浓度在0.007 8~1 mg/mL范围内与OPD反应,其质量浓度与生成DAP的荧光强度呈正比且线性很好(R2=0.997)(图3B)。AChE的酶解产物TCh与谷胱甘肽均含有巯基有还原性可以使MnO2纳米片降解,从而阻止OPD氧化。通过紫外-可见光谱验证(图3C),当体系含有AChE与底物ATCh时,MnO2纳米片在波长380 nm处的吸收峰明显降低,表明酶解产物TCh可使MnO2纳米片降解为Mn2+。荧光光谱图3A显示仅加入AChE后体系荧光值基本不变(图3A b线),而加入AChE与ATCh后体系,由于AChE催化底物ATCh产生TCh,TCh含有巯基具有还原性会分解MnO2纳米片,从而阻止OPD氧化,体系荧光值大幅度下降(图3A c线),而加入对氧磷后,体系的荧光值又重新增大(图3A d线),这是因为对氧磷抑制了AChE的活性,导致AChE无法催化ATCh生成TCh,从而无法分解MnO2纳米片。这些结果表明本方法原理完全可行。
2.3 方法条件的优化
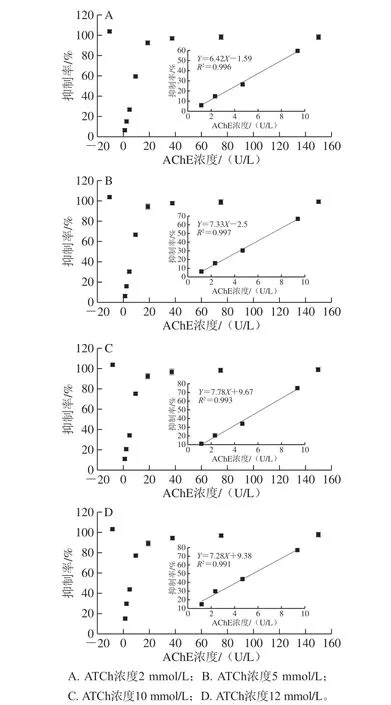
图4 不同AChE及ATCh浓度下体系荧光抑制率变化情况Fig. 4 Changes in fluorescence inhibition rate of different systems at different concentrations of AChE and ATCh
作为酶抑制法的核心试剂AChE的浓度及底物ATCh浓度不仅关乎检测性能,还与检测成本直接挂钩。因此,有必要对其浓度进行优化。由图4所示,当AChE浓度高于9.375 U/L,荧光抑制率增长速率变缓慢,当浓度高于18.75 U/L时,荧光抑制率变化趋于平缓接近100%。因此,9.375 U/L为AChE的最优浓度。而ATCh的浓度在2~12 mmol/L范围内对荧光抑制率变化趋势影响不大。因此,综合考虑ATCh用量尽量小,检测灵敏度尽量高的条件。由图4可知,ATCh 10 mmol/L时,荧光抑制率变化斜率最大,故选择10 mmol/L为ATCh的最佳浓度。
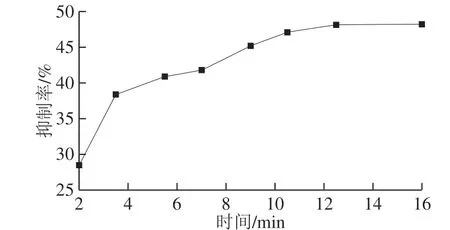
图5 MnO2纳米片与OPD反应时间优化Fig. 5 Optimization of reaction time of MnO2 nanosheets with OPD
以最优的AChE及ATCh浓度及1 mg/mL OPD与0.5 mg/mL MnO2纳米片构建反应体系,测定荧光抑制率与OPD、MnO2纳米片作用时间的关系。由图5可以看出,随着MnO2纳米片和OPD反应时间的延长,荧光抑制率逐渐增大,而且增加的速度是由快变慢最后趋于稳定。当反应时间为11 min时,抑制率的增加开始变得极为缓慢,说明11 min正是MnO2纳米片与OPD最佳的反应时间。
2.4 标准曲线和检出限
在最优条件下构建MnO2-OPD-AChE-ATCh的反应体系,并向其中加入分别为200、100、50、25、12.5、6.25、3.125、1.562 5 ng/mL的对氧磷标准溶液,测定体系荧光强度,以荧光恢复效率(F2-F1)/(F0-F1)为纵坐标,对氧磷质量浓度为横坐标绘制标准曲线,其中F2表示不同质量浓度的对氧磷溶液测得的荧光值,F1表示不添加对氧磷所测得的荧光值,F0表示既不添加对氧磷也不添加AChE所测得的荧光值。以四参数逻辑方程拟合得:(F2-F1)/(F0-F1)={-1.347/[1+(X/121.3)0.871]}+1.475,(R2=0.998),检出限为0.5 ng/mL(RSN=3)。如表1所示,与其他方法比较,本研究建立的荧光分析方法具有较好的检测性能,可用于对氧磷的灵敏检测。
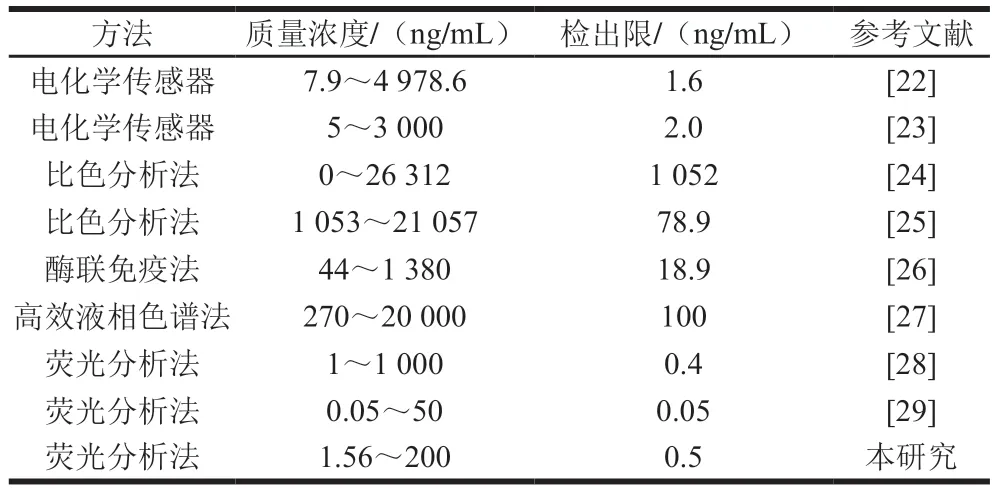
表1 不同有机磷农药检测方法检测性能比较Table 1 Performance comparison among different OPs detection methods
2.5 方法的加标回收率及精密度
为证明方法的准确性,选用3 种样品,自来水、卷心菜和燕麦进行添加回收实验。如表2所示,3 个样品的3 个添加水平50、10、2 ng/mL所得加标回收率在83.4%~105.9%之间,变异系数低于8.9%,表明所建立的方法具有较好的准确性及精密度,可用于食品中对氧磷的检测分析。
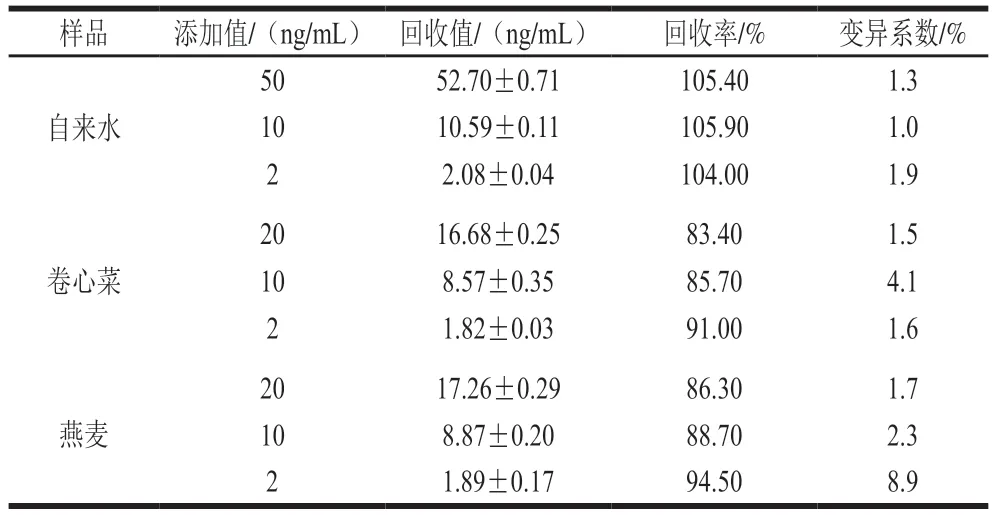
表2 不同样品的添加回收情况Table 2 Recoveries of paraoxon spiked into different samples by the proposed method
3 结 论
本研究受MnO2纳米片类氧化酶特性的启发,构建一种快速、简便、高灵敏的有机磷农药对氧磷的荧光分析方法。MnO2纳米片能够催化氧化典型的氧化酶底物OPD产生荧光物质DAP,在波长570 nm处有荧光发射峰。而AChE催化底物ATCh产TCh可以使MnO2纳米片降解Mn2+进而抑制OPD氧化,使体系荧光强度减弱,而有机磷农药可使AChE酶活性抑制从而使体系荧光增强。在最优条件下,该方法对对氧磷动态检测范围在1.56~200 ng/mL之间,检出限为0.5 ng/mL。对自来水、卷心菜、燕麦的加标回收实验,回收率在83.4%~105.9%之间,表明该方法具有较好的准确性。本研究说明本实验已成功构建一种快速、简便、高灵敏的有机磷农荧光免疫分析方法。本研究构建了基于MnO2纳米片(模拟酶)与AChE的“双酶”体系,提升有机磷农药的灵敏度,也为模拟酶在食品安全检测中应用提供了新的思路。

