亮氨酸氨肽酶LapA 在无孢黑曲霉中的重组表达优化及酶学性质
林晓彤,董良波,郑俊威,王 斌,2,潘 力,2,*
(1.华南理工大学生物科学与工程学院,广东 广州 510006;2.广东省发酵与酶工程重点实验室,广东 广州 510006)
氨肽酶是一种外肽酶,它依次水解多肽链N端上的氨基酸,并一次释放1~2 个氨基酸。大多数氨肽酶是金属蛋白酶,需要1 个或2 个二价金属离子作为活性中心[1-2]。亮氨酸氨肽酶(EC 3.4.11.1)主要水解以疏水性氨基酸为N端残基的多肽,水解亮氨酸时活性最高[3]。在食品工业中,许多食品蛋白经酶解后产生苦味物质,从而限制了蛋白质水解物的应用,而亮氨酸氨肽酶可以选择性地从多肽链或蛋白上切除末端的疏水性氨基酸残基,对蛋白水解液具有很好的脱苦作用[4-5]。
目前报道的氨肽酶来源广泛,存在于动植物组织和各种微生物中,如Aspergillus oryzae、A. sojae、Bacillus subtilis和Pseudomonas等[6-7]。亮氨酸氨肽酶IV从猪肠黏膜中分离出来,Mg2+和Mn2+对该酶有一定的激活作用[8]。Nakadai等[9-12]首先从米曲霉中提取并纯化了1 个羧基肽酶和3 个亮氨酸氨基肽酶。Blinkovsky等[13]从米曲霉中克隆表达了亮氨酸氨肽酶2,发现其特异性广,可水解多种氨基酸残基。近年来,在毕赤酵母中表达了A. sojae来源的lap1基因,其亮氨酸氨肽酶活力(766.9 U/mL)是真菌表达系统中的较高水平[14],但总体来说,食品级安全的亮氨酸氨肽酶表达水平不高[15],在较大程度上限制了其工业应用。
黑曲霉(A. niger)具有旺盛的蛋白表达分泌能力以及强大的繁殖能力,其普遍应用于工业重组蛋白、柠檬酸等的生产[16-17],被广泛地用于重组蛋白的表达[18-20]。黑曲霉被美国食品药品监督管理局认证为GRAS(Generally Regarded as Safe)范围的安全菌种[21],作为食品行业酶制剂的生产菌株。本研究利用低蛋白背景的无孢黑曲霉HL-1作为宿主,使用黑曲霉自身杂合启动子(PnaII)筛选曲霉中高酶活力的亮氨酸氨肽酶基因,再结合规律间隔成簇短回文重复序列(clustered regularly interspaced short palindromic repeats,CRISPR)/Cas9工具提高基因整合效率,实现亮氨酸氨肽酶基因lapA的过量表达。通过融合6×His标签实现重组亮氨酸氨肽酶LapA的纯化,研究重组亮氨酸氨肽酶LapA的酶学性质,目前在亮氨酸氨肽酶的表达研究中,曲霉表达系统产量普遍较低,本实验旨在提高亮氨酸氨肽酶产量的同时,为食品级安全亮氨酸氨肽酶的工业发酵表达量的提高提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与质粒
大肠杆菌Match1 T1感受态 美国Invitrogen公司;黑曲霉宿主菌株HL-1(ΔpyrG)由本实验室改造并保存;通用表达载体pRpT均由本实验室构建并保藏;质粒Cas9-hygB由本实验室构建并保藏。
1.1.2 试剂
限制性内切酶(如ApaI)、DNA聚合酶 日本TaKaRa公司;L-亮氨酸-4-硝基苯胺 美国Sigma公司;其他试剂均为分析纯。
1.1.3 培养基
LB(Luria-Bertani)培养基:1%蛋白胨,1%NaCl,0.5%酵母提取物;CD培养基:2%葡萄糖,0.3% NaNO3,0.2% KCl,0.05% MgSO4·7H2O,0.1%KH2PO4,0.001% FeSO4·7H2O,2%琼脂粉,pH 5.5;DPY培养基:2%葡萄糖,1%蛋白胨,0.5%酵母提取物,0.1% KH2PO4,0.05% MgSO4·7H2O;发酵培养基:5%玉米淀粉,3%玉米浆,2%豆粕粉。
1.2 仪器与设备
微量移液器、高速冷冻离心机 德国Eppendorf公司;酶标仪 美国Thermo Fisher Scientific公司;Veriti 96-Well Thermal Cycler聚合酶链式反应(polymerase chain reaction,PCR)仪 美国Applied Biosystems公司;AKATA层析仪 美国通用电气公司;浸入式水平电泳系统 美国Bio-Rad公司。
1.3 方法
1.3.1 引物设计
在uniprot数据库上筛选得到米曲霉、酱油曲霉、黑曲霉的亮氨酸氨肽酶基因序列(表1),在SignalP 4.0 server上预测其原有的信号肽,并通过设计引物将其信号肽替换成糖化酶GlaA信号肽,并在反向引物上加入6×His-Tag的标签序列。以各曲霉的基因组为模板,使用特异性引物(表2)扩增得到目的基因,引物对PnaII-F和PnaII-R扩增杂合启动子PnaII(由淀粉酶AmyB启动子和TPI的5’UTR组成)。
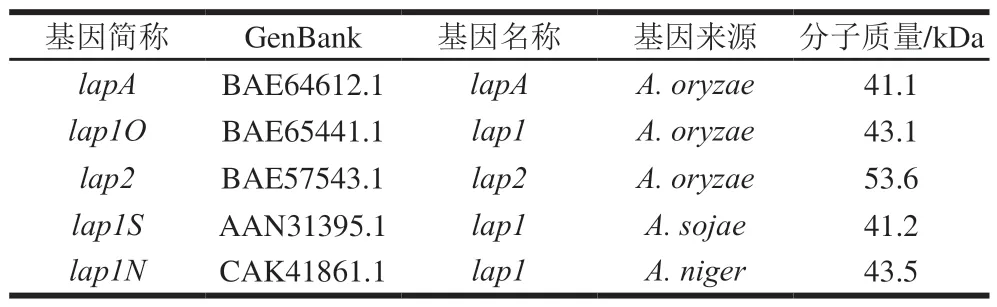
表1 本研究所扩增的基因Table 1 Genes used in this study

表2 本研究所用引物Table 2 Sequences of PCR primers used in this study
1.3.2 重组表达质粒的构建
以米曲霉、酱油曲霉和黑曲霉的基因组为模板,分别使用对应的特异性引物(如lapA-F和lapA-R)扩增得到目的基因(如lapA),将目的基因(lapA、lap1O、lap2、lap1S或lap1N)、启动子和pRpT线性化载体(含有筛选标记pyrG、终止子Ttef和同源臂amyA-HR)通过同源片段在DNA连接酶的作用下连接,转化大肠杆菌感受态细胞,经amp抗性筛选,通过菌液电泳验证质粒大小是否正确,得到不同目的基因的杂合启动子重组表达载体。经测序验证后,将构建正确的重组表达载体命名为pMD20-PnaII-Target gene,使用ApaI单酶切线性化。
1.3.3 重组表达菌株的构建
首先采用酶解法制备黑曲霉宿主HL-1的原生质体[22],将线性化的表达载体pMD20-PnaII-Target gene与原生质体相混合,利用CaCl2-聚乙二醇法诱导转化[23],涂布于高渗CD平板上30 ℃恒温培养。培养后两组转化子基因组用PnaIIp-F和Ttefp-R引物经过PCR鉴定,检测目的基因是否整合入黑曲霉宿主基因组中,得到重组菌株的阳性转化子。
1.3.4 重组表达菌株的摇瓶发酵及酶活力检测
将重组菌株的阳性转化子接种于液体淀粉发酵培养基中,30 ℃、250 r/min培养,按24 h间隔分别取样,8 000×g离心5 min,收集上清液。发酵液稀释至合适的倍数,以L-亮氨酸-4-硝基苯胺为底物测酶活力[9,15,24],检测反应体系在405 nm波长处的吸光度,标准酶活力单位定义为:在65 ℃和pH 8.5条件下,每分钟水解底物亮氨酸对硝基苯胺产生1 μg对硝基苯胺所消耗的酶量定义为1 个酶活力单位(U)。
1.3.5 重组亮氨酸氨肽酶LapA的纯化
由于LapA带有6×His标签,故采用镍柱亲和层析纯化重组蛋白,重组菌株经摇瓶培养7 d后,收集上清液用于纯化。使用的层析柱为HisTrapTMHP,上样量为30 mL,采用梯度洗脱法(咪唑浓度0~0.5 mol/L),流速2.0 mL/min[25]。十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)检测纯化效果,再进行质谱鉴定。
1.3.6 重组亮氨酸氨肽酶LapA酶学特性分析
最适温度和pH值的测定:在pH 8条件下,设置不同温度梯度15、20、25、30、35、40、45、50、55、60、65、70、75、80、85 ℃,测定酶活力随温度的变化;在测得的最适反应温度条件下,测定不同pH值(2.0、3.0、4.0、5.0、6.0、7.0、8.0、8.5、9.0、9.5、10.0、11.0)条件下的酶活力,以最适条件下所得的酶活力为100%。
热稳定性和pH值稳定性的测定:酶液在不同温度(55~75 ℃)保温2 h,在标准条件下测定剩余酶活力,以未经处理组的酶活力为100%;将酶液置于不同pH值(6.0~10.0)缓冲液中,65 ℃保温2 h后在标准条件下测定剩余酶活力,以未经处理组的酶活力为100%。
金属离子及表面活性剂SDS对氨肽酶活力的影响:在标准测定体系中分别加入不同金属离子及表面活性剂SDS,使其终浓度为5 mmol/L,测定酶活力,以未经处理组的酶活力为100%。
1.3.7 利用CRISPR/Cas9工具提高LapA蛋白的表达量
传统的同源重组转化是利用CaCl2-聚乙二醇法诱导,将线性化的表达载体pMD20-PnaII-Target gene与原生质体相混合进行转化,在此基础上,结合CRISPR/Cas9工具,质粒Cas9-hygB[26](带有Cas9蛋白表达框和sgRNA表达框,靶点位于amyA基因内)和线性化的表达载体pMD20-PnaII-Target gene共转[27],培养后两组转化子用PnaIIp-F和Ttefp-R引物经过PCR鉴定,检测目的基因是否整合入黑曲霉宿主基因组中,得到两组不同方法的重组菌株的阳性转化子,并测定表达菌株目的基因拷贝数。
1.3.8 real-time PCR体系和反应条件
real-time PCR体系如表3所示。反应条件设定为:95 ℃预变性30 s,然后进行35 个循环(95 ℃变性5 s;60 ℃退火34 s)。

表3 real-time PCR扩增体系Table 3 Formulation of real-time PCR amplification system
1.3.9 表达菌株目的基因拷贝数的测定
选用gpda为内源参照基因[28],对酶活力最高基因进行real-time PCR分析,构建包含目的基因和内源参照基因gpda单拷贝标准质粒,使用Nano Drop1000测定标准质粒浓度和质量,计算相应拷贝数,并用无菌RNase free水将标准质粒拷贝数分别稀释到相应梯度。用初始质量浓度10 ng/μL重组转化子基因组作为模板稀释到相应梯度,分别以qGPDA-F、qGPDA-R和qLapA-F、qLapA-R为引物扩增目的基因(146 bp)和gpda的部分片段(157 bp),根据其Ct值和标准质粒的拷贝数作标准曲线,并计算得到内参基因和目的基因的初始拷贝数,目的基因拷贝数是目的基因和内参基因初始拷贝数的比值[29]。
2 结果与分析
2.1 高表达亮氨酸氨肽酶基因筛选
为筛选高表达的亮氨酸氨肽酶基因,从米曲霉、黑曲霉和酱油曲霉中筛选出5 个亮氨酸氨肽酶,利用MEGA7进行系统进化树分析(图1A),根据亮氨酸氨肽酶基因氨基酸序列的进化树显示,大概分为3 个分支,lap1N与lap1O关系较近,置信度可达到100;lapA与lap1S关系较近,置信度可达到100;lap2单独为一个分支。SignalP 4.0服务器预测的5 个亮氨酸氨肽酶基因都含有N端信号肽,用黑曲霉的glaA信号肽所取代。
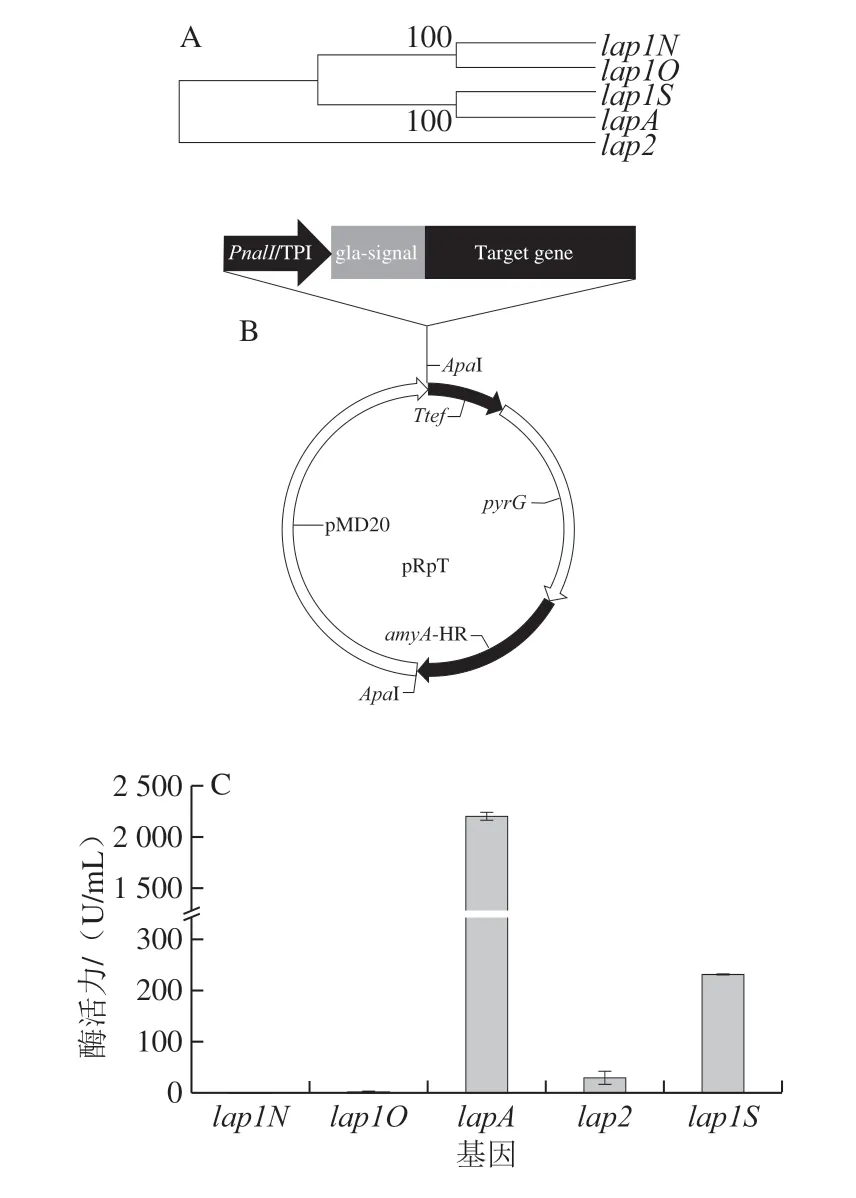

图1 从曲霉中筛选高表达的亮氨酸氨基肽酶基因Fig. 1 Screening of highly expressed leucine aminopeptidase genes from Aspergillus
为了筛选高表达亮氨酸氨基肽酶的转化子,对阳性转化子进行摇瓶发酵。96 h取发酵液,测定酶活力。从图1C可以看出,LapA亮氨酸氨肽酶活性最高(2 212.3 U/mL),远高于Lap1S亮氨酸氨肽酶活性(231.8 U/mL)和Lap2亮氨酸氨肽酶活性(41.5 U/mL)。然而,Lap1N和Lap1O几乎没有显示出任何亮氨酸氨肽酶活性。
LapA蛋白分子质量约为35.0 kDa,小于预测分子质量41.1 kDa(图1D泳道1),是由于成熟的LapA是通过从LapA前体蛋白中去除前79 个N端氨基酸而形成的[15],导致了LapA的实际分子质量小于预测分子质量。Lap2蛋白分子质量约为66.2 kDa,大于预测分子质量53.6 kDa(图1D泳道2),可能是由于蛋白的糖基化使分子质量增大。Lap1S的预测分子质量为41.2 kDa,可能被中性淀粉酶AmyA(45 kDa)覆盖(图1D泳道3)。
2.2 利用CRISPR/Cas9工具高水平表达重组亮氨酸氨肽酶
为了进一步提高LapA的表达水平,使用CRISPR/Cas9工具进行转化作为表达策略。结果表明,利用CRISPR/Cas9工具表达的转化子(LapA-C)蛋白带较常规同源重组表达的转化子(LapA-T)蛋白带更粗(图2A、B)。两种表达方法的氨肽酶活性随发酵时间的延长而增加,LapA-T在72 h达到最高值,LapA-C在120 h达到最高值。LapA-T的氨基肽酶活力最高为2 476.0 U/mL(图2C),而LapA-C的酶活力最高为11 701.2 U/mL(图2D),约为LapA-T的4.7 倍。real-time PCR标准曲线的相关系数分别为0.999 8(lapA)和0.999 9(gpda),结果可靠,LapA-C的基因拷贝数是LapA-T的2.1 倍(图2E、F),提高了基因插入的拷贝数。

图2 传统同源转化方法的转化子(LapA-T)和运用CRISPR/Cas9工具转化的转化子(LapA-C)对lapA基因表达量的比较Fig. 2 Comparison of expression levels of genes in conventional homologous transformants (LapA-T) and transformants obtained using CRISPR/Cas9 (LapA-C)
2.3 重组亮氨酸氨肽酶LapA的纯化
将LapA-C转化子发酵液上清液经过亲和层析,蛋白纯化样品进行SDS-PAGE鉴定,如图3所示,条带1为发酵液原液,条带2为纯化后的亮氨酸氨肽酶样品,LapA蛋白分子质量约为35.0 kDa。
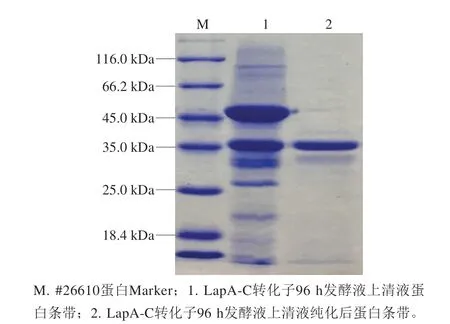
图3 重组亮氨酸氨肽酶LapA的纯化Fig. 3 SDS-PAGE profile of purified LapA
2.4 重组亮氨酸氨肽酶LapA酶学性质
2.4.1 温度对纯化后重组亮氨酸氨肽酶LapA活力的影响重组LapA在65 ℃时酶活力最高(图4A),而且在55~60 ℃时酶活力较稳定,可以保持50%以上的相对酶活力(图4B)。

图4 温度对纯化后重组LapA活力的影响Fig. 4 Effects of temperature on the activity of the purified recombinant LapA
2.4.2 pH值对纯化后重组LapA活力的影响
重组LapA在pH 8.5时酶活力最高(图5A),在酸性条件下基本没有活性,当pH值大于10,酶活力基本为0,而且在7.5~8.5时LapA酶活力较稳定,可以保持50%以上的相对酶活力(图5B)。
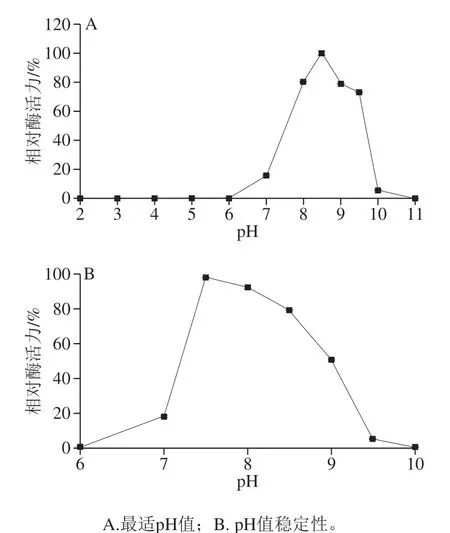
图5 pH值对纯化后重组LapA活力的影响Fig. 5 Effects of pH on the activity of the purified recombinant LapA
2.4.3 金属离子及化学试剂对重组LapA的影响
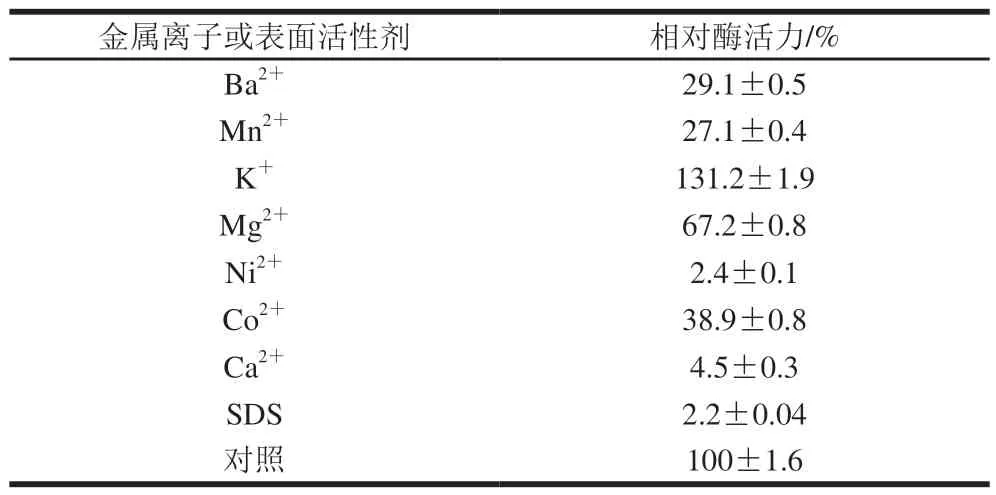
表4 金属离子及表面活性剂对重组LapA活力的影响Fig. 4 Effect of metal ions and surfactants on the activity of LapA
表4表明,在5 mmol/L浓度下,K+对该重组酶具有激活作用,而Ba2+、Mn2+、Mg2+、Ni2+、Co2+、Ca2+有明显的抑制作用,其中Ni2+、Ca2+抑制作用较为明显,而表面活性剂SDS对重组酶有明显的抑制作用。
3 结论与讨论
黑曲霉作为重组蛋白表达的重要宿主,具有蛋白分泌量大、可进行蛋白翻译后修饰及高生物安全性等优点[30]。本研究为实现异源蛋白在黑曲霉中的高效表达,通过将信号肽替换为高分泌的糖化酶的信号肽,使用强启动子(杂合启动子PnaII),增加基因拷贝数的表达策略,筛选曲霉得到高酶活力的亮氨酸氨肽酶基因,并以杂合启动子PnaII、Ttef终止子作为表达载体元件,pyrG为双向筛选标记,构建亮氨酸氨肽酶重组表达载体,经过同源重组和CRISPR/Cas9工具转化黑曲霉HL-1,提高目的基因的基因重组效率,使亮氨酸氨肽酶基因lapA的拷贝数增加,以此提高蛋白的表达量。通过PCR鉴定和测定发酵液的酶活力,筛选出成功转化的重组亮氨酸氨肽酶菌株LapA-C,达到11 701.2 U/mL,而对照组(不使用CRISPR/Cas9工具)的重组亮氨酸氨肽酶菌株LapA-T发酵液酶活力为2 476.0 U/mL,均显著高于先前的报道[15,24]。再经过亲和层析对重组亮氨酸氨肽酶LapA进行亲和层析纯化,SDS-PAGE鉴定显示LapA蛋白分子质量在35.0 kDa左右。同时验证了温度、pH值对重组亮氨酸氨肽酶LapA活力的影响,亮氨酸氨肽酶LapA在pH 8.5时酶活力最高,而且在pH 7.5~8.5时酶活力较稳定;亮氨酸氨肽酶LapA在温度65 ℃时酶活力最高,55~60 ℃时酶活力较稳定,5 mmol/L的K+对该重组酶具有激活作用。本研究的成果为食品级安全亮氨酸氨肽酶LapA的工业发酵表达量的提高提供了理论依据。后续可以进一步研究黑曲霉宿主的改造以及亮氨酸氨肽酶LapA的定点突变研究,以得到酶活力更高的黑曲霉菌株和酶学性质更稳定的亮氨酸氨肽酶。

