晚期阴茎癌围手术期化疗疗效的荟萃分析
曲弘辰 穆中一 黄焱 孙涛 杨启 王凯 胡滨
阴茎鳞状细胞癌(penile squamous-cell carcinoma, PSCC),简称阴茎癌,是一种少见的恶性肿瘤。全球范围内每年新发病例大约26 000例[1]。在以美国为代表的发达国家,每年男性恶性肿瘤患者中有0.4%~0.6%为PSCC[2],而在亚洲、非洲、南美洲等发展中国家,这一比例可高达10%[1-3]。PSCC发病率虽然较低,但死亡率却很高:对于仅有单侧腹股沟淋巴结存在转移(无区域外或盆腔淋巴结转移)、并且转移的腹股沟淋巴结数量小于2枚的患者,疾病预后较好,5年生存率可达75%~82%[4]。但是如果患者存在双侧腹股沟淋巴结转移,或单侧转移的腹股沟淋巴结数量多于3枚,或同时存在盆腔淋巴结转移,预后较差,5年生存率低于50%[5-7]。PSCC是一种侵袭性较高的恶性肿瘤,局部切除原发肿瘤只对早期肿瘤有意义。除了切除原发肿瘤外,有选择地对PSCC患者行腹股沟及盆腔淋巴结清扫术,有助于减少肿瘤复发,获得长期生存[8]。但是,对于晚期PSCC(局部晚期或转移)患者,治疗方式选择目前仍存在争议。
对于晚期PSCC(局部晚期或转移)患者的治疗,目前的指南或临床试验均推荐多模式联合治疗,如术后联合放疗、放化疗联合[9]、术后辅助化疗[10]、术前新辅助化疗[11-13]。对于存在淋巴结转移的PSCC患者,特别是存在双侧腹股沟淋巴结转移,或单侧腹股沟转移淋巴结的数量多于3枚,或存在盆腔淋巴结转移,是否应在行腹股沟及盆腔淋巴结清扫术后辅助化疗治疗,目前仍存争议。既往的相关研究大多规模较小,并且多是单中心经验[14-15],仍需更多数据去证实术后辅助化疗治疗的疗效。目前,部分研究开始尝试手术联合术前新辅助化疗,既往回顾性研究提示,对于存在淋巴结转移的PSCC患者,新辅助化疗可提高患者生存率,但其有效性仍需进一步证实[12-13]。另外化疗方案、剂量、疗程均无标准化方案,同样需进一步确定[16]。
本文拟通过纳入多项相关研究数据并进行Meta分析,评估晚期PSCC患者围手术期接受化疗(新辅助化疗或辅助化疗)的疗效,以便确定晚期PSCC多模式的治疗方案,有助于临床医师的选择,提高患者总生存率。
对象与方法
一、检索策略
计算机检索PubMed、Embase、Cochrane图书馆、Web of Science、Springer Link以及CBM等数据库,并追查所有纳入文章的参考文献。英文检索词包括“penile cancer/penile squamous-cell carcinoma”、“adjuvant chemotherapy”以及“neoadjuvantchemotherapy”。检索文献的范围从1990年至2020年。同时对于纳入文章的参考文献,我们也进行评估并筛选。
二、纳入与排除标准
纳入本研究的文献应符合如下标准:①研究的内容应是评估晚期PSCC患者围手术期化疗(辅助化疗或新辅助化疗)疗效;②研究的患者群体应是病理诊断为PSCC的患者;③文章中应提供相应原始数据,或可由文中数据计算得出;④限于英文SCI文献。若文献缺少对照组、缺少原始数据、数据不全或文章类型为病例报告、综述及会议报告,应予以排除。
三、数据提取
对于纳入文献的原始数据,安排两名研究人员单独提取。需要提取的数据包括如下内容:第一作者,发表年限,研究组与对照组人数,研究评价指标。如遇到争议问题,另外由第3名研究人员参与讨论,并共同研究解决。
四、资料分析
为保证数据处理的准确性与可靠性,由两名未参与数据提取的研究人员独立处理数据。本研究分析采用Revman 5.3软件(由Cochrane协作网提供)。对于计数资料,本研究采用相对危险度(risk ratio,RR)以及95%可信区间(95% confidence interval, 95%CI)表示。异质性分析通过I2(0%~100%)评价进行分析。如各研究间存在统计学异质性(P<0.05,I2>50%),采用随机效应模型;当组内各研究之间不存在统计学同质性时(P≥0.05,I2≤50%),则采用固定效应模型。发表偏倚采用“倒漏斗图”进行分析,如为非对称性倒漏斗图,则表示可能存在发表偏倚。
结 果
一、纳入研究的特征
最终,共有9篇文章[17-25]纳入此次Meta分析中。9篇文章的发表年限均从2010年至2020年,共有77例患者接受了术后辅助化疗,207例患者接受了术前新辅助化疗。所有患者均符合纳入标准。纳入文章的一般特征见表1。
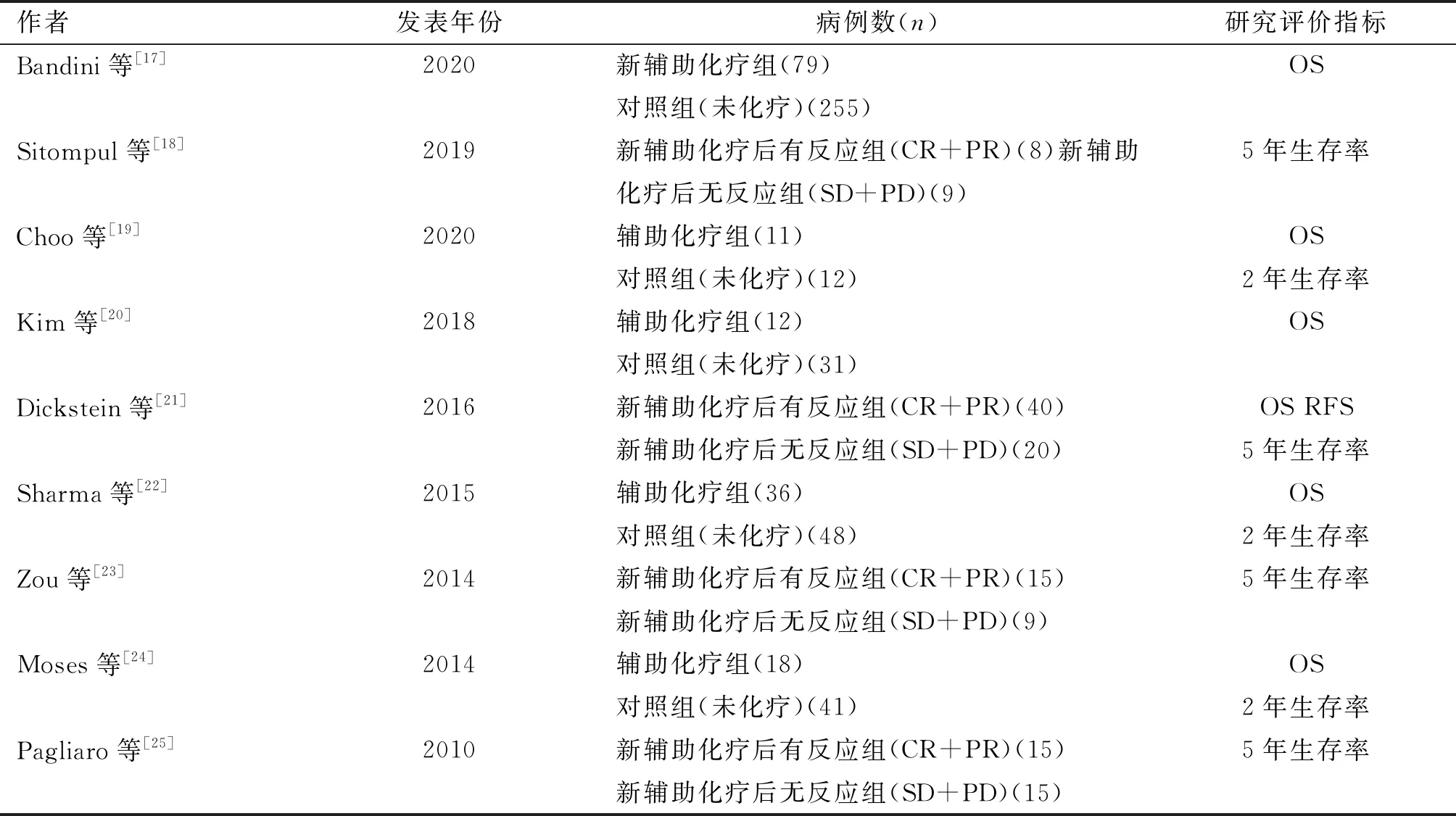
表1 纳入文献的一般特征
二、辅助化疗组vs.对照组(单纯手术组)
图1显示了辅助化疗组与对照组对于PSCC患者总生存期(overall survival, OS)的获益情况。结果显示辅助化疗对于提升总生存的获益并无统计学差异(RR=0.94,95%CI:0.39~2.25,P=0.89)。图2显示了辅助化疗组与对照组(单纯手术组)患者2年生存率的比较情况。结果显示,辅助化疗对于患者2年生存率的提升差异无统计学意义(RR=1.22,95%CI:0.86~1.72,P=0.27)。
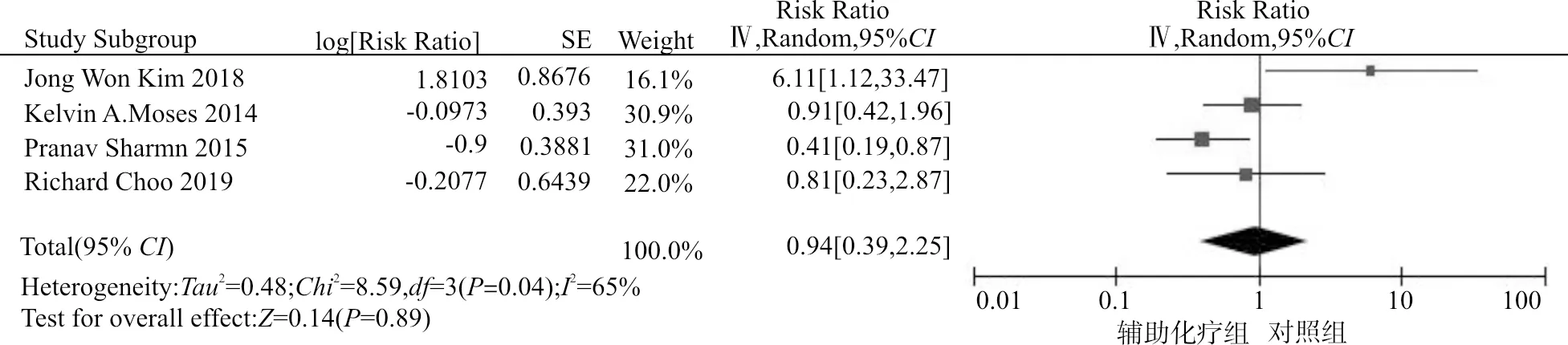
图1 辅助化疗组vs.对照组OS获益
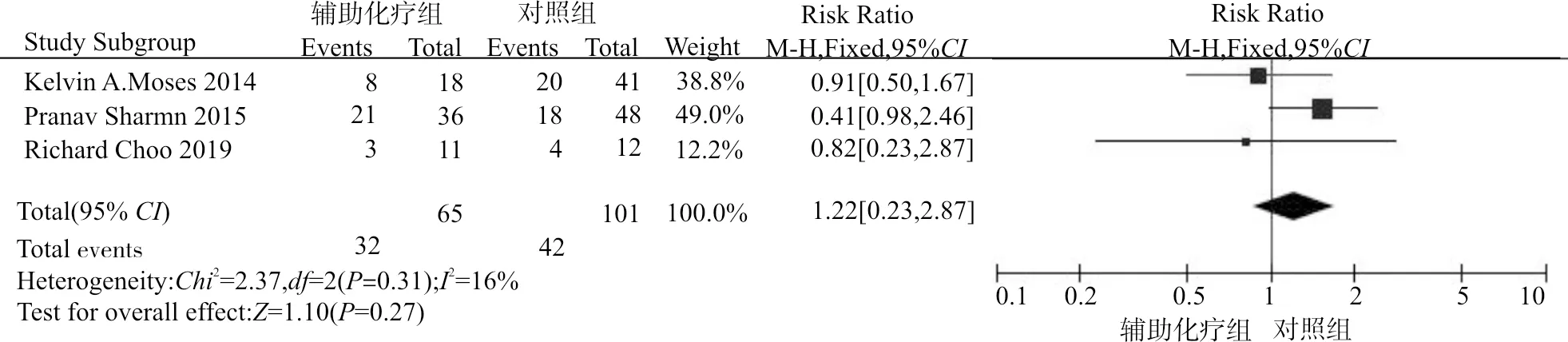
图2 辅助化疗组vs.对照组2年生存率
三、新辅助化疗组vs.对照组(单纯手术组)
图3结果显示,相比于对照组(单纯手术组),新辅助化疗组可显著提高患者OS获益(RR=0.28,95%CI:0.13~0.62,P=0.002)。

图3 新辅助化疗组vs.对照组总生存OS获益
四、新辅助化疗有反应组(CR+PR)vs.新辅助化疗无反应组(SD+PD)
图4显示应用新辅助化疗后,对新辅助化疗有反应的患者(CR+PR)与对新辅助化疗无反应的患者(SD+PD)相对比,其5年生存率及5年无疾病复发生存率的差异。结果显示,对新辅助化疗有反应的患者,其5年生存率及5年无疾病复发生存率均显著提高,结果差异有统计学意义(RR=5.51,95%CI:2.32~13.07,P=0.002;RR=4.73,95%CI:1.59~14.10,P=0.005)。图5显示应用新辅助化疗后,对新辅助化疗有反应的患者,即(CR+PR)与对新辅助化疗无反应的患者,即(SD+PD)相对比其OS与RFS的获益情况。结果显示,对新辅助化疗有反应的患者,其OS及RFS同样显著获益,结果差异有统计学意义(RR=0.25,95%CI:0.12~0.51,P<0.001;RR=0.25,95%CI:0.13~0.50,P<0.001)。
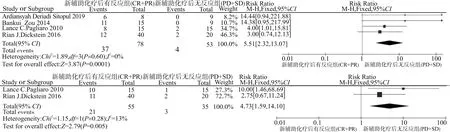
图4 新辅助化疗有反应组(CR+PR) vs. 新辅助化疗无反应组(SD+PD),5年OS率及5年RFS率

图5 新辅助化疗有反应组(CR+PR) vs. 新辅助化疗无反应组(SD+PD), OS与RFS获益
五、发表偏倚
纳入研究的发表偏倚通过倒漏斗图表示(图6)。倒漏斗图图形显示左右分布尚均匀,对称性较好,无明显发表偏移。
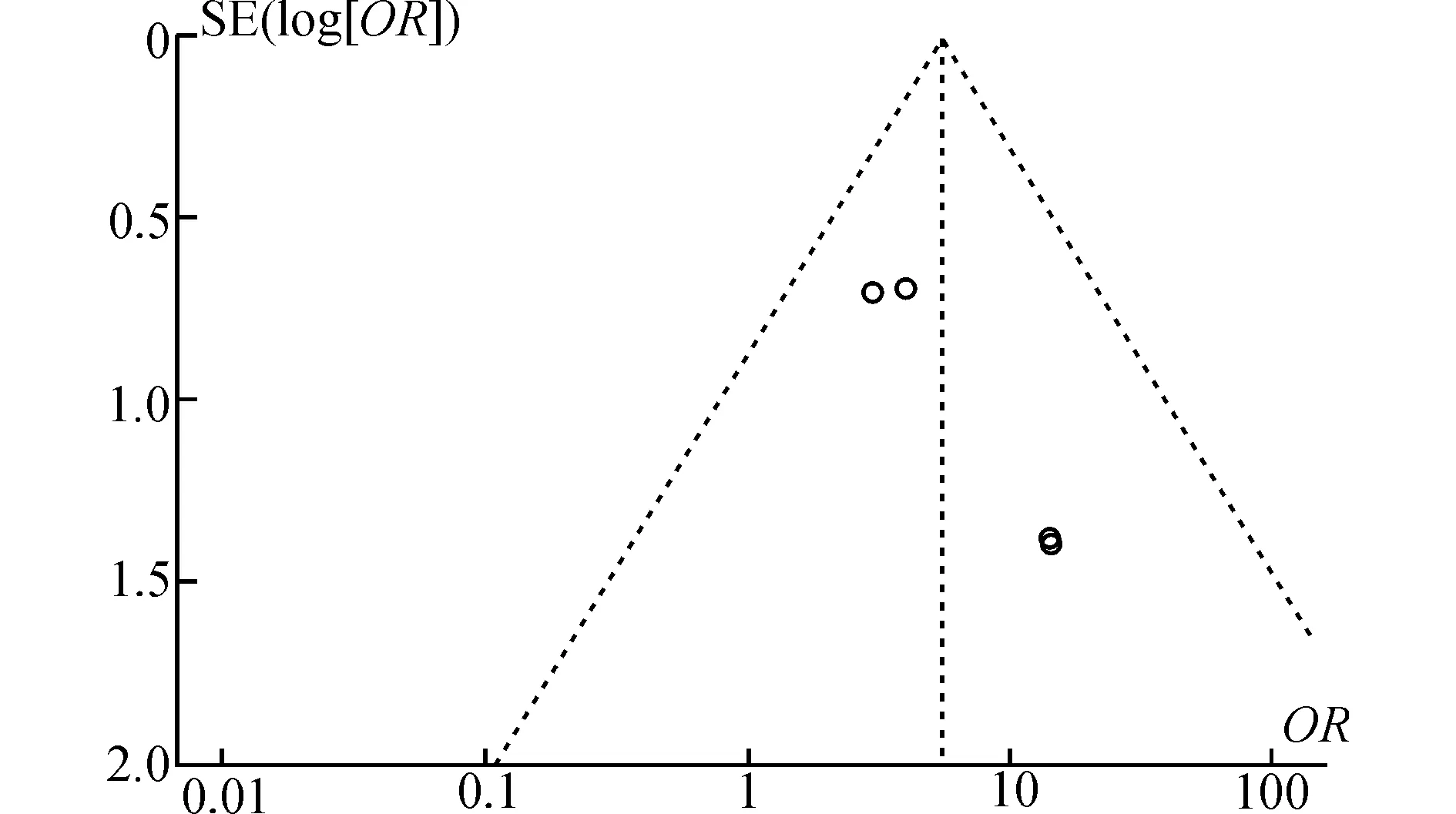
图6 发表偏倚
讨 论
对于伴有区域淋巴结转移以及远处转移的PSCC患者,仅依靠单一的手术治疗往往无法取得良好的治疗效果[25]。腹股沟区域转移淋巴结的大小、数目、是否双侧同发、是否同时伴随盆腔淋巴结转移均影响PSCC的预后[5]。目前,对于存在体积较大、固定的腹股沟转移淋巴结,以及伴随盆腔淋巴结转移的患者,预后常较差,指南往往建议手术后给予辅助治疗(放疗、化疗、放化疗联合治疗)[26]。与辅助放疗不同,术后辅助化疗并不会导致患者淋巴结水肿,并且副反应相对较低,因此辅助化疗往往被建议应用于高危患者(体积较大、固定、双侧同发的腹股沟转移淋巴结,或盆腔淋巴结转移)的术后辅助治疗[27-28]。虽然既往多项研究证实,对于晚期PSCC患者行术后辅助化疗,可以迅速获得良好的客观反应(PR患者,甚至部分患者出现CR)[29-30]。但是长期随访过程中,大量患者仍出现PD,辅助化疗的生存获益无统计学意义,对于患者1年、2年,甚至5年生存率也没有明显提高[31]。与本次Meta分析的结果相一致,患者术后行辅助化疗,不仅长期OS获益无统计学意义(RR=0.94,95%CI:0.39~2.25,P=0.89),2年生存率的提升差异无统计学意义(RR=1.22,95%CI:0.86~1.72,P=0.27)。出现这种结果可能是多种因素造成的:首先,由于PSCC发病率低,因此关于PSCC的研究难以设计成随机对照研究,往往多为回顾性研究,而术后选择应用辅助化疗的患者往往具有更高的临床分期及病理分级,甚至多为高危组患者。这类患者往往本身病情危重,预后不佳。而对于术后短期内肿瘤复发的患者,同样病情高危、预后较差,且常需接受挽救性化疗。部分研究将这类患者纳入化疗组进行研究,这也在一定程度上造成了化疗组预后较差的情况。另外对于是否选择术后进行辅助化疗,往往也取决于不同临床医师对于患者病情、对化疗耐受性的判断以及不同时期、不同地区指南的指导意见。因此,回顾性研究往往存在选择偏移问题。最后,对于不同中心的研究,其选择辅助化疗的方案不同,可能也是造成不同研究疗效差别的原因。尽管本次Meta分析结果显示术后辅助化疗对于提高PSCC患者的长期生存无统计学意义,但这并不能绝对反映术后辅助化疗无意义,仍需进一步设计大规模随机对照研究去证实。
由于化疗存在毒副作用,手术后身体虚弱的患者往往难以耐受,无法坚持完成全部周期的化疗,这也导致关于辅助化疗的研究结果往往不理想,因此更多的研究将关注投入到术前新辅助化疗中,以求可以缩小肿瘤病灶体积,以便术中获得完整的肿瘤切除效果[32]。既往研究证实,术前行新辅助化疗的患者,5年生存率可达40%~56%[12-13]。这也与本次Meta分析的结果相一致:相比于未行新辅助化疗的单纯手术组患者,新辅助化疗组可显著提高患者OS生存获益(RR=0.28,95%CI:0.13~0.62,P=0.002);而相比于对新辅助化疗无反应的患者(SD+PD),对于新辅助化疗出现良好客观反应的患者(CR+PR)可以获得OS及RFS显著获益(RR=0.25,95%CI:0.12~0.51,P<0.001;RR=0.25,95%CI:0.13~0.50,P<0.001);同样,患者的5年生存率及5年无疾病复发生存率均显著提高(RR=5.51,95%CI:2.32~13.07,P=0.002;RR=4.73,95%CI:1.59~14.10,P=0.005)。因此新辅助化疗的应用逐渐得到重视,对新辅助化疗是否有反应也成为PSCC患者治疗预后判定的一项独立预测因素。对于新辅助化疗反应良好者(CR+PR),往往在之后的手术中获得更好的生存获益,因此可在临床工作中为这部分患者选择更为积极的手术治疗方案。而对于存在器官转移或远处转移的患者仅进行姑息性化疗,甚至放化疗联合治疗,以替代手术治疗,可以减少手术带来的不必要的并发症,同样具有重要意义[25]。另外,我们同样期待更多设计良好的大规模随机对照研究去直接比较新辅助化疗组患者与单纯手术组患者的预后及不良反应发生率差别。
选择不同的化疗方案作为新辅助化疗往往可以带来不同的客观反应率以及不良反应发生率[12,33],目前尚无统一标准的新辅助化疗方案、剂量及周期,尚需设计大规模随机对照研究,根据化疗方案的疗效及副反应发生率去制定标准的新辅助化疗方案。
对于新辅助化疗无反应组的患者(SD+PD),其预后也存在较大区别。Dickstein等[21]结果提示,对于新辅助化疗SD的患者,在新辅助化疗后行相关手术治疗可获得41个月的OS和31个月的RFS;而对于新辅助化疗PD的患者,其平均生存仅为11个月。因此,对于在新辅助化疗期间PD的患者,姑息性手术治疗的意义极其有限,不应常规进行。对于这部分患者,可考虑其他治疗方案,如放疗、EGFR靶向治疗或PD-1免疫治疗[34-35]。
虽然经过严格设计和统计学分析,但本研究仍存在诸多局限性:①PSCC发病率低、样本量相对较小,相关研究的设计往往只能进行回顾性研究,而非前瞻性随机对照研究,尚需设计良好的大规模随机对照研究去证实进一步验证辅助化疗及新辅助化疗对于晚期PSCC患者的治疗意义;②由于PSCC发病率低,因此目前相关研究开展较少,故本次Meta分析纳入的研究数相对较少,且个别研究中的病例数较少;③目前尚无统一的标准化疗方案,不同研究中心采用的化疗方案不同,同时,不同术者的手术技术和方式存在差别,随访方案及研究观察终点指标不同,这些都可能对本次Meta分析的结果造成影响;④由于相关研究多为回顾性研究,因此采用新辅助或辅助化疗的患者往往恶性程度更高,病情更危重,预后结果分析存在选择偏移;⑤PSCC患者随访时间短,失访率较高,往往无法获得详尽的数据。
尽管存在一定的局限性,但本次Meta分析研究仍证实了相比于单纯手术组,新辅助化疗组可显著提高患者OS。而应用新辅助化疗后有反应的患者(CR+PR)要比无反应的患者(SD+PD)获得更佳的5年OS及5年RFS。而辅助化疗组相比于对照组,其OS并无明显获益。因此,有选择地对适当患者应用新辅助化疗联合手术治疗,可以获得更好的生存获益。然而,由于缺少足够的数据支持,新辅助化疗方案的药物、剂量、疗程均未统一,并且如何准确筛选出对新辅助化疗反应良好的患者仍无定论。因此,尚需设计严密的大样本量、多中心、完全随机、对照良好的临床试验来进一步验证本研究结果,同时摸索出最佳用药方案,以便更好的为临床服务。

