脉冲电场协同酶解提高多孔淀粉制备效率及吸油率
余雅倩,李松南,孙纯锐,Wei Shan Lim,贾祥泽,曾新安,张斌,黄强
(1.华南理工大学食品科学与工程学院,广东广州 510640)(2.中新国际联合研究院,广东广州 510555)(3.诸城兴贸玉米开发有限公司,山东诸城 262200)(4.南洋理工大学材料科学与工程学院,新加坡 639798)
多孔淀粉因其多孔状蜂窝结构而具有良好的吸附能力,目前被广泛应用于食品、医药、农业和化工等领域[1]。多孔淀粉常用于光/热敏感型生物活性物质(如β-胡萝卜素、姜黄素以及番茄红素等)的吸附和包埋[2],以及作为肥料控释的理想壁材[3]。目前制备多孔淀粉的技术手段集中在酸水解、酶水解、湿热处理和超声波处理等方法[4]。酶水解法具有专一高效、反应条件温和,易于调控孔隙率和工业化等特点,是目前最具应用前景的多孔淀粉制备方法[5,6]。利用α-淀粉酶和糖化酶协同制备多孔淀粉具有较高的水解效率和较好的吸附性能,在工业上已被广泛采用[7,8]。但目前而言,仅通过酶解法制备多孔淀粉,在不同的酶解条件下,时长从6~24 h不等,能源成本高且耗时较长[9]。通过对淀粉预改性,进而提高淀粉酶解效率是目前改善多孔淀粉制备工艺颇具前景的方法之一[10]。
脉冲电场(Pulsed electric field,PEF)是一种新兴的食品非热杀菌技术,可延长热敏性物料的贮藏期和改善食品的风味与质地。随着PEF技术的不断发展,其逐渐被应用于食品生产的诸多领域,如辅助提取、分子改性等[11]。在改性淀粉领域中,Hong[12]发现经过PEF改性后的乙酰化马铃薯淀粉颗粒表面会产生更多的凹陷,且随着电场强度的增强而更加明显。Li等将小麦淀粉、马铃薯淀粉和豌豆淀粉分别进行PEF处理后,发现这三种不同晶型的淀粉在经过PEF处理后分子量都有不同程度的改变,且体外消化速率上升[13]。可见,PEF改性具有改变淀粉的形貌以及内在结构的效果,在淀粉改性方面具有潜在应用前景。
本文探究了PEF改性对淀粉酶水解制备多孔淀粉制备效率和吸油率的影响,进一步考察了PEF改性对淀粉颗粒结构(形貌、晶体结构、孔容孔径和孔隙结构)的影响,为快速、高效的多孔淀粉工业化制备提供理论指导。
1 材料与方法
1.1 原料
蜡质玉米淀粉(食品级),秦皇岛骊骅股份有限公司;冰醋酸、醋酸钠(分析纯),江苏强盛功能化学股份有限公司;玉米油(食品级),嘉里粮油(中国)有限公司。异硫氰酸荧光素-葡聚糖(分子量:20 ku,分析纯),美国Sigma-Aldrich公司;复合糖化酶(酶活:60000 U/mL,HME001),安徽华明太合生物有限公司。
1.2 主要仪器与设备
SY-500脉冲电场设备,华南理工大学自主研发,最高电压20 kV,频率范围为800~1200 Hz,脉宽范围为20~80 μs;梅特勒DSC-3型差示扫描量热仪,瑞士梅特勒-托利多公司;TCS.SP5激光共聚焦显微镜,德国LEICA公司;COXEM扫描电子显微镜,韩国库塞姆公司;Mastersizer 2000激光粒度仪,英国马尔文公司;D8ADVANCE型X-射线衍射分析仪,德国Bruker公司;NOVA4200e型比表面与孔径分析仪,美国Quantachrome公司。
1.3 实验方法
1.3.1 多孔淀粉的制备
PEF改性:将蜡质玉米淀粉与去离子水在25 ℃下配置成8%的淀粉乳,添加0.5 mol/L的KCl溶液至悬浊液电导率为125±5 µS/cm;调节频率为1000 Hz,脉宽为40 μs,将淀粉乳在电场强度为40 kV/cm下,以恒定流速1.8 mL/s泵入PEF处理室,处理室体积为0.34 mL,脉冲数为 188.89;改性后的玉米淀粉乳在4000 r/min下离心10 min,取上清液用苯酚硫酸法测水解率[14]。使用去离子水将改性后的淀粉洗涤3次后置于鼓风干燥箱中45 ℃下干燥48 h,粉碎后过100目筛[15]。
酶解:称取一定质量的蜡质玉米淀粉分散于 pH为4.3的醋酸-醋酸钠缓冲溶液,配成23%(m/V)的淀粉乳,分别进行不同加酶量与酶解时间的单因素实验,具体操作如下[16]:
(1)恒定加酶量:在配置好的淀粉乳中加入基于淀粉干基的0.8×10-2mL/g的复合酶后,于56 ℃中分别酶解3、6、12、24和36 h;
(2)恒定酶解时间:在淀粉乳中分别加入淀粉干基0.4、0.8、1.2、1.6、2.0 mL/g的复合酶后,于56 ℃中分别酶解6 h。
酶解后离心20 min(4000 r/min),取上清液测定水解率;同时用无水乙醇洗涤沉淀,离心20 min,置于鼓风干燥箱在45 ℃的温度下干燥48 h,粉碎后过100目筛,即得多孔淀粉。
1.3.2 多孔淀粉吸油率的测定
将1 g玉米油与多孔淀粉以2:1(m/m,即0.2 g)的比例在4 mL的离心管中混合,称重记为M1,磁力搅拌2 min后,于4000 r/min的转速下离心10 min,弃去上清液,将离心管倒置于滤纸上以吸去浮油,重新称重记为M2,吸油率A计算公式为[17]
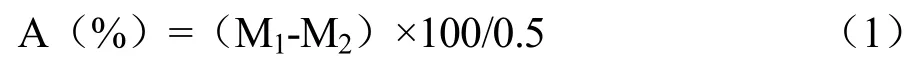
1.3.3 不同处理方式制备的多孔淀粉水解率及吸油率的测定
为更直观表现PEF改性过程对淀粉水解率及吸油率的影响,另制备原淀粉(Native)、PEF改性淀粉(PEF)、酶解淀粉(EN)和 PEF改性酶解淀粉(PEF+EN)。PEF电场强度为40 kV/cm,淀粉乳流速为1.8 mL/s,酶解时间6 h,加酶量为基于淀粉干基的0.8×10-2mL/g。对样品水解率和吸油率分别进行测定。
1.3.4 扫描电镜分析
将淀粉样品放于100 ℃烘箱中干燥8 h,去除水分,冷却后均匀分散于贴有导电胶的样品台上,真空条件下喷金处理5 min后在1000和10000放大倍数的条件下观察表面形貌并拍摄,扫描电压为20 kV。
1.3.5 差示扫描量热仪分析
准确称取3 mg淀粉样品于坩埚中,加入去离子水配成30%的淀粉乳,封盘后放置12 h以平衡水分。以空盘为对照,以10 ℃/min的升温速率扫描,扫描范围为20~90 ℃。扫描完成后,用STARs软件计算糊化初始温度To,峰值温度Tp,终止温度Tc及糊化焓值ΔHgel等特征参数。
1.3.6 结晶特性分析
用X-射线衍射测定淀粉样品的相对结晶度。取样品粉末置于长方形铝片的孔中,随后压紧。在40 kV和 40 mA 下操作,步进间隔为 0.02°,扫描速率为0.5°/min。从 5°扫描至 35°,样品的相对结晶度由PeakFit 4.0软件测出。
1.3.7 孔容孔径测定
使用NOVA4200e型比表面与孔径分析仪检测淀粉样品的比表面积、总孔体积和孔径分布。在测量前,先将淀粉样品在100 ℃下真空脱气处理5 h,除去淀粉样品表面吸附的空气;待冷却至室温后,以高纯氮气为介质,将样品管放入比表面与孔径分析仪中,随后通入氮气进行低温吸附,氮气的吸附量与样品的表面积定量相关;随着样品管的升温,淀粉吸附的氮气重新被解吸,最终达到平衡,得到吸附-脱附曲线和相关参数。
1.3.8 粒径测定
淀粉样品的颗粒粒径采用英国马尔文激光粒度仪进行分析,将0.5 g淀粉样品和10 mL蒸馏水加入到血清瓶中,剧烈振荡均匀后可滴加到仪器中进行测试,设置水的折射率为1.33,淀粉的折射率为1.52,吸收率为0.01,当激光遮光度为0.0时开始上样,在2500 r/min的转速下使加入的样品分散,待激光遮光度达到11%左右时开始测量样品。
1.3.9 激光共聚焦观察
将1 mg淀粉样品分散在1 mL FITC-葡聚糖溶液(2 mg/mL)中,于37 ℃混合3 h,然后将混合物涂布在载玻片上,使用激光共聚焦显微镜进行观测。激光共聚焦显微镜放大倍数为100×1.25。氩/氪激光器在488 nm处激发荧光。用Leica LASAF lite软件记录样品的激光扫描图像[18]。
1.3.10 数据处理及统计分析
各组实验数据重复3次测定,采用Origin 8.0进行数据处理和绘图,采用SPSS 19.0软件进行方差分析对实验数据进行检验。
2 结果与讨论
2.1 酶解时间对多孔淀粉水解率和吸油率的影响
不同酶解时间对多孔淀粉水解率和吸油率的影响如图1所示。随着酶解时间的增加(图1a),淀粉样品的水解率均呈现逐渐升高趋势;当酶解时间为3 h时,经PEF改性(PEF+EN)和对照(EN)淀粉样品的水解率分别为17.41%和10.20%,此时两组水解率的差异最大。随着酶解时间延长,两者水解率趋于接近。当酶解时间在24 h和36 h时,未经PEF改性多孔淀粉的水解率分别为28.71%和29.71%;经PEF改性多孔淀粉的水解率分别为30.51%和31.61%,均无显著差异,说明水解率的差异主要反映在酶解过程的前期,PEF改性主要影响酶解初期的反应速率。
随着酶解时间的增加(图1b),未经PEF改性的多孔淀粉吸油率随着酶解时间的延长呈现逐渐升高的趋势,在24 h达到最高值145.29%,趋势与图1a中随酶解时间增加的水解率一致。这是由于淀粉酶解过程中,淀粉颗粒逐渐形成可以截留油脂的空腔;进一步酶解的情况下,部分酶解较快的淀粉颗粒开始崩解成细小淀粉颗粒碎片,吸油率不再增加。经过PEF改性的淀粉颗粒酶解6 h即可达到最高值,为145.11%(图1b),与原淀粉酶解24 h制备的多孔淀粉的吸油率没有显著差异(p<0.05),这说明在酶解制备多孔淀粉的工艺中,引入PEF改性过程能缩短酶解时间,提高酶解效率,降低酶解过程中的能源损耗。

图1 酶解时间对多孔淀粉的水解率(a)和吸油率(b)的影响Fig.1 Effect of enzymolysis time on the hydrolysis rate (a) and oil absorption (b) of porous starch
2.2 加酶量对多孔淀粉水解率和吸油率的影响
固定酶解时间为 6 h,不同加酶量对多孔淀粉水解率和吸油率的影响如图2所示。随着加酶量的增加,经PEF改性多孔淀粉(PEF+EN)的水解率相比对照组(EN)更高,且表现出持续增加的趋势(图2a)。当加酶量为淀粉干基的0.4×10-2mL/g时,对照组水解率为 9.14%;而经 PEF改性后多孔淀粉水解率为14.08%,有显著提升。随着加酶量的增加,二者之间水解率差异减小,说明PEF改性的优势主要体现在水解程度较低的时候,也就是无定形区被逐渐水解的时期。当加酶量为1.6×10-2mL/g且水解程度接近30%时,经 PEF改性的多孔淀粉水解率与对照组无显著差异(p<0.05),与图1a中PEF改性组对应的酶解时间为24 h的结果相近,说明了增加酶解时间或加酶量均能提高PEF改性多孔淀粉的水解效率。
图1b中,经PEF改性的多孔淀粉(PEF+EN)与未经改性的多孔淀粉(EN)的吸油率都随着加酶量的增加而呈现上升的趋势;在吸油率达到 145%以上后其数值不再增加,与图1b中酶解24 h的两种样品的吸油率无显著差异(p<0.05),说明吸油率增加到一定程度,增加酶解时间或增大加酶量不会再增加多孔淀粉的吸油率。黄强等[19]在探究酶解多孔淀粉的水解率与吸油率的相关性时,也发现了类似的现象。经PEF改性后,加酶量为0.8×10-2mL/g时,多孔淀粉的吸油率达到 145.11%(图 2b),而对照样的吸油率仅为119.47%;提高加酶量至1.2×10-2mL/g时,对照样的吸油率才达到145.27%,说明PEF预改性能增加淀粉颗粒对复合糖化酶的敏感性,降低了酶使用量,节省了工业成本。
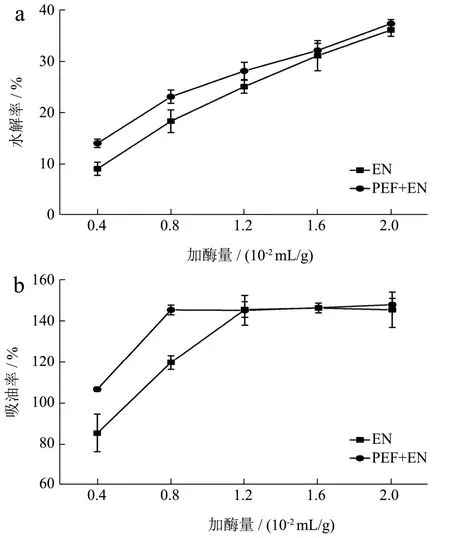
图2 加酶量对多孔淀粉的水解率(a)和吸油率(b)的影响Fig.2 Effect of enzyme amount on the hydrolysis rate (a) and oil absorption (b) of porous starch
2.3 PEF改性对多孔淀粉水解率和吸油率的影响
PEF改性对多孔淀粉水解率及吸油率有显著影响(图3)。蜡质玉米原淀粉具有一定的吸油性,吸油率为 74.40%,这是由于淀粉颗粒表面存在着天然的微孔。有研究者认为这些微孔有利于淀粉颗粒的水解,是酶解的最初反应位点[20]。单独PEF改性使原淀粉轻度水解,水解率为0.86%,其原因可能是在脉冲电场作用下,带电粒子发生移动,并聚集在淀粉颗粒表面,形成空间极化电荷;随着PEF电压的不断升高,在淀粉颗粒的表层产生瞬时高压放电,导致淀粉颗粒外层破裂,支链淀粉断裂析出,结晶区结构被破坏[21]。单纯经过 PEF改性后,多孔淀粉的吸油率提升至79.76%,而PEF协同酶解制备的多孔淀粉水解率和吸油率都显著高于对照样,这与图1、图2的结果一致。

图3 不同处理方式对淀粉颗粒的水解率和吸油率的影响Fig.3 Effects of different treatments on the hydrolysis rate and oil absorption of starch granules
2.4 扫描电子显微镜观察淀粉颗粒形貌
不同处理方式的淀粉样品SEM图谱如图4所示。蜡质玉米原淀粉为表面完整平滑的多角型,部分颗粒表面出现少量细小孔洞。经过PEF改性后,淀粉颗粒表面发生变化,呈现出更多的凹槽,这导致α-淀粉酶与糖化酶更容易进入淀粉颗粒内部进而发生酶解反应,这与 Wu[22]等的研究结果一致。同时,相比原淀粉(Native)与PEF预处理淀粉(PEF),酶解后的淀粉样品(EN和PEF+EN)从多角形转变为更加规整的椭球形且颗粒粒径变小,这可能是因为在酶解过程中淀粉颗粒表面的多角结构发生了水解,同时减小了颗粒的粒径。
多孔淀粉对照样(EN)颗粒表面出现尺寸均匀的蜂窝状孔洞,酶解6 h的水解率为18.38%;而经过PEF改性的多孔淀粉孔洞明显增大,形成了连续甚至贯穿的孔洞,但仍然保持了淀粉颗粒的完整性,对应的水解率为23.11%。较大的孔洞和相对完整的淀粉颗粒结构可能是PEF改性能提高酶解多孔淀粉吸油性能的原因。
图4 不同处理方式对淀粉颗粒形貌的影响Fig.4 Effect of different treatments on the morphology of starch granules
2.5 热力学性质分析
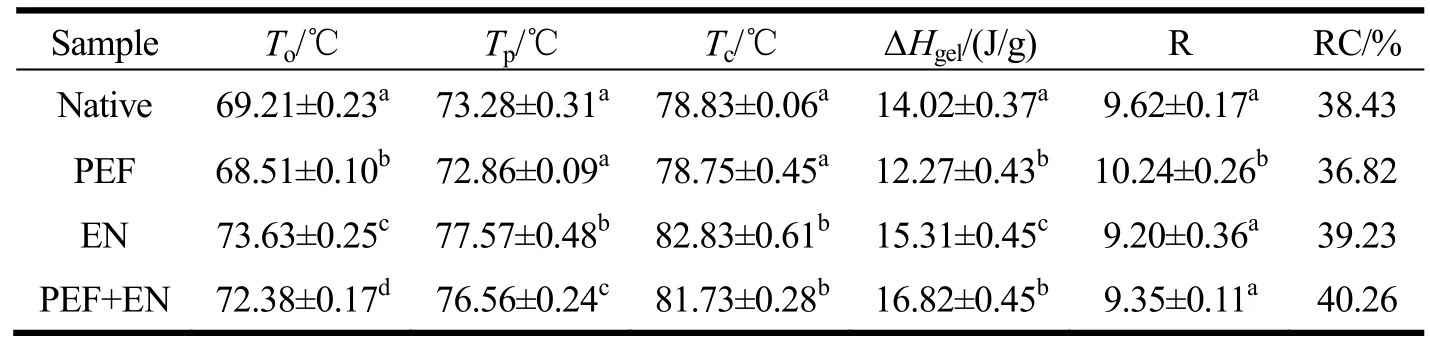
表1 不同处理方式对淀粉颗粒的热力学性质的影响Table 1 Effect of different treatments on the thermal properties of starch granules
不同处理方式对淀粉颗粒的热力学性质(糊化温度及其焓变参数)的影响如表1所示。酶解改性的多孔淀粉相对于原淀粉具有更高的To、Tp、Tc和△Hgel,这可能是因为酶解更多地发生在淀粉颗粒的无定形区,致密淀粉结晶结构需要更高的温度和能量才能糊化,这与Dura等人[23]的研究结果一致。经过酶解后,制备的多孔淀粉(EN)与 PET改性多孔淀粉(PEF+EN)相对结晶度增加,原淀粉的相对结晶度从38.43%增加到39.23%,PEF改性后的淀粉颗粒酶解前后的相对结晶度从36.82%增加到40.26%,这归因于淀粉颗粒中的无定形区被优先水解,使其结晶区域相对增加,因此经过酶解制备的多孔淀粉颗粒相对结晶度更高。PEF改性以后,多孔淀粉的△Hgel有所降低,这可能是由于PEF破坏了淀粉颗粒内部分致密的结晶区,降低了淀粉的相对结晶度;糊化温度范围(R)同时也有所增加。据文献报道[24-26],R值是反映淀粉结晶质构和均一性的指标,代表结晶区的大小、稳定性、完整性和紧密程度。淀粉颗粒经PEF改性之后,R值增加,意味着淀粉结晶区稳定性和均匀性降低。由此推断,在脉冲电场作用下,能量相对低、结合不够紧密的结晶区域被破坏,使淀粉颗粒结构更加松散。热力学研究结果与图1a中PEF改性对多孔淀粉水解率影响的结果一致:PEF改性可能导致部分致密的结晶区域变得更为松散,使得原淀粉相对结晶度降低,淀粉颗粒结构更加疏松,从而增加了酶促反应的作用位点,使酶解速度加快。此外,在图1a中,淀粉前12 h的水解速度较快,归因于PEF改性对淀粉颗粒结构产生的影响,而酶优先水解淀粉颗粒的无定形区[27,28],导致水解速率的相对增加;随着酶解时间的延长,底物浓度降低,水解速率逐渐降低并趋于平缓。
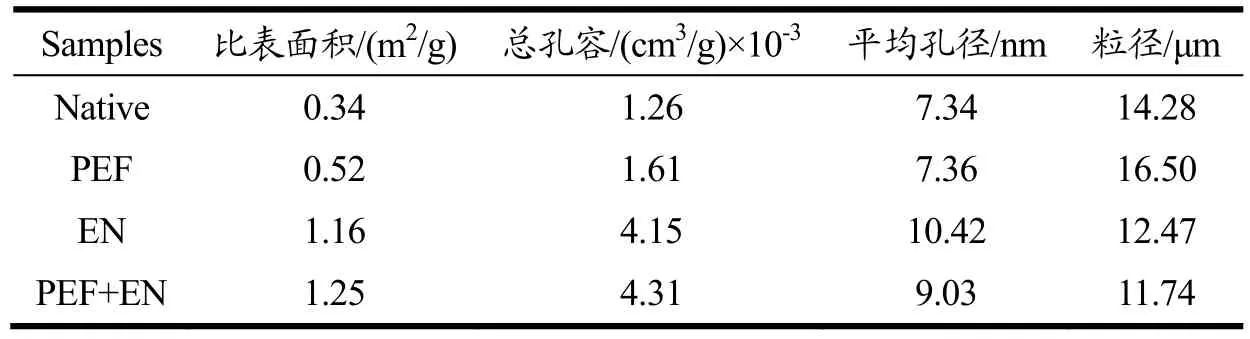
表2 不同处理方式对淀粉颗粒的内部孔径结构的影响Table 2 Effect of different treatment methods on the internal pore structure of starch granules
2.6 淀粉孔容孔径及粒径分析
通过BET和BJH法可计算得到淀粉样品的比表面积、孔径大小和总孔体积,结果如表2所示。蜡质玉米原淀粉表面存在天然的微孔,总孔容为1.26×10-3cm3/g。PEF改性增加了淀粉颗粒的比表面积、粒径、总孔容以及平均孔径;比表面积从 0.34 m2/g增加到0.52 cm3/g,促使图1a中水解反应开始之前,由于比表面积以及粒径的增加,底物与酶分子之间在淀粉颗粒的表面有着更多的接触位点,因此在水解反应初期,经 PEF改性的淀粉颗粒水解速率更快。Kim等人[29]分析了不同比表面积的土豆淀粉、蜡质玉米淀粉以及大米淀粉酶解过程的水解速率,得出了相同的结论,即比表面积更大的淀粉颗粒在反应初期有着更高的水解速率,底物与酶分子间更多的接触位点主导着淀粉酶解的初始阶段。酶解过程使原淀粉及PEF改性淀粉的比表面积、总孔容、平均孔径都有所增加,这与Zhu[30]等的研究结果一致。所有样品中,PEF+EN样品的总孔容最大(4.31 cm3/g×10-3),是原淀粉(1.26 cm3/g×10-3)的3.42倍,与图4中PEF+EN样品颗粒表面有着更大更深的孔洞结果一致,从而导致PEF协同酶解制备的多孔淀粉具有更高的吸油率,Lisa等[31]认为,对于应用于活性物质包埋的多孔材料而言,更大的总孔容意味着能够吸附更多的有机溶剂或油脂,实现了对活性物质更高的包埋率。
2.7 激光共聚焦显微分析
为探究PEF改性对淀粉颗粒内部结构的影响,选用分子尺寸与α-淀粉酶和糖化酶相近(分子直径约6.4~6.6 nm)的荧光染料FITC-葡聚糖模拟淀粉酶进入淀粉的过程。图5中激发出绿色荧光的物质为FITC-葡聚糖分子。由图5可知,蜡质玉米原淀粉颗粒内部FITC-葡聚糖发出的绿色荧光信号较弱,表明PEF改性使 FITC-葡聚糖分子更易于进入淀粉颗粒内部。这种现象归因于PEF改性后,淀粉颗粒粒径增大,比表面积增加,酶分子与淀粉颗粒表面有了更多的接触面积,解释了图1a中水解初期经PEF改性的淀粉颗粒水解率更高的一部分原因是淀粉颗粒内有着更高的酶浓度;同时图2a中,更多的α-淀粉酶进入到经PEF改性的淀粉颗粒内部,使得酶浓度成为影响水解初期反应速率的主要因素。

图5 蜡质玉米原淀粉和PEF改性淀粉颗粒的激光共聚焦显微图Fig.5 Fluorescence images of the internal structure of PEF pre-treated starch and raw starch particles
3 结论
PEF改性导致蜡质玉米原淀粉的表观形貌和内部结晶结构发生改变,主要表现在颗粒表面出现凹槽状结构、粒径增加、内部结晶度降低,有利于淀粉酶更容易进入淀粉颗粒内部并优先水解PEF改性过的淀粉区域,进而表现出更高的水解率和油吸附能力。PEF改性对于提高酶解多孔淀粉的酶解效率,减少加酶量和降低酶解时间有显著效果。该改性方式为工业上降低多孔淀粉生产成本提供了新思路,对多孔淀粉新工艺的开发提供了理论依据。

