真空微波干燥过程中南瓜果胶性质变化与质构的关系
张钟元,聂梅梅,肖亚冬,李大婧,宋江峰,刘春泉,王晓燕,刘春菊,徐亚元,牛丽影,江宁
(江苏省农业科学院农产品加工研究所,江苏南京 210014)
脱水果蔬的质构是重要的品质属性,对消费者的可接受性有较大影响。影响脱水果蔬质构特性的外在因素包括原料成熟度、脱水条件等,内在因素包括其水分含量、孔隙大小等,而在微观结构上,研究表明细胞壁的化学成分相互作用会影响脱水果蔬的质构[1]。果胶是构成细胞壁的主要多糖物质,控制着细胞壁孔隙及细胞间粘结和组织结合[2]。果胶在加工过程变化显著,可有效调控细胞结构特性。研究发现果胶的含量和性质的变化与脱水果蔬质构关系密切[3]。
干燥方式诱导细胞壁果胶降解和组分改变,果胶的结构和分子交联方式可能是影响脱水果蔬质构的重要因素,进而导致脱水果蔬质构发生改变。大量研究表明不同干燥方式对果胶性质影响不同[4-6],Monsoor等[7]研究比较了喷雾干燥、冷冻干燥和真空干燥对大豆皮果胶性质的影响,表明真空干燥制备的果胶的色泽较差,而不同干燥方法对果胶的溶解度和流动性没有显著影响。刘佳[8]研究发现微波干燥相比热风干燥所获得的苹果皮渣中果胶酯化度和半乳糖醛酸含量较高。刘江等[9]研究表明热风干燥、真空干燥、冷冻干燥及喷雾干燥对柠檬果胶结构没有显著影响,但不同干燥后的果胶各指标均存在显著性差异,其中真空干燥得到果胶酯化度较高、色差值较小。然而对于干燥过程中果胶性质的变化对质构影响的研究较少,肖敏等[3]研究表明压差闪蒸处理过程中果胶发生解离、转化,进而使组织产生多孔状结构,因此获得脱水苹果片脆度大,而热风干燥过程中水溶性果胶含量较高,导致产品组织结构致密。探究不同干燥过程中果胶性质变化对调控脱水果蔬的质构具有重要意义。
真空微波干燥由于降低了干燥温度又加快干燥速率被广泛应用[10]。微波辐射产生热效应使细胞壁多糖尤其是果胶的物化性质改变,使果胶发生β-消除反应、去甲酯化等,破坏原有果胶结构[11]。然而真空微波干燥过程中果胶特性的变化对脱水果蔬质构的影响并不明确。因此,本实验以南瓜为研究对象,采用真空微波干燥方式进行处理,基于果胶特性的变化,结合南瓜微观结构,分析真空微波干燥对南瓜质构的影响,为获得高质量的果蔬干制品提供理论依据。
1 材料与方法
1.1 材料与试剂
供试南瓜品种为‘蜜本南瓜’,购于南京市孝陵卫集贸中心。
1-苯基-3-甲基-5-吡唑啉酮(PMP)、单糖(鼠李糖、岩藻糖、阿拉伯糖、木糖、甘露糖、果糖、葡萄糖、半乳糖)标准品购于Sigma公司;甲醇标准品购于Aladdin公司;1,2-环己二胺四乙酸(CDTA)购于麦克林公司;美国光谱医学即用型透析袋购于上海桥星贸易有限公司;乙醇氧化酶(OA)购于上海源叶生物科技有限公司。
1.2 仪器与设备
VDM-1型真空微波干燥设备,南京孝马机电设备厂;CT3质构仪美国Brookfield公司;1200高效液相色谱仪,美国安捷伦科技有限公司;BS224S电子分析天平,北京赛多利斯科学仪器公司;SHZ-D(Ⅲ)循环水式真空泵,上海东玺制冷仪器设备有限公司;RE52CS旋转蒸发仪、B-226恒温水浴锅,上海亚荣生化仪器厂;D10氮气吹扫仪,杭州奥盛仪器有限公司;FW100高速万能粉碎机,天津市泰斯特仪器有限公司;DW-86L828型超低温保存箱,青岛海尔股份有限公司;Quanta-200环境扫描电子显微镜,美国FEI公司。
1.3 样品处理
严格挑选新鲜、大小形状均一、无机械损伤、无生理病害的南瓜,清洗、去皮,南瓜需去除瓜籽及瓜瓢,后切成厚度约为7±2 mm的薄片。
分别称取南瓜各200 g,采用微波间歇比为1的间歇加热方式,真空度为-90 kPa,选取6、9、12、15 W/g等4个不同微波强度,将南瓜干燥至干燥终点(水分含量<5%),装入自封袋,置于干燥器中备用。
1.4 硬度脆度测定
硬脆度测定采用CT3质构仪:选用TA-TPB夹具、TA7刀具探头;目标类型:距离;目标值:10.00 mm;测试速度:0.50 mm/s;触发点负荷:10 g;在此条件下测定干燥后南瓜脆片的硬度和脆度。硬度是在压缩过程中坐标图中出现的最大压力峰值,力越大,硬度越大,单位为 g;在第一次压缩过程中若是产生破裂现象,曲线中出现一个明显的峰,此峰值就定义为脆度,力越小,脆度越大,单位为g。
1.5 扫描电镜观察
用双面胶将干燥后的南瓜分别粘附于循环样品板上,对断面喷金,利用扫描电子显微镜观察南瓜的微观结构[12]。所有样品的观察均在低真空状态下进行。
1.6 果胶的提取与测定
本实验乙醇不溶物(alcohol-insoluble residue,AIR)的提取方法以McFeeters与Armstrong[13]的文献报道中的方法为基础,并稍作修改而成;三种果胶的提取参考Willemsen[14]与Jianyong Yi[15]的方法,并稍作修改。称取真空微波干燥后样品各20 g,剪碎后置于研钵中研磨,随后置于200 mL锥形瓶中,加入60 mL 95%乙醇,均质10 min,过滤,收集滤渣,加入40 mL 95 %乙醇,均质10 min,过滤,收集滤渣,加入40 mL丙酮,置于震荡培养箱中震荡(37 ℃)5 min,过滤,收集滤渣,置于干燥箱(40 ℃)中干燥16 h,获得干燥的AIR。准确称取0.5 g AIR置于250 mL烧杯中,加入100 mL沸水,于100 ℃的恒温水浴锅中煮沸10 min,冷却至室温,过滤,收集滤液,透析(72 h)、冻干(48 h)后获得干燥的水溶性果胶(water-solute pectin,WSP);收集滤渣。取全部滤渣于250 mL烧杯中,加入100 mL 0.05 mol/L 的CDTA(pH=6.5),28 ℃下震荡反应6 h,过滤,收集滤液,透析(72 h)、冻干(48 h)后获得干燥的螯合性果胶(CDTA-solute pectin,CSP);收集滤渣。取全部滤渣于250 mL烧杯中,加入100 mL 0.05 mol/L的碳酸钠溶液(含有0.02 mol/L硼氢化钠),在4 ℃下培养16 h后在28 ℃下培养6 h,过滤,收集滤液,透析(72 h)、冻干(48 h)后获得干燥的碱溶性果胶(Na2CO3-solute pectin,NSP)。总果胶(total solute pectin,TSP)为三种果胶的总量。
三种果胶含量测定参考 Blumenkrantz等[16]的方法,采用分光光度法测定525 nm处的吸光度,绘制半乳糖醛酸(Galacturonic Acid,GalA)标准曲线。果胶含量的测定:吸取1.5 mL滤液置于25 mL具塞玻璃试管中,依次加入1.5 mL蒸馏水、0.75 mL咔唑乙醇溶液,连续摇动试管,迅速加入15 mL硫酸,盖好磨口玻璃塞,摇匀。将试管置于 85 ℃的恒温水浴锅内水浴20 min,冰浴,冷却至室温后于分光光度计525 nm处测定吸光度。根据上述标准曲线计算果胶含量。
1.7 单糖组成的分析
利用 PMP柱前衍生化法测定中性糖(岩藻糖、鼠李糖、阿拉伯糖、半乳糖、葡萄糖、木糖、甘露糖)的含量,参考武忠伟[17]的方法进行试验,具体步骤如下:多糖样品酸水解:称取5 mg冻干样品,用蒸馏水配成5 mg/mL,取100 μL加入到2 mL具塞玻璃管中,加入100 μL 4 mol/L三氟乙酸(TFA)并充氮封管,在100 ℃条件下水解2 h,冷却至室温,加入200 μL甲醇于50 ℃减压蒸干,重复3次,加100 μL蒸馏水溶解后备用。
PMP衍生化:向上述水解后的样品加入0.6 mol/L NaOH溶液100 μL,混合均匀后取该溶液100 μL与5 mol/L的100 μL PMP甲醇溶液旋涡混匀,置于70 ℃下反应100 min,冷却至室温,加入50 μL 0.3 mol/L HCl溶液中和反应液,于50 ℃下减压蒸干,加入1 mL蒸馏水溶解,用氯仿反复萃取以除去其中过量的PMP,经0.45 μm滤膜过滤后,置于超低温冰箱,待液相分析使用。
HPLC检测条件:Agilent 1100高效液相色谱仪;RP-C18 柱(4.6×250 mm,5 μm Venusil,USA);柱温30 ℃;流动相为比例为83:17(V/V)的0.1 mol/L PBS(pH=6.7)和乙腈;流速1.0 mL/min;检测波长245 nm。
1.8 果胶分子量分布的测定
样品的分子量分布及分子量测定采用高效液相凝胶渗透色谱法,具体方法根据Wang等[18]稍作修改,具体操作如下:色谱条件:Agilent 1100高效液相色谱仪,TSL-Gel G3000 SWXL色谱柱;示差折光检测器(RID);流动相为含0.1 mol/L Na2SO4的0.01 mol/L PBS(pH=6.8);流速0.8 mL/min;柱温25 ℃;进样体积 20 μL。
1.9 β-消除反应程度的测定
取0.05 g AIR样品与30 mL的去离子水混合置于100 ℃水浴锅中,5 min后取出,冷却至室温。调节pH到6.5,过滤,收集滤液,于分光光度计235 nm处测定吸光度值。吸光系数为5412 M-1cm-1,无水半乳糖醛酸的分子量为176[19]。
1.10 果胶酯化度的测定
果胶酯化度为皂化过程中甲醇生成量与细胞壁果胶半乳糖醛酸含量的比值。根据 Yi等[20]方法做稍微调整,吸取90 μL果胶溶液置于具塞玻璃试管中,加入75 μL 1 mol/L NaOH进行皂化反应,25 ℃条件下反应30 min后用0.75 mol/L的硫酸调节pH值至7.5。分别向试管中依次加入270 μL 0.2 mol/L磷酸缓冲液(pH 7.5)、30 μL 乙醇氧化酶(1 unit/mL),置于摇床中(25 ℃)培养15 min,然后向混合液中加入6 mL乙酰丙酮溶液(0.02 mol/L 2,4-乙酰丙酮溶于2.0 mol/L乙酸铵和0.05 mol/L乙酸溶液中),于58 ℃恒温水浴锅中反应15 min。冷却至室温后于412 nm处测定吸光度。以甲醇为标准物,配制标准曲线。
1.11 数据统计与分析
各实验结果均以“平均值(means)±标准差(SD)”表示。应用SAS软件进行单因素方差分析及组间差异的Duncan’s多重比较。利用Origin Pro V8.5软件绘制曲线。
2 结果与分析
2.1 真空微波干燥对南瓜硬度脆度的影响
本实验选用硬度和脆度两个指标来描述真空微波干燥后南瓜的质构。从表1可见,经过不同微波强度处理后,南瓜的脆度和硬度存在显著差异。微波强度为9 W/g时,南瓜的脆度值较小,为723.00 g,产品酥脆性较好。南瓜的硬度值随微波强度增加而上升,分析原因可能是随微波强度升高,表面温度比内部高,内部在水分转移到表面之前,细胞收缩,在表面迅速形成一层硬膜,因此硬度升高。不同微波强度对不同物料影响不同,如微波强度为12 W/g时,获得的苹果片感官品质较好[21],这可能与物料性质差异有关。
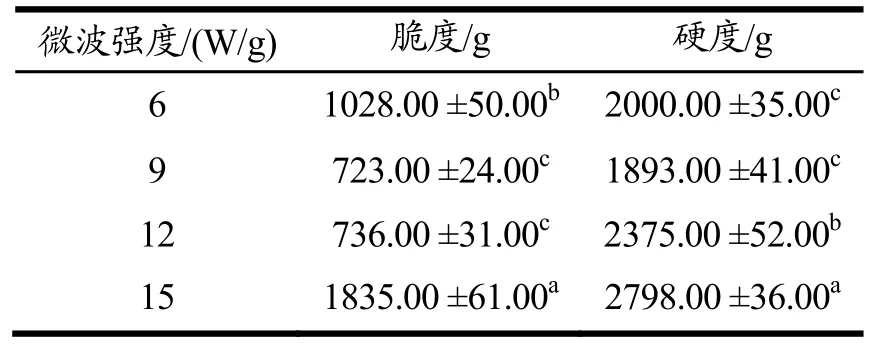
表1 不同微波强度条件下南瓜的硬度和脆度Table 1 Hardness and crispness of pumpkinunder different microwave power density
2.2 真空微波干燥对南瓜微观结构的影响
图 1为不同微波强度条件下南瓜的扫描电镜图(×100倍)。真空微波干燥后的南瓜形成大小不均的多孔状结构,出现断裂,微波强度为12 W/g时,细胞壁破坏较明显,形成大小不均的多孔状结构,排列密集。经真空微波干燥处理后,南瓜能够形成多孔状结构。这是因为微波能够穿透南瓜细胞,导致水分子的震动剧烈,使南瓜内部的水分直接汽化,细胞组织在压力的作用下膨胀破裂产生孔状结构。

图1 不同微波强度条件下南瓜的扫描电镜图Fig.1 Scanning electron micrograph of pumpkinunder different microwave power density
2.3 真空微波干燥对南瓜果胶含量的影响

表2 不同微波强度条件下南瓜中果胶的含量Table 2 Pectin extraction yields of pumpkin under different microwave power density
经真空微波干燥后的南瓜中三种果胶含量下降显著。由表2可以看出,南瓜中三种果胶的含量变化情况存在一定的差异性:三种果胶含量随微波强度的升高变化趋势不同,随着微波强度的升高,WSP含量先减少后增加,CSP含量先增加后减少,NSP含量显著下降(p<0.05)。其中,微波强度为9 W/g时,干燥后的南瓜中WSP含量显著降低(p<0.05),达到65.13 mg/g AIR,与对照组显著降低56.23%,而CSP含量显著升高(p<0.05)。这表明真空微波干燥使果胶物质流失或发生降解,这将引起果胶对物料组织支撑作用下降,导致物料粘弹性和可塑性增加[3],同时微波处理水分散失速度较快,容易形成较多的孔状结构,这与江宁等对甘薯片研究结果相似[22]。
2.4 真空微波干燥对南瓜果胶单糖的影响
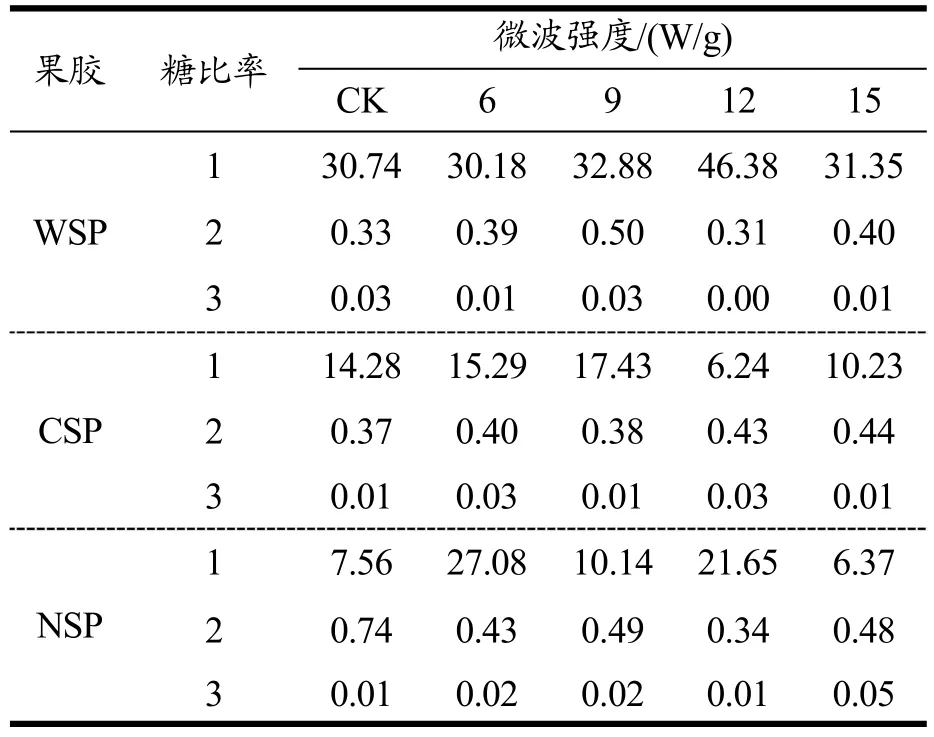
表3 不同微波强度条件下南瓜果胶的糖比率Table 3 The sugar ratios of pectin in pumpkin under different microwave power density
果胶分子主要以半乳糖醛酸为主链,其他单糖主要参与构成果胶侧链,因此可以用不同单糖之间的比值关系来表达果胶的相关结构信息,如糖比率1可以反映鼠李聚半乳糖醛酸Ⅰ支链与鼠李糖的比值;糖比率2可以反映果胶的线性度;糖比率3能够反映主链的变化,即鼠李聚半乳糖醛酸类型果胶在全部果胶中所占的比例[23,24]。由表3可知,真空微波干燥后的南瓜的糖比率变化情况明显,说明真空微波干燥对其细胞壁果胶的组分变化有显著影响(p<0.05)。真空微波干燥后的南瓜的NSP的糖比率1变化显著,说明真空微波干燥对果胶结构产生较大的影响,改变了NSP的结构,减小了其与细胞壁其他物质之间的粘结作用力。根据糖比率2可知,与鲜样相比,CSP的线性度均有不同程度的增加,说明在真空微波干燥过程中,发生了果胶间的转化,有线性度较大的CSP的生成;南瓜NSP的糖比率2均低于南瓜鲜样,说明NSP分子的线性度下降;而糖比率3均较低,其中CSP与NSP的糖比率3小于0.05,说明在南瓜的果胶中RG的含量较低。在三种果胶中,糖比率1最高的为WSP,说明在三种果胶中,WSP的鼠李聚半乳糖醛酸Ⅰ最多,同时也说明了WSP更易提取,这与肖敏等[3]的试验结果类似。结合果胶含量变化(表 2)及糖比率的性质,微波辐射使WSP发生解离,转化成CSP果胶,这有利于在高温、水分散失速度大的条件时形成稳定的孔状结构[25]。
2.5 真空微波干燥对南瓜果胶分子量的影响
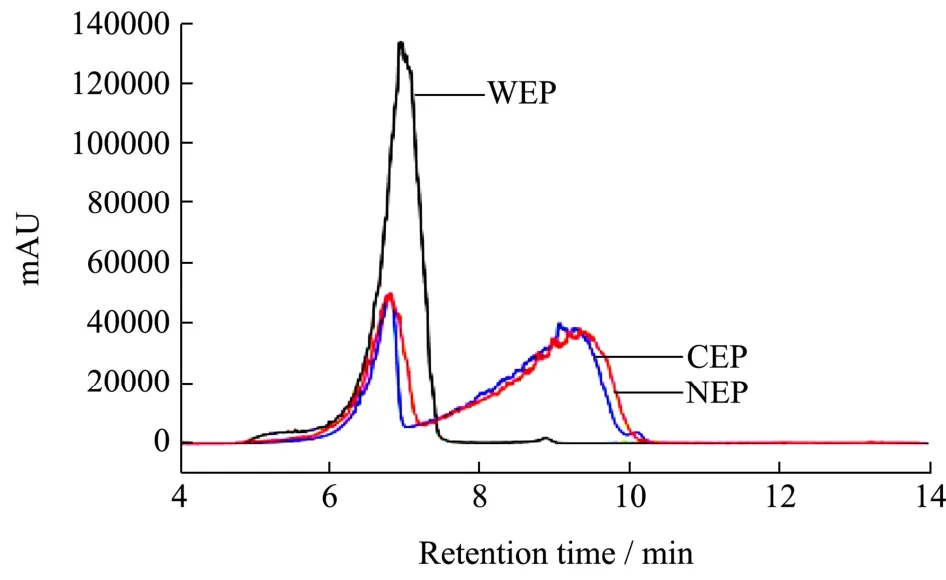
图2 南瓜鲜样中果胶的分子量分布Fig.2 Pectin molecular distribution of pumpkin
分子量是描述果胶性质的重要指标之一,出峰时间越早说明分子量越大,出峰时间越晚则说明分子量越小。从图2可看出,鲜样南瓜中WEP出峰时间较早,且仅含有一个峰值,NEP与CEP各含有两个峰值且NEP与CEP的分子量相差较小。本实验研究了不同微波强度对果胶分子量分布的影响,南瓜三种果胶经不同微波强度处理后表现出不同的分子量分布。图3a可以发现液相图中出现小分子峰,对比鲜样可知,真空微波干燥促进了南瓜 WSP的降解,导致分子量降低。由图3b可知,南瓜CSP随微波强度的增加,分子量减小的速度放缓,在6 W/g时,分子量减小明显,高强度情况下尽管也发生分子量的改变,但不如低强度变化明显。图3c表明,高强度组NSP分子量变化比低强度组明显,6 W/g时分子量变化不明显。
不同强度对果胶结构影响差异明显,高强度组的NSP分子量变化较大,低强度组的CSP变化明显,这可能与NSP、CSP的结合方式及性质有关。NSP为共价结合果胶,CSP为离子结合型果胶,高强度组在干燥的过程中产生的瞬时热量高,利于打断果胶共价键,使NSP降解成小分子,低强度组则是一个持续加热的过程,缓慢破坏果胶离子结合,使CSP更易降解。

图3 不同微波强度条件下南瓜果胶的分子量分布Fig.3 Pectinmolecular distribution of pumpkin under different microwave power density
2.6 真空微波干燥对南瓜 β-消除反应程度的影响
果胶在加工过程中发生β-消除反应,使高分子果胶解聚,导致果胶的溶解和相邻细胞的分离,最终降低蔬菜组织完整性和硬度[26]。采用不饱和半乳糖醛酸(UG)含量的高低来反应β-消除反应的程度,含量越高,说明β-消除反应发生的越彻底[22]。由图4可知,与南瓜鲜样组(CK)相比,真空微波干燥后的南瓜UG含量显著升高(p<0.05),升高幅度为79%~176%,UG含量随微波强度的升高呈现先上升后下降的趋势。微波强度为9 W/g时,南瓜UG含量达到较高水平,为10.54 mg/g,表明此强度下β-消除反应发生彻底,果胶溶解,因此降低组织硬度,这可能是得到适中硬度的原因。这与表1中硬度值变化趋势相符。
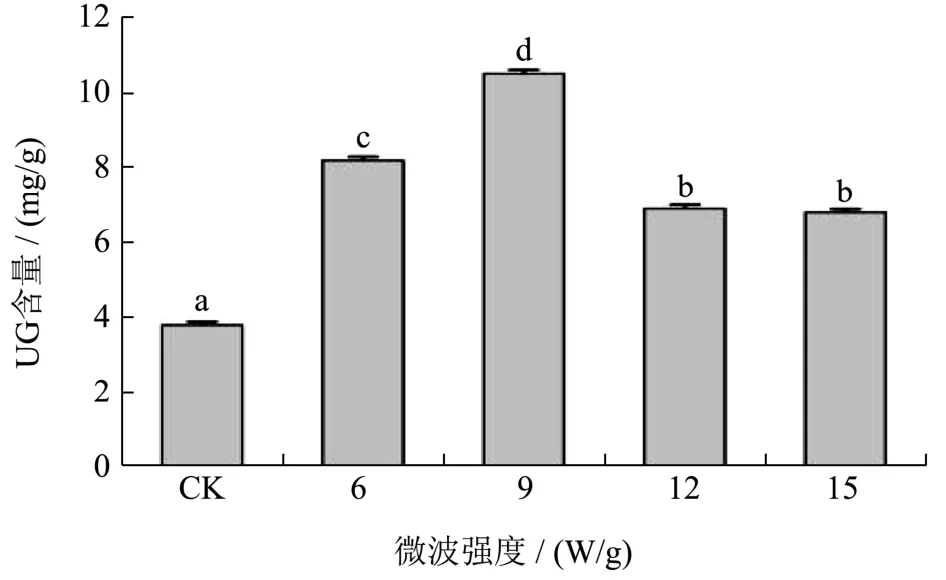
图4 不同微波强度条件下南瓜的果胶UG含量Fig.4 The content of UG in pectin of pumpkin under different microwave power density
热加工过程中,在高温和中性的理化环境下发生的β-消除反应会导致果胶链的断裂,使细胞壁结构松散,具体表现为半乳糖醛酸含量升高,果胶的负电荷含量增加,分子内作用力降低,果胶链发生团聚、交联性减弱,果胶呈链状结构[27]。本研究发现UG含量随微波强度的升高呈先升高后下降的趋势,这与Zhang等研究结果一致[28],这是因为在一定温度条件下,相同时间内产生的热量越高,β-消除反应越易发生;而较高的强度条件下,瞬时产生的热量过高,水分蒸发较快,缩短了干燥过程,使果胶解聚不明显。
2.7 真空微波干燥对南瓜果胶酯化度的影响
甲酯化和β-消除反应是果胶在热加工过程中发生的两类主要反应。酯化度影响果胶分子间的氢键作用,从而影响果蔬组织的质构[3]。表4显示不同微波强度条件下南瓜细胞壁果胶酯化度的变化趋势。研究发现,微波热效应会引起果胶的去甲酯化反应,随着微波强度的升高,南瓜 WSP的酯化度呈现先升高后降低的趋势,NSP的酯化度持续降低,CSP的酯化度则是先降低后升高。这表明真空微波干燥对每一种果胶酯化度的影响不同。酯化度基本呈现先上升后下降的趋势,这与UG含量的变化一致。当微波强度为9 W/g时,南瓜CSP酯化度较低,仅为28.92%,游离的羧基多,更易与组织中金属离子交联[29],因此有利于增强南瓜片多孔强度,这可能是微波强度为9 W/g得到较大脆度的原因。
微波辐射会产生热效应与非热效应,一方面热效应会使细胞壁多糖尤其是果胶的物化性质改变;另一方面,微波的非热效应产生湍流剪切细胞壁多糖大分子,导致果蔬细胞壁结构瓦解。刘佳[8]研究了3种干燥方式对苹果皮渣果胶理化性质的影响,发现微波干燥所获得的果胶酯化度和半乳糖醛酸含量较高,这与本实验研究结果一致,这是因为微波的热效应使腔体内温度升高,增加了β-消除反应的速率,导致pH增加,从而使果胶酯化度上升[30]。此外,Latorre等通过对红甜菜进行不同强度的微波处理的研究,发现微波处理本质上是通过增加细胞壁多糖的亲水性的方式来改变细胞壁结构[31]。肖敏等[3]研究发现压差闪蒸干燥获得的苹果片具有较好的质构特征,然而对比本研究中真空微波干燥,压差闪蒸干燥时间长,能耗高,因此,采用真空微波干燥通过选择适当的微波强度可调控果蔬的果胶性质变化,最终获得较佳的质构特征。

表4 不同微波强度条件下南瓜果胶的酯化度Table 4 Esterification degree of pectin from pumpkin under different microwave power density
3 结论
真空微波干燥使果胶物质流失、降解,WSP转化为CSP,果胶分子链断裂,分子量降低,导致在高温、水分散失速度大的条件时形成稳定的孔状结构。随微波强度的升高,南瓜中UG含量、果胶酯化度呈现先升高后降低的趋势。其中微波强度为9 W/g时,南瓜中UG含量较高,表明β-消除反应发生彻底,从而降低组织硬度,此时获得产品硬度适中,南瓜CSP酯化度较低,有利于增强其多孔强度,从而获得较大脆度。

