miR-126靶向SETD8抑制乳腺癌细胞增殖、迁移的作用及其机制研究
张晓静,陈延松,陈 晨,刘 元,金功圣,刘先富
(蚌埠医学院第一附属医院肿瘤外科,蚌埠 233000;*通讯作者,E-mail:276325428@qq.com)
乳腺癌是一种普遍存在的恶性疾病,在全世界妇女死亡率中排名第二[1],严重影响女性的身心健康。近些年随着分子生物学的进步,目前乳腺癌的分子分型主要由雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、人表皮生长因子受体2(human epidermal growth factor receptor 2,Her-2)和Ki-67在患者肿瘤组织中的表达量决定,可将乳腺癌分为四种类型:Luminal A型、Luminal B型、Her-2阳性型、三阴性型[2]。随着研究的深入,提高了我们对不同亚型乳腺癌生物学特性的理解,但由于肿瘤无限增殖和迁移的发生限制了乳腺癌的临床治疗效果[3]。因此,亟需寻找乳腺癌增殖、迁移的新分子机制。
miR-126位于9号染色体EGFL7基因的第7位内含子上,在毛细血管和大血管的内皮细胞中表达,具有调节血管生成的功能[4]。越来越多的研究表明,miR-126在肿瘤发生发展中具有重要作用,并证实miR-126在结肠癌、前列腺癌、肺癌、食管癌中低表达[5-8],而miR-126在乳腺癌中的作用仍存在争议,有待深入研究。本课题将探究miR-126对乳腺癌细胞增殖和迁移的影响,并寻找其可能的作用机制,为乳腺癌的临床治疗提供新的理论基础。
1 材料和方法
1.1 主要试剂
MCF-10A细胞培养基主要成分为:DMEM/F12培养基,依次加入5%马血清、10 μg/ml胰岛素、20 ng/ml表皮生长因子、100 ng/ml霍乱毒素、0.5 μg/ml氢化可的松,均购买于武汉普诺赛(Procell)生物试剂公司;DMEM和RPMI-1640高糖培养基购于Hyclone(美国)公司;转染试剂购自镇江Abm公司;CCK-8试剂盒购于日本同仁生物试剂公司;miR-126模拟物(miR-126 mimics)、阴性对照(mimics-NC)和相关引物由滁州通用生物公司合成;STED8、PCNA、β-actin抗体购于武汉三鹰生物技术有限公司;pcDNA3.1-SETD8质粒购于南京金斯瑞生物公司;Transwell小室购于Corning公司;青链霉素溶液购于碧云天生物试剂公司。
1.2 细胞株和细胞培养
MCF-10A、MDA-MB-231、MCF-7、SK-BR-3、BT-549细胞购于武汉普诺赛生物试剂公司。乳腺上皮MCF-10A细胞使用专用培养基培养;乳腺癌MDA-MB-231和MCF-7细胞均采用DMEM高糖培养基培养,乳腺癌SK-BR-3和BT-549细胞培养采用RPMI-1640高糖培养基,且含10%胎牛血清和1%青链霉素溶液,置于37 ℃,5% CO2细胞培养箱中常规培养。
1.3 qRT-PCR检测miR-126的相对表达量
使用Trizol试剂分别抽取乳腺上皮细胞MCF-10A,乳腺癌细胞MDA-MB-231、MCF-7、SK-BR-3、BT-549的总RNA、使用试剂盒每组逆转录1 μg RNA作为cDNA用于后续qRT-PCR实验,检测miR-126的表达情况。根据SYBR Green Mix试剂盒说明书配制反应体系:Mix 10 μl,上游引物0.5 μl,下游引物0.5 μl,cDNA模板4 μl,去离子水5 μl。U6作为内参。miR-126上游引物为:5′-TATGGTTGTTCTCGACTCCTTCAC-3′,下游引物为:5′-TCGTCTGTCGTACCGTGAGTAAT-3′;U6上游引物为:5′-CTCGCTTCGGCAGCACA-3′,U6下游引物为:5′-AACGCTTCACGAATTTGCGT-3′。反应步骤为:预变性95 ℃ 5 min(1个循环),循环反应95 ℃ 10 s、60 ℃ 30 s(40个循环)。使用2-ΔΔCt法计算miR-126相对表达量。
1.4 细胞转染
选取生长状态较好的MCF-7细胞接种于6孔板,4×105个/孔,培养箱中继续培养24 h进行转染。本实验中需进行两种类型转染实验,miR-126过表达实验设置阴性对照组(mimics NC)组和miR-126模拟物组(miR-126 mimics);挽救实验设置阴性对照组(mimics NC)、miR-126模拟物组(miR-126 mimics)、STED8回补组(miR-126 mimics和pcDNA3.1-SETD8质粒共转染),每孔转染复合物体系为:0.5 ml无血清DMEM高糖培养基中加入4 μl DNAfectin plus转染试剂,5 μl siRNA或5 μl siRNA+2 μg质粒,充分混匀、室温静置10 min,加入6孔板。培养箱继续培养48 h,收集细胞用于后续实验。
1.5 CCK-8法检测细胞增殖
选择转染后生长状态良好的细胞,消化离心,接种于96孔板中,3 000个/孔,每组设置5个复孔,放入培养箱中继续培养。分别于0,24,48,72 h每孔加入10 μl CCK-8溶液(以接种后细胞完全贴壁时作为0 h检测点),37 ℃孵育2 h,酶标仪检测450 nm处的吸光度值(optical density,OD)。
1.6 集落克隆实验检测细胞增殖
选取转染后生长状态良好的MCF-7细胞,胰酶消化离心、计数,接种于6孔板中,1 000个/孔。置于37 ℃,5% CO2细胞培养箱培养10 d,取出6孔板,弃去培养基,PBS洗涤一次;每孔加入1 ml甲醇室温固定20 min,0.1%结晶紫染色30 min,去离子水洗涤干净,37 ℃烘箱烘干拍照,并在显微镜下进行计数。
1.7 Transwell检测细胞迁移能力
使用转染后生长状态良好的MCF-7细胞,胰酶消化离心,用无血清培养基洗涤一次,再次使用无血清培养基重悬计数,每个Transwell小室上室加入3×104个细胞,下室加入700 μl含10%血清的完全培养基,每组设置3个复孔。细胞培养箱中继续培养24 h,取出小室,甲醇室温固定20 min,0.1%结晶紫室温染色20 min,棉签轻柔擦去上室表面未迁移细胞,去离子水清洗两次,显微镜下随机选取5个视野拍照计数、求出各组迁移细胞平均数。
1.8 Targetscan Human 7.2数据库在线预测miR-126下游靶基因
打开网站http://www.targetscan.org/vert-72/,首先选择物种为Human,然后输入microRNA名称为miR-126,对其靶基因进行预测。
1.9 Western blot检测SETD8、PCNA、β-actin蛋白表达
选取转染后对数生长期细胞、消化计数,接种于60 mm平皿中,6×105个/皿,细胞培养箱中48 h,收集细胞于1.5 ml EP管,预冷的PBS洗涤一次,弃去PBS,加入适量RIPA裂解液,冰上裂解30 min,13 000g离心15 min,收集上清。加入1/4体积loading buffer,100 ℃煮样5 min变性蛋白。随后进行SDS-PAGE电泳、转膜至PVDF膜,5%脱脂牛奶室温封闭1 h,分别加入SETD8、PCNA、β-actin一抗(均使用5%脱脂牛奶按1 ∶1 000稀释),4 ℃过夜孵育,PBST洗膜3次、20 min/次,加入对应兔二抗(使用PBST溶液按1 ∶5 000稀释),室温孵育2 h,PBST洗膜3次、20 min/次,ECL发光液显影曝光。
1.10 数据统计分析
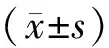
2 结果
2.1 miR-126在乳腺癌细胞中表达水平降低
qRT-PCR结果显示:相比于乳腺上皮细胞MCF-10A,miR-126在四株乳腺癌细胞中表达均降低(P<0.05),且MCF-7细胞中表达水平最低(见图1)。
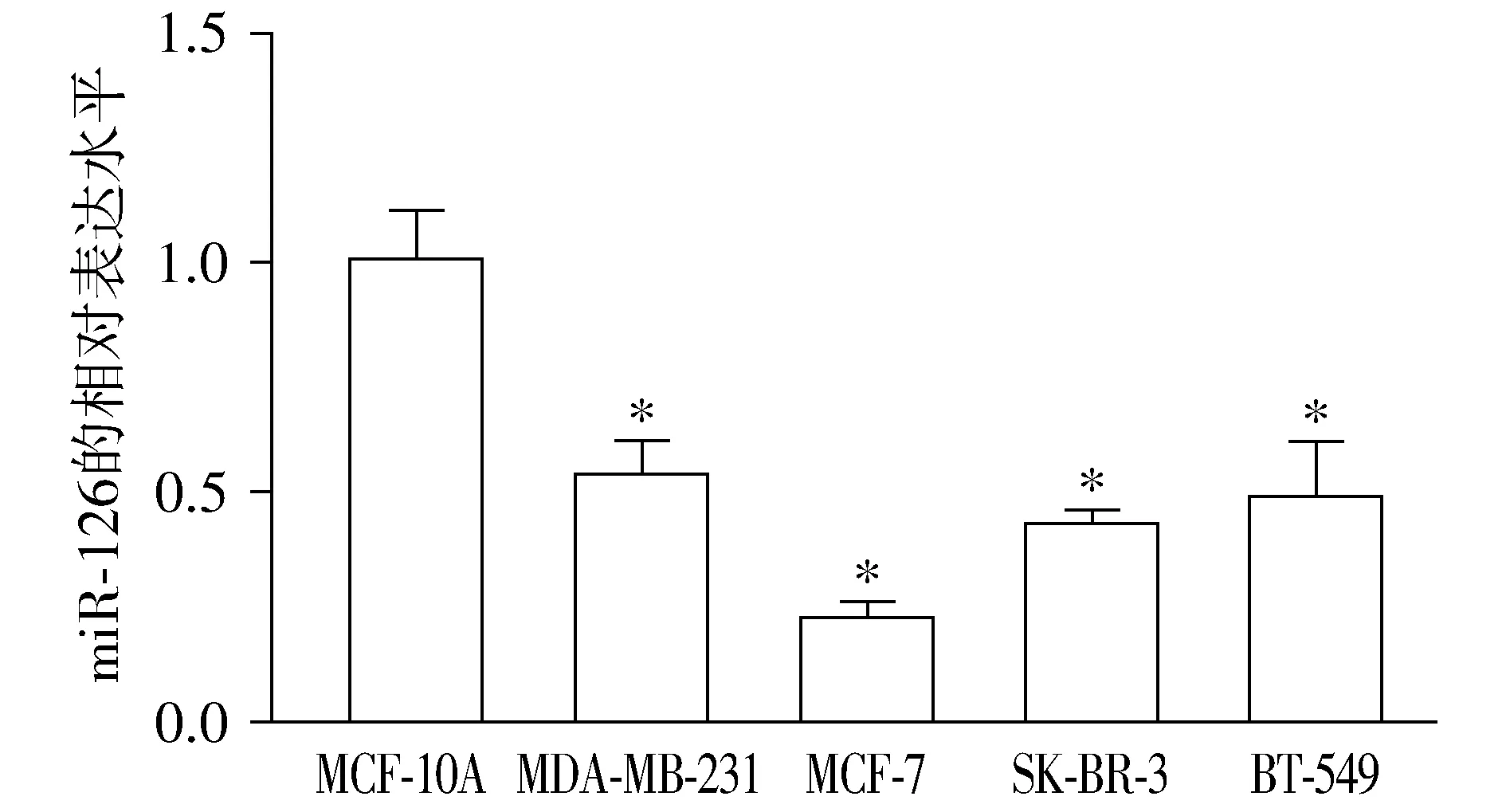
与MCF-10A细胞比较,*P<0.05图1 miR-126在乳腺上皮细胞和乳腺癌细胞中的表达情况Figure 1 Expression of miR-126 in breast epithelial cells and breast cancer cells
2.2 miR-126抑制乳腺癌细胞增殖
相比于NC组,miR-126 mimics组miR-126水平显著升高(P<0.05,见图2);随后使用CCK-8和集落克隆实验检测细胞增殖,结果显示:相比于NC组,miR-126 mimics组细胞增殖能力明显降低(P<0.05,见图2)。
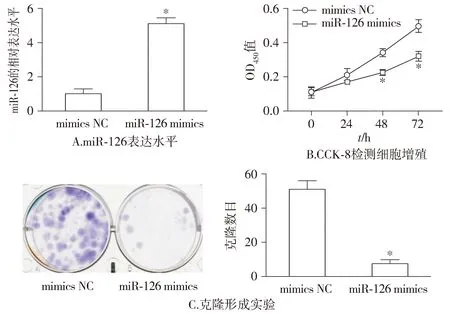
与mimics NC组比较,*P<0.05图2 miR-126对乳腺癌MCF-7细胞增殖的影响Figure 2 Effect of miR-126 on the proliferation of breast cancer MCF-7 cells
2.3 miR-126抑制乳腺癌细胞迁移
Transwell实验表明:相比于NC组,miR-126 mimics组细胞迁移能力显著下降(P<0.05,见图3)。
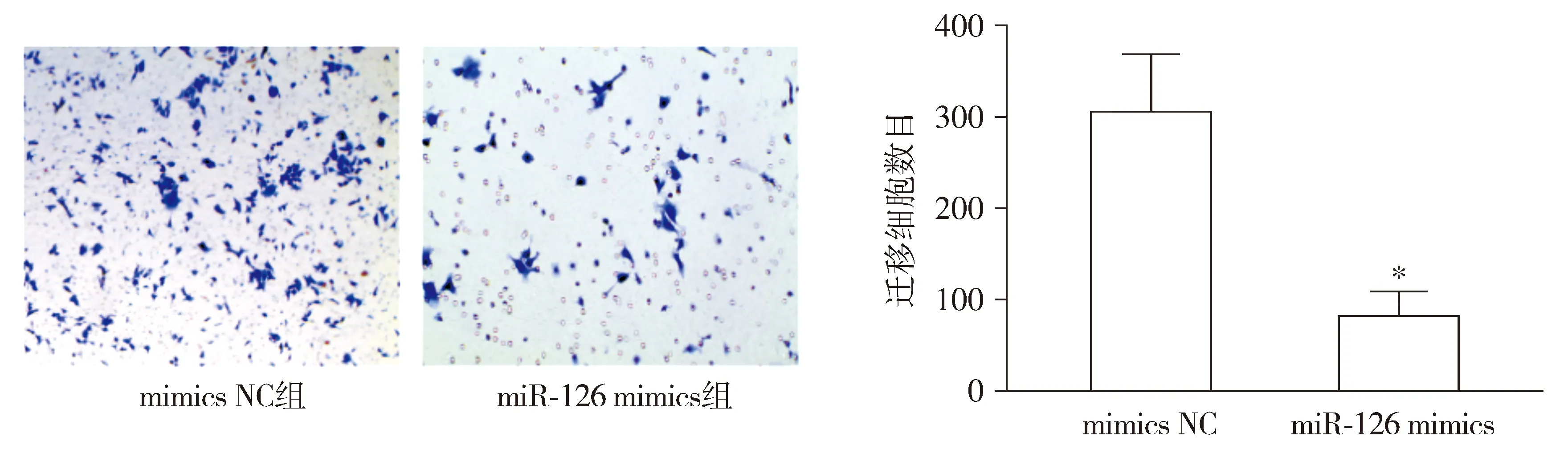
与mimics NC组比较,*P<0.05图3 miR-126对乳腺癌MCF-7细胞迁移的影响Figure 3 The effect of miR-126 on the migration of breast cancer MCF-7 cells
2.4 miR-126靶向SETD8抑制其表达
使用Targetscan网站预测miR-126下游靶基因,结果表明:miR-126能够结合在SETD8的3′-UTR区域(见图4A),推测SETD8可能为miR-126的下游靶基因;Western blot实验证实:转染miR-126 mimics确能降低SETD8蛋白表达(P<0.05,见图4B)。
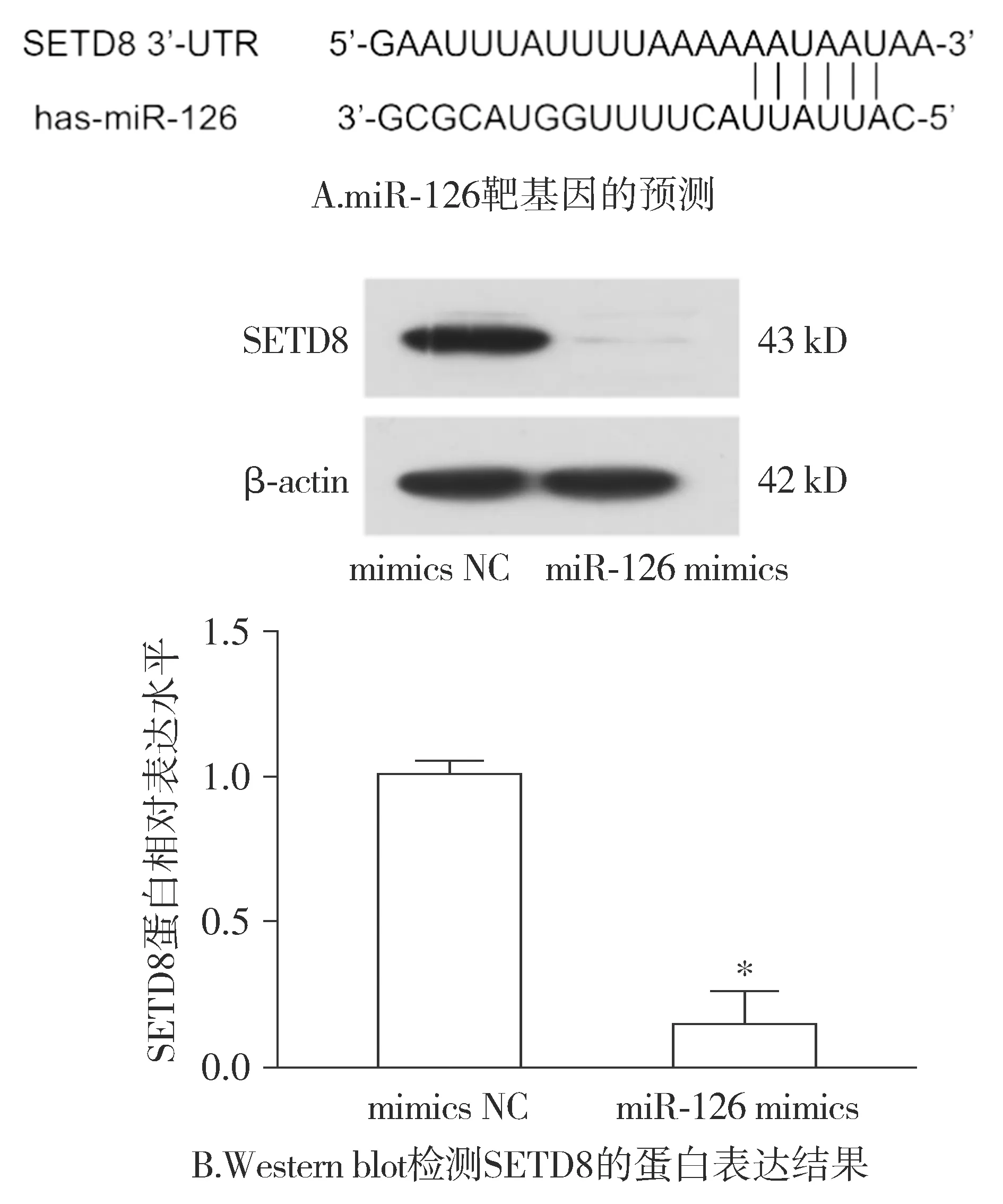
与mimics NC组比较,*P<0.05图4 miR-126对MCF-7细胞SETD8表达的影响Figure 4 The effect of miR-126 on SETD8 expression in MCF-7 cells
2.5 miR-126能抑制PCNA表达
通过Western blot实验证实:乳腺癌MCF-7细胞中miR-126可以下调PCNA蛋白表达(P<0.05,见图5)。
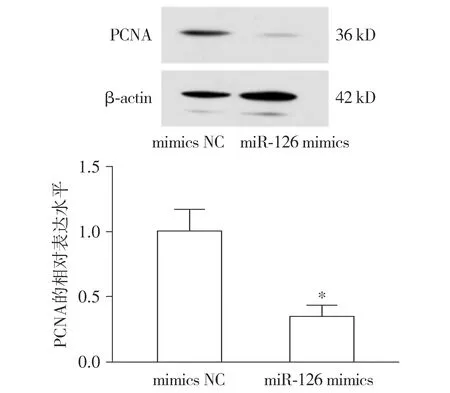
与mimics NC组比较,*P<0.05图5 miR-126对MCF-7细胞PCNA表达的影响Figure 5 The effect of miR-126 on the expression of PCNA in MCF-7 cells
2.6 回补SETD8增加乳腺癌细胞增殖能力
Western blot实验表明:相比于miR-126 mimics转染组,SETD8回补组能升高SETD8的蛋白表达(见图6A)。CCK-8和集落克隆实验证实:相比于miR-126 mimics组,SETD8回补组细胞增殖能力略有升高,且差异具有统计学意义(P<0.05,见图6)。
2.7 回补SETD8增加乳腺癌细胞迁移能力
Transwell实验结果表明,回补SETD8表达能明显恢复细胞的迁移能力(P<0.05,见图7)。
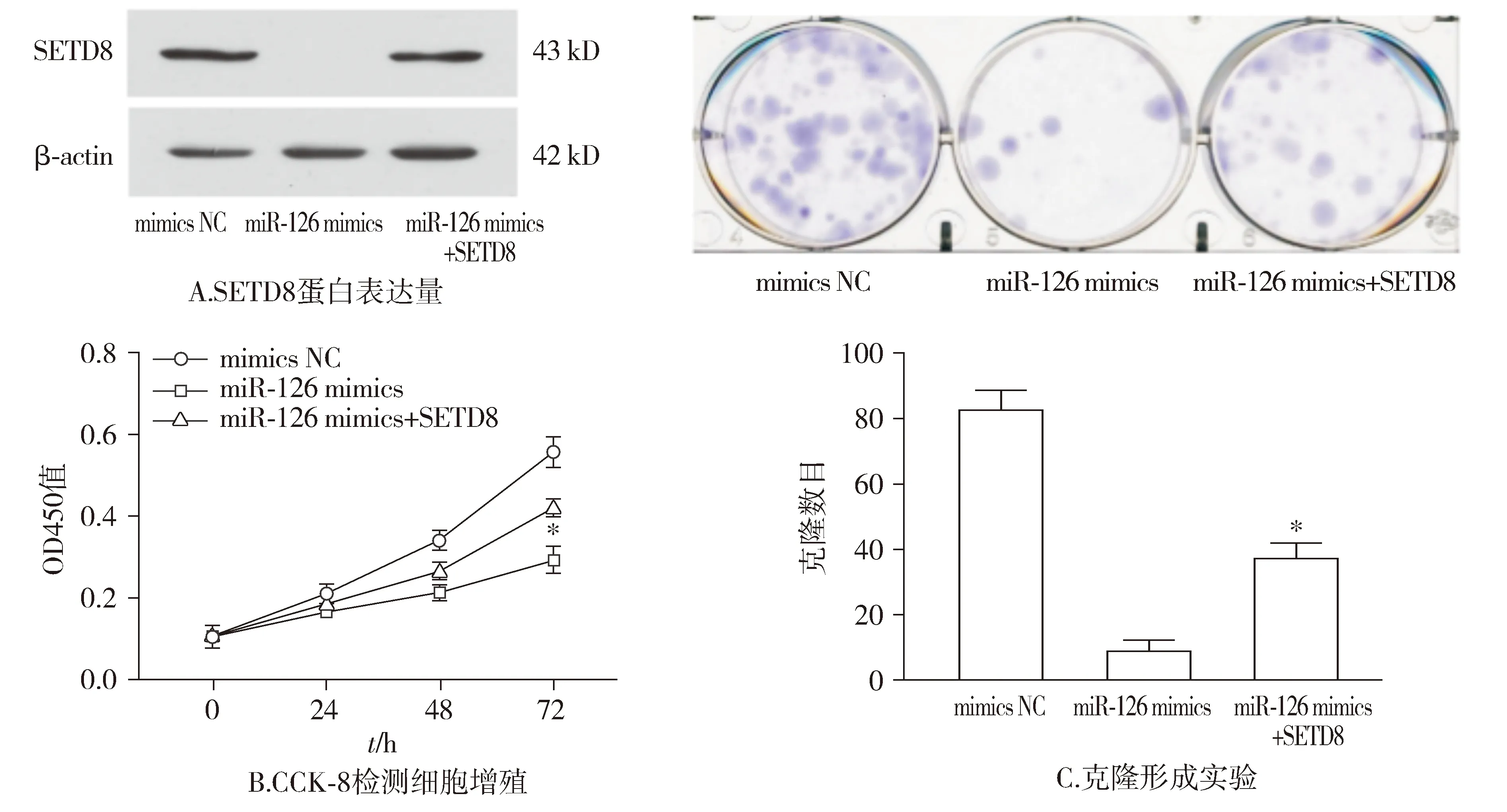
与miR-126 mimics组比较,*P<0.05图6 回补SETD8表达对乳腺癌细胞增殖能力的影响Figure 6 Effect of backfilling SETD8 expression on the proliferation ability of breast cancer cells
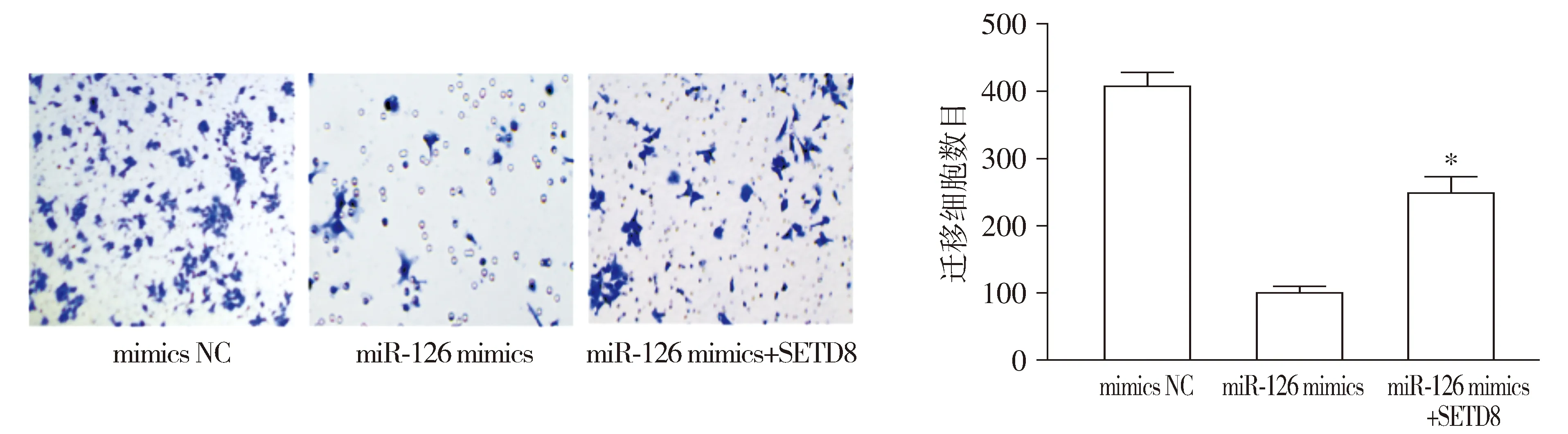
与miR-126 mimics组比较,*P<0.05图7 回补SETD8表达对乳腺癌细胞迁移能力的影响Figure 7 Effect of backfilling SETD8 expression on the migration ability of breast cancer cells
2.8 回补SETD8增加PCNA蛋白表达
Western blot实验证实,相比于miR-126 mimics组,SETD8回补组能够增加PCNA的蛋白水平(见图8),证实miR-126能通过SETD8调控PCNA表达。
3 讨论
miRNA是由21-25个核苷酸组成的短链非编码RNA,能够靶向目的基因mRNA的3′-UTR区域,从而抑制蛋白质的翻译。目前对miRNA在各种疾病中的作用进行了深入研究,发现miRNA能影响视网膜疾病、神经退行性疾病、心血管疾病、癌症发生发展等[9]。关于miRNA在癌症中的作用已有大量报道,有研究表明miR-146能抑制多种肿瘤进展,并能作为一些非转移性肿瘤的分子标志物[10];miR-10a能负调控BDNF蛋白表达,进而抑制宫颈癌的增殖和迁移[11];miR-132能逆转卵巢癌对顺铂的耐药性[12]。这些研究证实miRNA在肿瘤发生发展中具有重要意义。
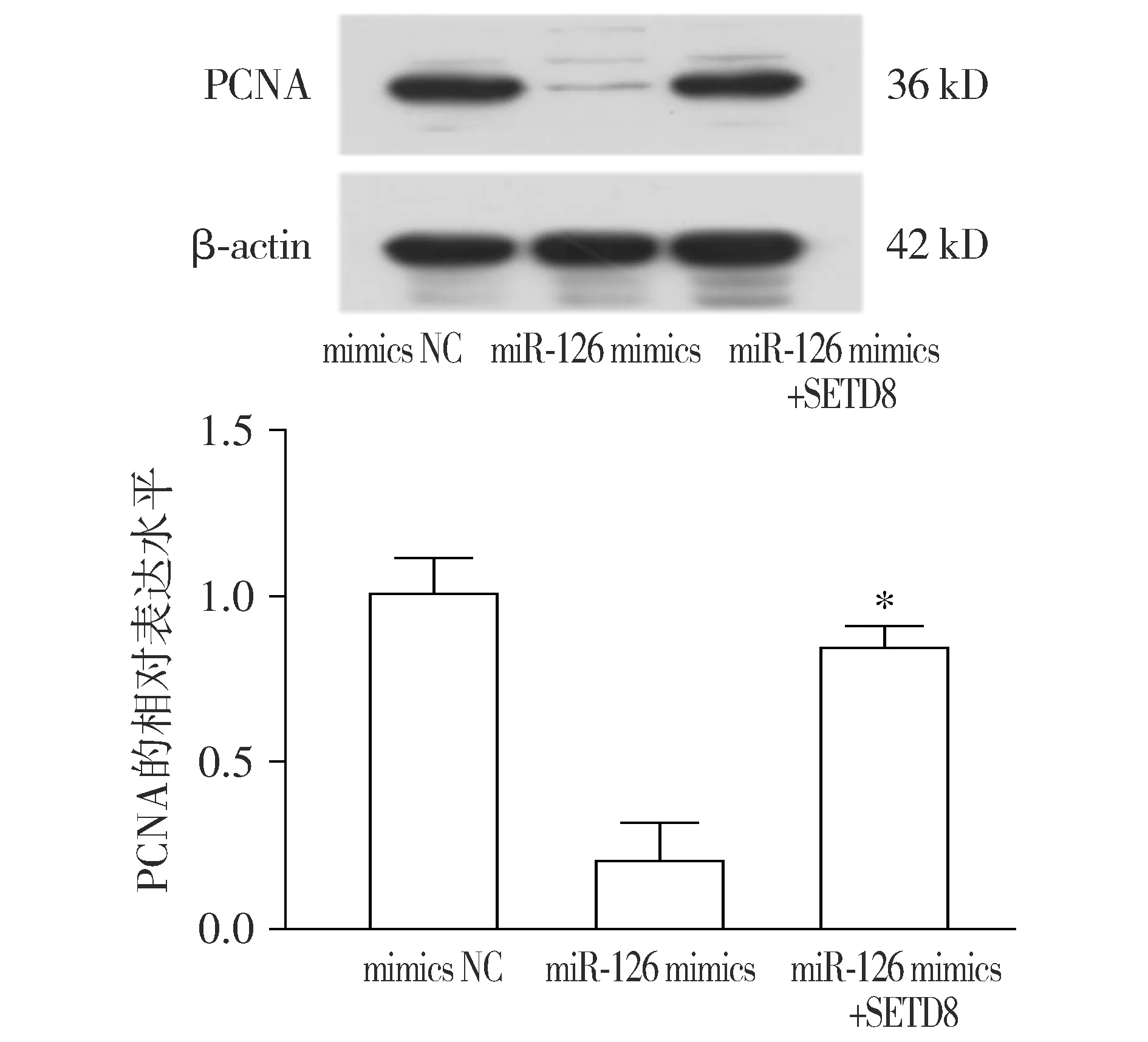
与miR-126 mimics组比较,*P<0.05图8 回补SETD8对PCNA表达的影响Figure 8 Effect of backfilling SETD8 on PCNA expression
miR-126在肿瘤中研究较多,最近有研究表明miR-126能够在靶向PIK3R2并调控AKT/mTOR通路降低乳腺癌对曲妥单抗的耐药性[13];Wang等[14]证实miR-126可抑制ADAM9蛋白表达进而降低乳腺癌细胞侵袭性;Hong等[15]报道miR-126可通过靶向RGS3抑制三阴性乳腺癌细胞的增殖、迁移和血管生成。本研究证实miR-126在多株乳腺癌细胞中低表达,且miR-126能抑制乳腺癌MCF-7细胞的增殖和迁移,与以前研究[14,15]结果一致,均表明miR-126在乳腺癌中发挥抑癌功能。通过Tatgetscan网站在线预测表明miR-126可能结合在SETD8的3′-UTR区域,随后通过Western blot实验证实miR-126确能降低SETD8的表达。
SETD8属于组蛋白赖氨酸甲基转移酶(histone lysine methyltransferase)家族中的一员,包含SET结构域,能够催化组蛋白H4第20位赖氨酸发生单甲基(H4K20me)和非组蛋白甲基化,已发现其可以参与转录调控、DNA损伤、细胞周期等生物学过程[16]。已有研究表明SETD8能促进神经胶质瘤、非小细胞肺癌、骨肉瘤等发生发展[17-19]。目前仅有Huang等[20]证实SETD8可以增加HIF-1α蛋白稳定性从而促进乳腺癌细胞增殖。因此,仍需进一步探究SETD8在乳腺癌中的作用机制。
已有报道表明SETD8能够通过提高PCNA蛋白稳定性,进而促进其表达[9]。那么乳腺癌细胞中miR-126是否可以通过SETD8调控PCNA表达,引起了我们极大兴趣。本研究证实SETD8在乳腺癌MCF-7细胞中可调控PCNA表达。随后,我们通过挽救实验回补SETD8的表达,结果表明回补SETD8表达后能部分增加乳腺癌细胞的增殖、迁移能力,同时能恢复PCNA的表达。挽救实验证实了miR-126能够靶向SETD8下调PCNA表达,进而抑制乳腺癌细胞增殖、迁移的特异性和重要性。
综上所述,本研究初步证实miR-126/SETD8/PCNA轴能调控乳腺癌细胞增殖、迁移,丰富了乳腺癌发生发展的分子机制。此外,本研究为乳腺癌的临床治疗提供了新的思路和方法。

