血管钠肽缓解小鼠脑出血后神经功能缺损评分和脑水肿程度及其作用机制
常 盼,朱萧玲,于 军,朱肖星,王建榜,王西辉,李 静*
(1西安医学院第二附属医院中心实验室,西安 710038;2空军军医大学西京医院麻醉科;*通讯作者,E-mail:8683268@qq.com)
脑出血(intracerebral hemorrhage,ICH)是一种致残率和复发率较高的神经系统疾病,是指原发性脑实质出血,在急性脑血管病中具有最高的病死率[1]。近年来,脑出血的发病率逐年上升,且呈低龄化趋势[2],尽管临床治疗取得了显著进展,但45岁以上脑出血患者的5年死亡率仍超过50%[3],因此,脑出血不仅造成患者较高的发病率和死亡率,而且给家庭和社会带来严重的负担。脑出血后的病理机制可引发一系列不良事件,进而导致继发性脑损伤和严重的神经功能缺损,这是影响脑出血患者生活质量和预后的主要因素之一[4]。因此缓解脑出血后的继发性损伤具有重要的意义。脑出血后氧化应激和内质网应激的过度激活是脑出血后继发性损伤的主要病理机制[5,6]。钠尿肽是一组结构相似的多肽家族,在维持机体水盐平衡、血压稳定等方面具有重要作用,主要包括心房钠尿肽(atrial natriuretic peptide,ANP)、脑钠肽(brain natriuretic peptide,BNP)和C型钠尿肽(C-type natriuretic peptide,CNP)。血管钠肽(vasonatrin peptide,VNP)是一种具有ANP和CNP的生理功能人工合成的多肽,我们前期首次发现,VNP降低脑出血后基底节区水肿程度[7],但具体的作用机制仍不清楚。因此,本研究主要探究VNP对小鼠脑出血神经功能缺损评分与脑水肿程度的影响,以及其对氧化应激和内质网应激的作用。
1 材料与方法
1.1 动物与分组
8周龄雄性C57BL/6小鼠,体质量18-20 g,购于空军军医大学实验动物中心,将动物随机分为:假手术组(sham组)10只,脑出血组(ICH组)24只,脑出血+10 μg/kg血管钠肽处理组(ICH+10 μg/kg VNP)16只,脑出血+25 μg/kg血管钠肽处理组(ICH+25 μg/kg VNP)24只及脑出血+50 μg/kg血管钠肽处理组(ICH+50 μg/kg VNP)16只。脑出血1,3,5,7 d应用神经功能损伤评分观察小鼠脑出血的神经功能;采用干湿重法检测脑水肿程度,这两个指标评估VNP发挥保护作用的最佳效应(脑出血3 d时,25 μg/kg VNP)。因此,后续实验分为3组:sham组、ICH组和ICH+25 μg/kg VNP组。动物术前12 h禁食,但自由进水。
1.2 小鼠脑出血模型的建立
应用0.1%戊巴比妥钠腹腔注射将动物麻醉后,仰卧位固定于立体定位仪(北京众实迪创生物科技发展有限公司,中国),备皮碘伏消毒,剥离小鼠右侧颅顶骨膜,将1 μl含0.2 U的胶原酶Ⅶ(Sigma-Aldrich,美国)于5 min内缓慢注入右纹状体内,留针5 min后,进行缝合,整个手术过程中,保持动物肛温在37 ℃。假手术组以同样的方法注入1 μl的生理盐水,造模开始前1 h和脑出血造模结束后1 h,VNP溶液按照相应剂量通过腹腔分别注射入模型鼠。
1.3 神经功能的评估
神经功能的评估采用神经功能缺损评分(NDS)进行检测,主要测试内容包括行走、平衡、感觉、提尾反射等,分别在脑出血1,3,5,7 d后评估小鼠脑出血神经功能的损伤情况。
1.4 脑水肿的检测
采用干湿重法检测脑组织含水量,评估脑水肿程度,检测完神经功能后,分别在脑出血1,3,5,7 d采用0.1%戊巴比妥钠腹腔注射麻醉后断头取出脑组织,称得质量即为湿重,在100 ℃干燥箱烘干24 h后,称其质量即为干重,脑组织含水量(%)=(湿重-干重)/湿重×100%。
1.5 二氢乙锭(dihydroethidium,DHE)染液检测脑组织超氧化物阴离子水平
脑出血3 d后取材,进行冰冻切片切片,将含有5 μmol/L的DHE溶液(碧云天生物科技有限公司,中国)加入到组织切片上,37 ℃避光孵育30 min后,PBS清洗3次,加入DAPI溶液,应用激光共聚焦显微镜观察DHE水平,以评价活性氧(reactive oxygen species,ROS)的产生情况。
1.6 脑组织ROS含量的检测
脑出血3 d后取材,采用酶消化法制备脑组织单细胞悬液,加入DCFH-DA溶液(南京建成生物工程有限公司,中国),37 ℃避光孵育30 min,荧光光度分度计检测荧光数值。
1.7 脑组织丙二醛(malondialdehyde,MDA)及超氧化物歧化酶(superoxide dismutase,SOD)的检测
应用细胞裂解液将脑出血3 d的脑组织进行裂解,12 000g离心10 min取上清,分别应用MDA检测试剂盒(碧云天生物科技有限公司,中国)和SOD活性检测试剂盒(碧云天生物科技有限公司,中国),按照说明书操作依次检测脑组织MDA含量和SOD活性。
1.8 Western blot检测内质网应激相关蛋白
脑出血3 d处理后,提取组织蛋白,检测蛋白浓度,通过SDS-聚丙烯酰胺凝胶电泳分离蛋白样品,采用恒流250 mA,120 min的条件将蛋白转移到PVDF膜上,使用5%脱脂牛奶常温封闭2 h,一抗GRP78(1 ∶1 000)、CHOP(1 ∶1 000)及β-actin(1 ∶1 000)在4 ℃孵育过夜。辣根过氧化物酶标记山羊抗兔IgG的二抗(1 ∶3 000)室温孵育2 h,ECL化学发光系统检测免疫印迹。
1.9 统计学分析处理
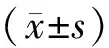
2 结果
2.1 血管钠肽对小鼠脑出血后神经功能缺损评分结果的影响
采用NDS评分评估小鼠脑出血后神经功能缺损情况,结果显示,与sham组相比,ICH组的小鼠在1,3,5,7 d时神经功能缺损评分显著增加(P<0.01)。与ICH组相比,10 μg/kg VNP处理组脑出血后神经功能缺损评分未明显改变(P>0.05);脑出血1 d或3 d时,25 μg/kg和50 μg/kg VNP处理组神经功能缺损评分均降低(P<0.05,见图1)。

与sham组相比,**P<0.01;与ICH模型组相比,#P<0.05图1 小鼠脑出血后神经功能缺损评分结果比较Figure 1 Comparison of scores of neurological deficits after cerebral hemorrhage
2.2 血管钠肽对小鼠脑出血后脑水肿的影响
通过干湿重法检测脑组织含水量评估脑水肿程度,结果发现,与sham组相比,ICH组脑出血小鼠在1,3,5,7 d后脑水肿显著增加(P<0.01)。与ICH组相比,10 μg/kg VNP处理组脑出血后脑水肿程度未明显改变(P>0.05);脑出血1 d时,25 μg/kg和50 μg/kgVNP处理组脑水肿程度均降低(P<0.05);脑出血3 d时,25 μg/kgVNP处理组脑水肿程度显著降低(P<0.01,见图2)。
与sham组相比,**P<0.01;与ICH模型组相比,#P<0.05,##P<0.01图2 小鼠脑出血后脑水肿的变化Figure 2 Changes of brain edema after cerebral hemorrhage in mice
2.3 血管钠肽对小鼠脑出血后氧化应激的影响
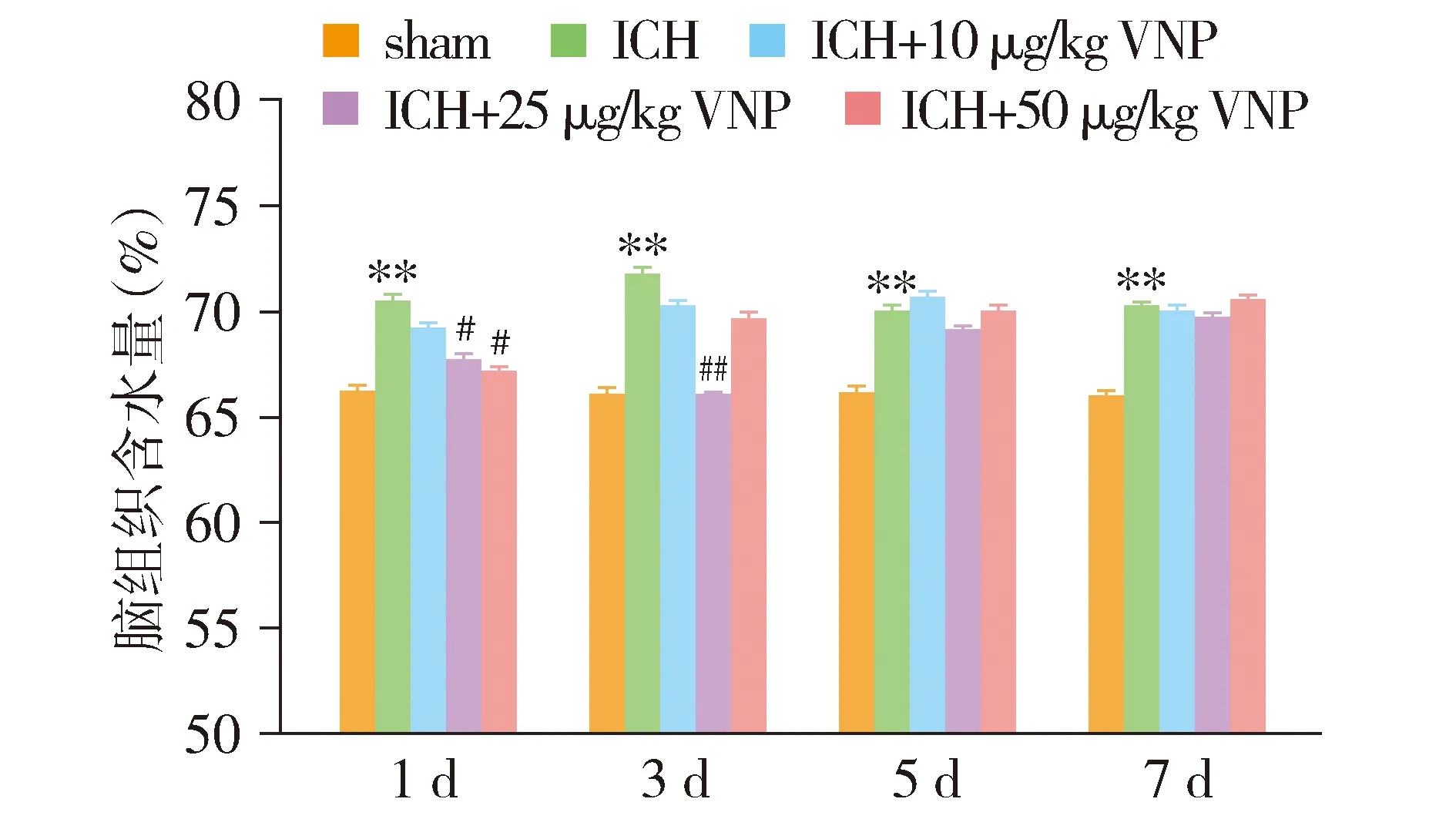
采用DHE免疫荧光染色后,荧光显微镜下观察超氧化物阴离子情况,评估ROS的产生,结果见图3。与sham组相比,ICH组ROS显著增加(P<0.01)。与ICH组相比,25 μg/kg VNP处理组ROS的产生降低(P<0.05)。利用化学荧光法检测脑组织ROS和MDA含量,结果表明,与sham组相比,ICH组ROS及MDA含量显著增加(P<0.01,见图4)。与ICH组相比,25 μg/kg VNP处理组的ROS及MDA含量降低(P<0.05)。检测脑组织SOD的含量,结果显示,与sham组相比,ICH组的SOD含量显著降低(P<0.01)。与ICH组相比,25 μg/kg VNP处理组的SOD活性增高(P<0.05,见图4)。以上结果提示,VNP抑制小鼠脑出血后氧化应激的发生。
图3 血管钠肽对小鼠脑出血后DHE荧光强度的影响 (×40)Figure 3 Effect of VNP on DHE fluorescence intensity after cerebral hemorrhage in mice (×40)

与sham组相比,**P<0.01;与ICH模型组相比,#P<0.05,##P<0.01图4 血管钠肽对小鼠脑出血后氧化应激的影响Figure 4 Effect of VNP on oxidative stress after cerebral hemorrhage in mice
2.4 血管钠肽对小鼠脑出血后内质网应激的影响
利用Western blot检测内质网应激相关蛋白GRP78和CHOP的含量,结果显示,与sham组相比,ICH组的脑组织GRP78和CHOP的蛋白表达均显著增加(P<0.01,见图5)。与ICH组相比,25 μg/kg VNP处理组的GRP78和CHOP的表达均降低(P<0.05)。以上结果提示,VNP抑制小鼠脑出血后内质网应激的发生。
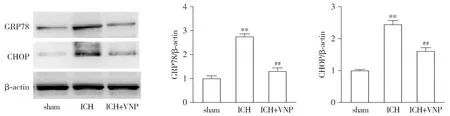
与sham组相比,**P<0.01;与ICH模型组相比,##P<0.01图5 血管钠肽小鼠脑出血后内质网应激相关蛋白的影响Figure 5 Effect of VNP on endoplasmic reticulum stress-related proteins after intracerebral hemorrhage in mice
3 讨论
有报道称脑出血后,血清BNP含量明显升高,且与脑水肿程度及预后效果密切相关[8,9]。外源性的BNP作用于脑出血小鼠后,可改善小鼠神经功能[10]。此外,ANP可以降低脑出血和脑外伤后的脑水肿程度[11]。以上研究表明,钠尿肽家族与脑出血的发生及预后密切相关,但是具体的作用机制仍不清楚。VNP是由ANP和CNP嵌合而成的由人工合成的新型钠尿肽,我们前期研究将脑组织分为5部分,检测VNP对5部分脑组织水肿程度的影响,结果显示VNP可以降低脑出血后脑基底节区水肿程度[7],具体作用机制不清楚。继发性脑损伤程度取决于脑水肿的大小[5]。本次研究应用不同浓度的VNP依次检测其对神经功能和脑水肿程度的影响,结果显示,25 μg/kgVNP作用于脑出血3 d的小鼠后,可降低神经功能缺损评分和脑水肿程度,以上结果表明,VNP对脑出血损伤具有神经保护作用。
氧化应激是指机体对各种有害刺激作出反应,并产生过量ROS的状态。氧化应激反映了活性氧的系统表现,是机体氧化和抗氧化作用失衡的一种状态。在脑出血继发性损伤中,氧化应激发挥重要的作用[12],抑制脑出血后氧化应激的发生是治疗脑出血的重要靶点之一[5],ROS作为机体氧化应激的主要因素,体内或细胞内ROS的积累,造成细胞毒性,最终可导致组织损伤,抑制ROS的产生对于脑出血的防治具有重要意义。为了进一步探究VNP发挥神经保护的机制,本部分采用DHE染色法观察超氧化物阴离子情况评估ROS的情况、化学荧光检测ROS含量以及试剂盒检测MDA和SOD活性,以评价氧化应激情况。结果发现脑出血后ROS的生成明显增加,而VNP缓解此现象,为了更进一步探究VNP对脑出血氧化应激的影响,分别检测脑组织ROS生成、MDA含量及SOD活性,结果发现VNP抑制脑出血后ROS的产生,降低MDA含量,提高SOD活性。以上结果提示,VNP对脑出血损伤的保护作用与氧化应激有关。
内质网是真核细胞中重要的细胞器,主要参与蛋白质折叠、脂质合成、细胞内钙稳态的维持等作用,缺氧、低血糖、温度过高和钙动态失衡等均可引起内质网应激[13]。脑出血发生后,其病理状态导致内质网蛋白折叠能力与容量之间的不平衡,导致未折叠蛋白在内质网内腔中积聚,从而导致内质网应激的发生[14]。氧化应激与内质网应激的发生密切相关,氧化应激发生后,未折叠蛋白质反应的适度激活可能是保护细胞功能和存活的适应机制,但过度的内质网应激可引起ROS积累,进一步加重氧化应激的发生[15]。脑出血发生时,氧化应激和内质网应激的水平增强[16,17],因此抑制氧化应激和内质网应激可能是脑出血新的治疗靶点。内质网应激信号主要由3种跨膜蛋白介导,即蛋白激酶RNA样内质网激酶、需要肌醇的蛋白1和活化转录因子6。这3种跨膜蛋白与GRP78结合,通常处于失活状态,当内质网应激发生的时候,GRP78与跨膜蛋白结合发生解离,从而导致内质网应激下游信号的激活。在本次研究中,我们检测内质网应激相关蛋白GRP78的表达,结果发现脑出血后GRP78的表达升高,VNP处理后显著降低GRP78的表达。内质网应激的3种跨膜蛋白不仅可以介导内质网应激的发生,而且还可以引发促凋亡信号。CHOP在内质网应激介导的细胞凋亡中发挥重要作用。本研究中检测CHOP的蛋白含量变化,结果显示,脑出血后CHOP蛋白表达显著增加,而VNP降低CHOP的表达。以上结果表明,VNP对脑出血的保护作用可能与内质网应激的降低有关,且与内质网相关的凋亡有关。
综上所述,VNP能够降低小鼠脑出血后神经功能缺损评分,缓解脑水肿程度,对脑出血后神经损伤可能具有重要的神经保护作用,且这种保护作用与氧化应激和内质网应激密切有关。

