大鼠胰岛beta细胞截短型P糖蛋白表达的初步鉴定
申 翔,杨 蔚,李代清
(1天津市人民医院重症医学科,天津 300000;2天津医科大学朱宪彝纪念医院糖尿病研究室;3常德市第一人民医院内分泌科;*通讯作者,E-mail:daiqingli68@126.com)
2型糖尿病发病率在世界范围内呈“爆发式”增长的趋势,目前对胰岛beta细胞分泌缺陷分子靶点的研究是热点之一,其中针对胰岛素颗粒酸化、锚定、启动、融合等过程的研究还有待深入。国外文献[1]报道和我们前期研究结果[2]表明多重耐药基因Mdr1(abcb1)调控的P糖蛋白可能是参与胰岛素颗粒酸化和释放的重要分子之一,但国内该领域的研究资料却十分有限,本研究通过分析大鼠胰岛beta细胞截短型P糖蛋白的表达,为进一步探讨P糖蛋白表达对胰岛素分泌的影响提供理论依据。
1 材料与方法
1.1 实验动物
健康雄性Wistar大鼠,250-300 g,10只,由天津医科大学实验动物中心提供。
1.2 细胞与试剂
大鼠胰岛beta细胞瘤细胞系(INS-1细胞),由武汉大学细胞库提供;TrizolReagent(Invitrogen, USA),DEPC(Sigma, USA),反义核酸第一链cDNA合成试剂盒(Thermo, USA),TaKaRa LA Tag(TaKaRa, Japan),琼脂糖凝胶DNA/PCR产物回收试剂盒(BIOMIGA, USA),质粒小量提取试剂盒(BIOMIGA,USA),SYBR premix Ex TagTM(TaKaRa,Japan),罗氏地高辛标记与检测试剂盒(Roche,Switzerland),蛋白提取试剂盒(上海贝博)。
1.3 实验方法
1.3.1 基因abcb1b、abcb1a的检测 实时荧光定量PCR方法检测大鼠胰岛、INS-1细胞及肝P糖蛋白主要调控基因abcb1b、abcb1a的表达,用Trizol法分别提取大鼠胰岛、INS-1细胞、肝脏的总RNA,针对abcb1b的3′末端及5′末端设计N端引物和C端引物,并设计P糖蛋白的另一个调控基因abcb1a的引物,反应引物均出自文献[3]并经BLAST软件行同源性分析,由北京奥科生物公司合成。BioPhotometer分光光度计测定总RNA的纯度,OD260/280为1.8-2.0,电泳法测定完整性。以各RNA标本经逆转录形成的cDNA为模板进行PCR扩增,反应条件为94 ℃预变性10 min后经95 ℃变性5 s,55 ℃退火30 s,72 ℃延伸1 min,共40个循环。PCR产物行1.2%(W/V)琼脂糖凝胶电泳,以Trans2K plus DNA Marker作为分子量标记,于凝胶图像分析仪中(SYNGENE, USA)照相保存。
用试剂盒对PCR产物进行回收,取纯化PCR产物与商品化提供的pEASY T克隆载体进行连接,重组载体转入Trans1-T1感受态细胞后通过分子克隆技术获得单克隆重组质粒。应用试剂盒对重组质粒进行提取,用BioPhotometer分光光度计测其浓度,OD260/OD280在1.8-2.0。根据公式[4]:拷贝数=[质粒浓度(ng/μl)/(质粒分子量×660)]×阿伏伽德罗常数计算出各质粒拷贝数,用ddH2O行倍比稀释得到拷贝数为1×108,1×107,1×106,1×105,1×104的5种浓度梯度的质粒标准品。在Bio-RadChrom04实时荧光定量PCR仪上,选用5个不同浓度梯度的质粒标准品为模板进行荧光定量PCR反应,条件为95 ℃预变性5 min后94 ℃变性15 s,55 ℃退火20 s,72 ℃延伸20 s,共35个循环,制作标准曲线。取等量胰岛、INS-1细胞及肝cDNA为模板,用与制作标准曲线相同的反应体系和条件分别检测abcb1b N端、C端及abcb1a的绝对表达量,每次检测均带有标准曲线,检测结果数据由SDS.4软件按标准曲线自动生成。
1.3.2 大鼠胰岛abcb1b基因选择性剪切的检测 利用Northern Blot制备探针,取胰岛及INS-1细胞RNA行RT-PCR合成所需探针DNA片段,反应条件为94 ℃预变性5 min后经98 ℃变性10 s,58 ℃退火30 s,68 ℃延伸1 min,共35个循环。引物依据大鼠MDR1cDNA序列(abcb1基因序列)由Primer5软件设计并经BLAST软件行同源性分析,由北京奥科生物公司合成,产物行1.2%(W/V)琼脂糖凝胶电泳鉴定,回收纯化目的探针DNA片段,应用试剂盒进行地高辛-dUTP标记,获得Northern blot检测探针。取20 μg胰岛及INS-1细胞RNA行甲醛变性凝胶电泳,于凝胶图像分析仪中观察RNA完整性并照相保存。凝胶RNA经虹吸印迹法转移至尼龙膜上后120 ℃ 30 min烘烤固定。将地高辛-dUTP标记探针与尼龙膜置于杂交缓冲液(DIG EASY HyB,Roche)中,在杂交炉中42 ℃震荡过夜使标记探针与RNA核酸互补序列进行杂交,尼龙膜经严谨洗涤后应用试剂盒进行检测。
1.3.3 大鼠胰岛beta细胞截短型P糖蛋白的检测 采用Western blot技术,取T25细胞培养瓶对数生长期的INS-1细胞,用裂解液按照蛋白提取试剂盒说明进行操作,蛋白酶抑制剂组加入蛋白酶抑制剂“Protease Inhibitor Cocktail Tablets”(商品名:complete, ULTRA, Mini, EDTA-free, EASY, pack. Roche),无蛋白酶抑制剂组裂解液不含“Protease Inhibitor Cocktail”。BCA法测定蛋白浓度,取20 μg蛋白经10%SDS-PAGE凝胶电泳分离目的蛋白,转膜,用含5%脱脂奶粉的TBST溶液室温封闭1 h。加P糖蛋白特异性单克隆抗体C129(1 ∶200)4 ℃孵育过夜,加HRP结合的二抗(1 ∶10 000)室温孵育2 h,TBST漂洗10 min×3次,ECL增强显色,凝胶图像分析仪曝光拍照。
1.4 统计学方法
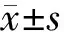
2 结果
2.1 基因abcb1b、abcb1a检测结果
大鼠abcb1bN端、C端及abcb1a目的片段经PCR扩增后1.2%琼脂糖凝胶电泳清晰可见(见图1)。实时荧光定量PCR结果显示大鼠胰岛、INS-1细胞及肝的abcb1b表达量远大于abcb1a,差异具有统计学意义(P<0.05);进一步分析结果显示大鼠胰岛、INS-1细胞的abcb1b C端拷贝数大于N端(约1.7倍),差异具有统计学意义(P<0.05),而在肝脏中abcb1b C端与N端拷贝数差异无统计学意义(P>0.05,见表1)。
1.大鼠管家基因β-actin;2.abcb1a;3.abcb1b N端;4.abcb1b C端;M.Trans2K plus DNA marker图1 大鼠abcb1b N端、C端及abcb1a目的片段PCR产物电泳图Figure 1 Electrophoretogram of PCR products of abcb1b N terminus, C terminus and abcb1a

表1 不同组织abcb1b N端、C端及abcb1a绝对定量 (×104拷贝数,
2.2 abcb1b选择性剪切的检测结果
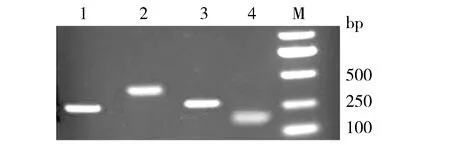
胰岛及INS-1细胞RNA经RT-PCR后1.2%琼脂糖凝胶电泳示abcb1b目的探针DNA片段清晰(见图2),abcb1b目的探针DNA片段经地高辛-dUTP标记后,按照10,3,1,0.3 pg梯度稀释探针至1 pg后仍检测清晰,探针达到预期标记效率(见图3),能够满足杂交试验的要求。胰岛及INS-1细胞RNA甲醛变性电泳示RNA 28S、18S条带清晰(见图4),表明RNA样品完整,无明显降解,RNA经转膜后与标记探针杂交可见模糊单条带(见图5)。

1.胰岛细胞cDNA为模板abcb1b目的探针DNA片段;2.INS-1细胞cDNA为模板abcb1b目的探针DNA片段;3.大鼠管家基因β-actin;M.Trans2K plus DNA marker图2 胰岛及INS-1细胞abcb1b目的探针DNA片段电泳图Figure 2 Electrophoretogram of abcb1b target probe DNA fragments in islets and INS-1 cells
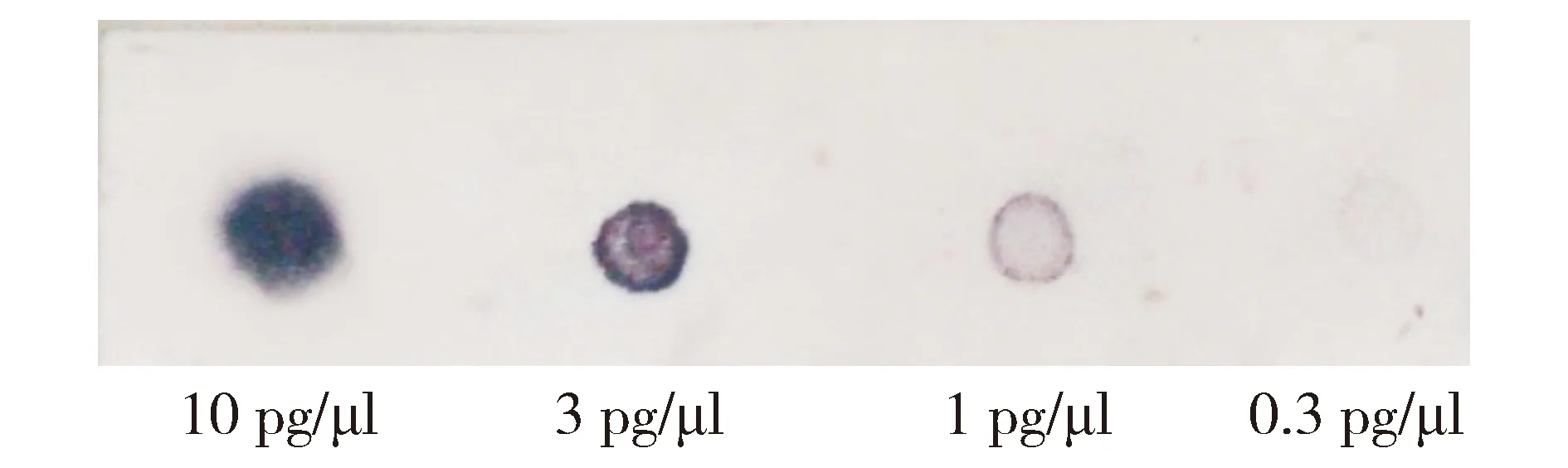
图3 地高辛-dUTP标记的abcb1b目的基因探针效率检测Figure 3 The efficiency of abcb1b probe labeled by digoxin dUTP
2.3 大鼠胰岛beta细胞截短型P糖蛋白检测结果
Western blot结果显示INS-1细胞无蛋白酶抑制剂组仅有65 kD截短型P糖蛋白的表达,而蛋白酶抑制剂保护组主要表达分子量为170 kD大小的全长P糖蛋白,截短型P糖蛋白表达显著减低,截短型P糖蛋白的组间表达差异具有统计学意义(P<0.05,见图6),无蛋白酶抑制剂组截短型P糖蛋白的表达量是蛋白酶抑制剂组的1.78±0.23倍。
图4 胰岛及INS-1细胞RNA甲醛变性电泳图Figure 4 Electrophoretogram of RNA denaturation by formaldehyde in islets and INS-1 cells

图5 胰岛及INS-1细胞RNA与标记探针Northern blot杂交结果Figure 5 Northern blot hybridization results of with labeled probe and RNA in islet and INS-1 cells
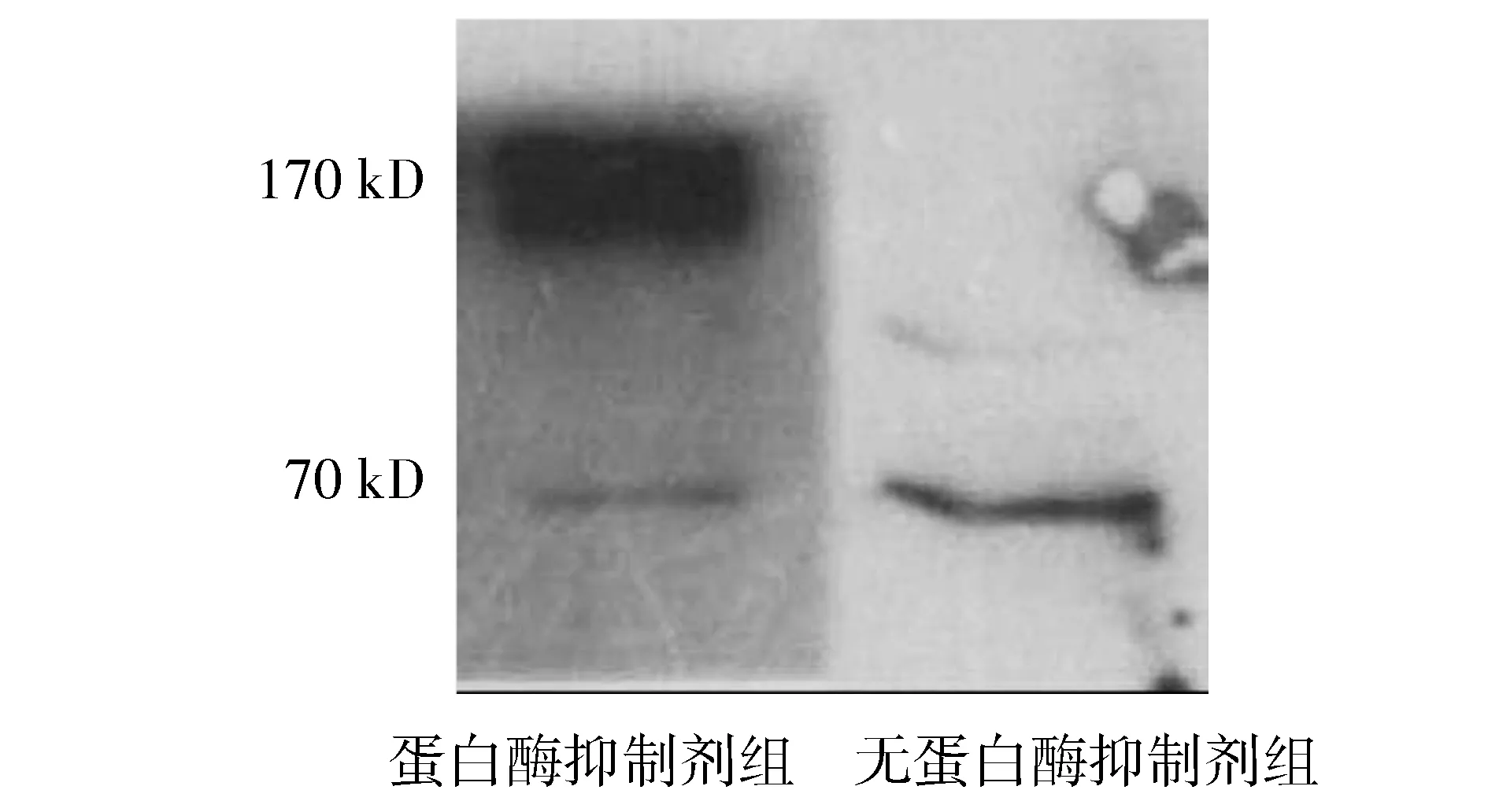
图6 Western blot测定INS-1细胞蛋白表达结果Figure 6 Protein expression of INS-1 cells by Western blot
3 讨论
P糖蛋白(P-glycoprotein,P-gp)作为多重耐药(multidrug resistance,MDR)基因MDR1/abcb1产物,于1976年首次被描述,人MDR1基因与鼠MDR1基因间的同源性为81%[5]。P糖蛋白在人体正常组织及肿瘤均有表达,不仅能够调节多种生理作用,还对肿瘤耐药机制的研究具有重要意义[6,7],众多研究结果表明P糖蛋白表达量与高血糖状态相关[8,9]。一些研究在探测某些细胞P糖蛋白时发现分子量约65 kD的P糖蛋白类似物mini-P糖蛋白(mini-P-glycoprotein)且认为其与酶原颗粒的酸化成熟相关[10],Barg等[11]研究发现小鼠胰岛素颗粒上存在mini-P糖蛋白,并进一步推断其具有类似磺脲类受体调节胰岛素释放的功能。我们前期研究发现[2,12]在INS-1细胞仅探测全长P糖蛋白表达,但在胰岛蛋白匀浆中仅探测到65 kD大小的min-P糖蛋白,而RT-PCR却证实全长P糖蛋白在胰岛中有表达且siRNA干扰实验也证实了P糖蛋白(INS-1)和mini-P糖蛋白(胰岛)与胰岛素分泌相关,因前期研究[3]已表明大鼠胰岛alpha细胞几乎不表达P糖蛋白,故对胰岛beta细胞截短型P糖蛋白表达存在与否的鉴定是进一步研究P糖蛋白与胰岛素分泌相关性的必要前提。
本研究RT-qPCR示abcb1b远大于abcb1a,大鼠胰岛abcb1b C端表达量大于N端表达量(约1.7倍),由于经典P糖蛋白分子量约是该mini-P糖蛋白的2倍,且P糖蛋白C端及N端(除去起始端10-15 kD的糖基化区域即非功能区)是高度保守区域,两端功能区的同源性达46%,故推测mini-P糖蛋白有可能是abcb1b基因在转录水平上选择性剪切造成的。虽然RT-qPCR结果显示一个基因的两端具有不同表达量,提示可能存在两个转录模板的问题,但该方法不能完全排除基因一端因降解而导致该端表达量降低的可能,故验证选择性剪切的存在需进一步进行Northern blot检测。
Northern blot是检验目的基因是否具有选择性剪切的首选方法,优势在于其特异性及直观性的结果表达:如检测到一条带,那么没有选择性剪切;如果有两条或多条,提示存在选择性剪切[13]。本研究Northern blot结果为一条带即提示并不存在选择性剪切,与RT-qPCR结果推测矛盾。因为RT-qPCR是定量观察编码P糖蛋白基因的N端与C端表达量的差异,可提示有无选择性剪切,为可能性判断。而Northern blot直观特异地证明选择性剪切是否存在,从研究目的上来说更具意义。因为考虑手工摘取胰岛方式容易有外分泌腺组织污染,胰岛匀浆制备时蛋白酶的含量比细胞株匀浆的高,从而推测前期胰岛匀浆中探测到的65 kD大小的P糖蛋白类似物很有可能是一个蛋白降解产物。进一步应用Western blot在蛋白质表达水平上检测INS-1细胞P糖蛋白,发现无蛋白酶抑制剂条件下仅检测到65 kD截短型P糖蛋白,与前期胰岛匀浆探测到的结果一致,而在蛋白酶抑制剂保护情况下主要表达分子量在170 kD大小的全长P糖蛋白且截短型P糖蛋白表达显著减低,综上结果,初步认为前期发现的大鼠胰岛beta细胞截短型P糖蛋白可能为蛋白降解产物。
一方面本实验Northern blot条带清晰度及重复性欠佳,故应进一步优化实验条件并增加阳性对照组以获得更加满意的实验结果。另一方面我们尚不能确定前期在胰岛蛋白匀浆中探测到65 kD大小的截短型P糖蛋白与Barg等[11]探测到的mini-P糖蛋白是否为同一分子。因此,仍需通过多种实验手段进一步研究P糖蛋白与胰岛素颗粒酸化及释放的关系,从而为糖尿病的治疗提供理论支持及干预靶点。

