β2AR激动剂沙丁氨醇对脂多糖诱导的急性肺损伤肺部炎症的影响及分子机制
张永红,李凤娟,刘 昀,张德信,李 维,吴媛媛,柯 蕊,孙秀珍
(西安交通大学第二附属医院呼吸与危重症医学科,西安 710004;*通讯作者,E-mail:doc-ly@sohu.com)
急性肺损伤(acute lung injury,ALI)/急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是常见的临床综合征,是指心源性以外因素,主要由严重感染、淹溺、重大创伤、吸入有毒气体和化学物质等导致急性、进行性、缺氧性急性呼吸衰竭。长期以来,国内外研究人员针对ALI/ARDS的主要发病机制炎症损伤、氧化应激损伤、气血屏障障碍进行了大量的研究,但是仍未找到行之有效的治疗措施,治疗上仍主要以对症治疗为主,ALI/ARDS患者的病死率高达30%-40%[1,2]。近20年来,可引起ALI/ARDS的新型病毒不断被发现,这些病毒严重影响人们的生活,已引起我国和世界卫生组织的高度重视,因此进一步明确ALI/ARDS发病的分子机制,寻找针对其发病机制的干预药物,对救治ALI/ARDS具有极其重要的意义[3]。研究表明,过度激活的炎症反应是ALI/ARDS发病的重要机制,炎症反应贯穿ALI/ARDS发病的整个过程[4],炎症因子在ALI/ARDS的发生以及发展中起着重要的作用,其中TNF-α,IL-1β和IL-6被认为是ALI/ARDS的治疗靶标[5]。Tristetraprolin(TTP)蛋白为内源性炎症抑制因子,能够结合含有ARE元件的mRNA并且靶向介导其快速降解,促进各种炎症因子mRNA衰减[6,7]。体内研究表明,β2肾上腺素受体激动剂能够抑制LPS诱导的肺部炎症反应,对急性肺损伤具有保护作用[8]。本研究拟探讨β2AR激动剂沙丁氨醇是否可以上调TTP蛋白的水平,从而抑制TNF-α、IL-1β、IL-6的表达,减轻ALI/ARDS炎症反应,从而为临床ALI/ARDS的治疗寻找新的有效治疗靶点。
1 材料与方法
1.1 主要试剂
LPS购自美国Sigma公司,沙丁氨醇购自于上海禾丰制药有限公司,兔抗小鼠Tristetraprolin一抗购自于美国Sigma公司,兔抗大鼠GAPDH购自于美国Sigma公司,HRP标记羊抗兔二抗购自于美国Sigma公司,ELISA测定试剂盒购自于美国R&D system。
1.2 实验动物与分组
36只6-8周雄性BALB/c小鼠随机分3组:对照组(Con)12只,无菌PBS持续雾化30 min;LPS组(LPS组)12只,浓度为2.5 mg/ml的LPS雾化液体持续雾化30 min;沙丁氨醇处理组(LPS+SALB组)12只,一次性腹腔注射5 mg/kg的沙丁氨醇,间隔30 min,再给予浓度为2.5 mg/ml的LPS溶液持续雾化30 min。
1.3 收集支气管肺泡灌洗液
雾化结束后第24小时,腹腔注射10%水合氯醛(0.8 ml/100 g)处死BALB/c小鼠,右侧支气管插管支气管肺泡灌洗,用4 ℃预冷的无菌PBS溶液0.7 ml灌洗支气管肺泡,重复灌洗3次,并收集支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)。灌洗液的回收率约为80%。回收的支气管肺泡灌洗液在4 ℃,1 500 r/min离心10 min沉淀细胞,将分离后的BALF上清在-80 ℃保存。
1.4 BALF中细胞总数计数及中性粒细胞计数
用1 ml PBS溶液重悬支气管肺泡灌洗液离心后沉淀细胞,用细胞计数板进行细胞计数,并将细胞沉淀涂片,用Wright-Giemsa染色进行中性粒细胞分类计数。
1.5 肺组织病理HE染色
取左肺下叶肺组织用4%中性缓冲甲醛液固定,石蜡包埋,切片(5 μm),苏木精-伊红(HE)染色,观察肺组织病理学变化。
1.6 Western bolt检测TTP蛋白水平
将左肺上叶提取的总蛋白用BCA蛋白定量试剂盒定量。取含有等量总蛋白的蛋白样品加入到上样孔内,电泳后将凝胶上的蛋白转移至硝酸纤维素膜,封闭后分别加TTP及GAPDH一抗溶液,4 ℃孵育过夜。PBST洗膜,滴加二抗溶液,室温孵育2 h,PBST洗膜后加入发光液,曝光,显影,定影,用Quantity One 4.6.2(美国Bio-Rad公司)凝胶成像分析仪采集底片图像并进行定量分析。
1.7 统计学分析
实验数据应用SPSS13.0软件统计分析,正态分布的计量资料以均数±标准差表示,非正态分布资料经正态转换后再进行统计学分析,多组间比较应用单因素方差分析Tukey post hoc检验,以P<0.05认为组间差异具有统计学意义。
2 结果
2.1 β2AR激动剂沙丁氨醇抑制LPS诱导的小鼠肺部炎症反应
本实验HE结果显示,对照组小鼠肺组织内肺泡结构完整,未见炎性细胞浸润;LPS模型组小鼠肺组织内皮细胞和上皮细胞被严重破坏,肺水肿、肺出血及以中性粒细胞为主的炎症细胞在肺组织内大量浸润,肺部正常的组织形态结构消失;而沙丁氨醇预处理组LPS诱导的肺部炎症损伤被显著抑制(见图1)。
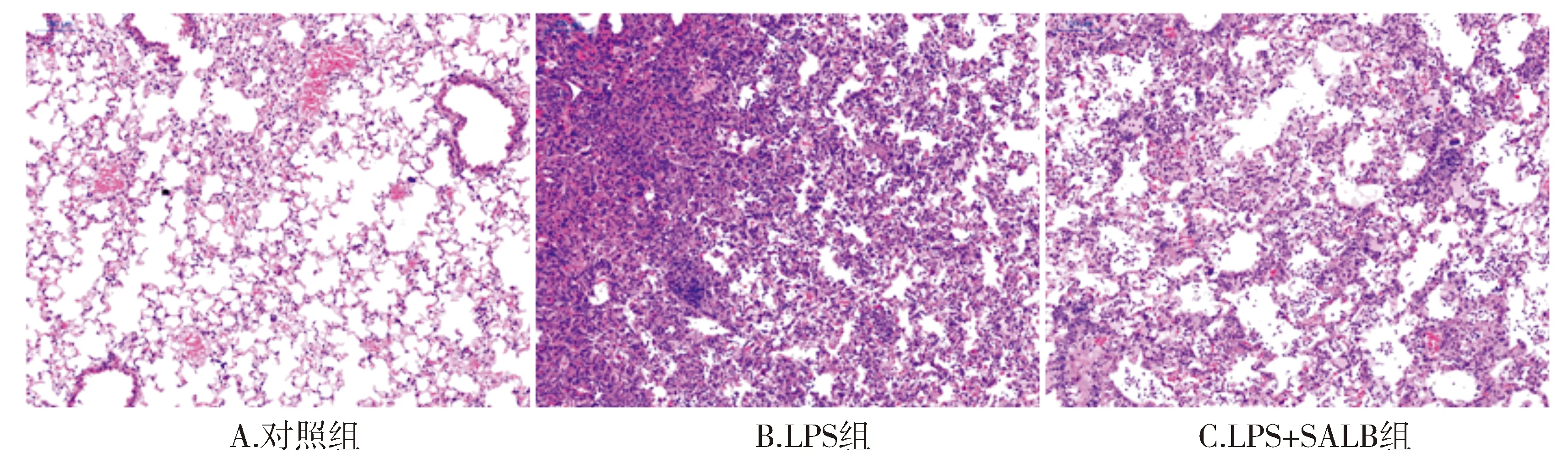
图1 β2AR激动剂沙丁氨醇对LPS诱导的ALI/ARDS小鼠肺部炎症反应的影响 (HE,×100)Figure 1 Effect of β2AR agonist salbutamol on LPS-induced lung inflammation in ALI/ARDS mice (HE,×100)
2.2 β2AR激动剂沙丁氨醇对LPS诱导ALI小鼠支气管肺泡灌洗液细胞影响
对照组小鼠支气管肺泡灌洗液细胞总数为(3.02±0.29)×106/ml、中性粒细胞计数为(1.73±0.16)×106/ml,LPS组小鼠支气管肺泡灌洗液细胞总数上升为(12.23±2.46)×106/ml、中性粒细胞计数升高为(7.84±1.16)×106/ml,与对照组比较均明显升高,差异具有统计学意义(P<0.05,见图2);而沙丁氨醇预处理后,LPS+SALB组小鼠支气管肺泡灌洗液细胞总数为(6.13±1.26)×106/ml、中性粒细胞计数为(4.12±0.79)×106/ml,与LPS组比较差异具有统计学意义(P<0.05,见图2),提示β2AR激动剂沙丁氨醇能够抑制LPS诱导的小鼠肺部炎性细胞浸润。
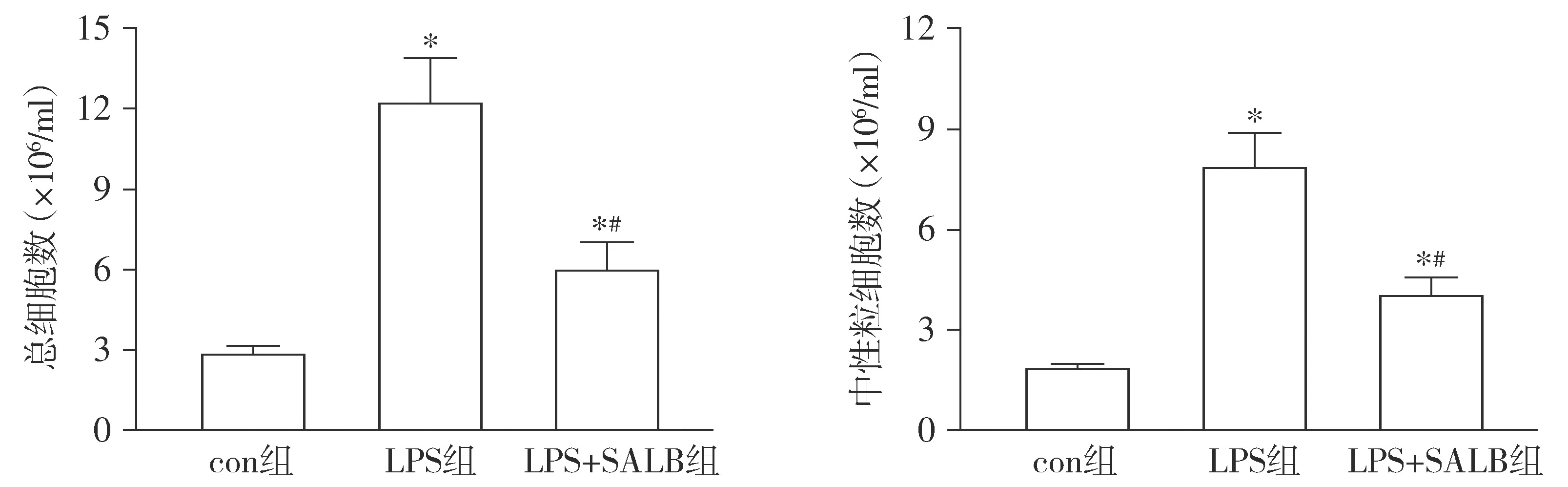
与对照组比较,*P<0.05;与LPS组比较,#P<0.05图2 β2AR激动剂沙丁氨醇对LPS诱导ALI/ARDS小鼠支气管肺泡灌洗液细胞的影响 (n=12)Figure 2 Effect of β2AR agonist salbutamol on bronchoalveolar lavage fluid cells in LPS-induced ALI/ARDS mice (n=12)
2.3 β2AR激动剂沙丁氨醇对LPS诱导ALI/ARDS小鼠支气管肺泡灌洗液中TNF-α,IL-1β和IL-6的影响
炎症因子是ALI/ARDS炎症反应强度的关键指标。LPS组小鼠气管肺泡灌洗液TNF-α浓度为(513.23±75.11)pg/ml,较对照组[(19.53±2.61)pg/ml]明显升高,差异具有统计学意义(P<0.05,见图3);应用沙丁氨醇预处理后,LPS+SALB组小鼠支气管肺泡灌洗液TNF-α浓度下降为(291±52.31)pg/ml,较LPS组明显减低(P<0.05)。LPS组小鼠气管肺泡灌洗液的IL-1β为(212.63±37.65)pg/ml,较对照组[(22.54±3.41)pg/ml]明显升高(P<0.05),LPS+SALB组小鼠支气管肺泡灌洗液的IL-1β水平为(83.24±21.34)pg/ml,较LPS组明显减低(P<0.05,见图3)。LPS组小鼠气管肺泡灌洗液的IL-6为(1 127.15±97.65)pg/ml,较对照组[(21.13±3.11)pg/ml]明显升高,差异具有统计学意义(P<0.05),LPS+SALB组小鼠支气管肺泡灌洗液的IL-6水平为(614±45.24)pg/ml,较LPS组明显减低(P<0.05,见图3)。提示β2AR激动剂沙丁氨醇预处理可以降低LPS诱导小鼠支气管肺泡灌洗液中TNF-α,IL-1β和IL-6的水平。

与对照组比较,*P<0.05;与LPS组比较,#P<0.05图3 β2AR激动剂沙丁氨醇对LPS诱导的ALI/ARDS小鼠支气管肺泡灌洗液中TNF-α,IL-1β和IL-6的影响 (n=12)Figure 3 Effect of β2AR agonist salbutamol on TNF-α,IL-1β and IL-6 in bronchoalveolar lavage fluid in LPS-induced ALI/ARDS mice (n=12)
2.4 激活β2AR激动剂对LPS诱导ALI/ARDS小鼠肺组织TTP蛋白的影响
Western blot结果显示,对照组小鼠肺组织内的TTP蛋白表达水平非常低,LPS组小鼠肺组织内TTP蛋白水平明显增加,是对照组的1.81倍,与对照组比较差异具有统计学意义(P<0.05);沙丁氨醇预处理后,LPS+SALB组小鼠肺组织内TTP蛋白水平进一步升高,是对照组的3.37倍,与LPS组比较差异具有统计学意义(P<0.05,见图4),提示沙丁氨醇预处理后,可以增加LPS组小鼠肺组织内TTP蛋白水平。
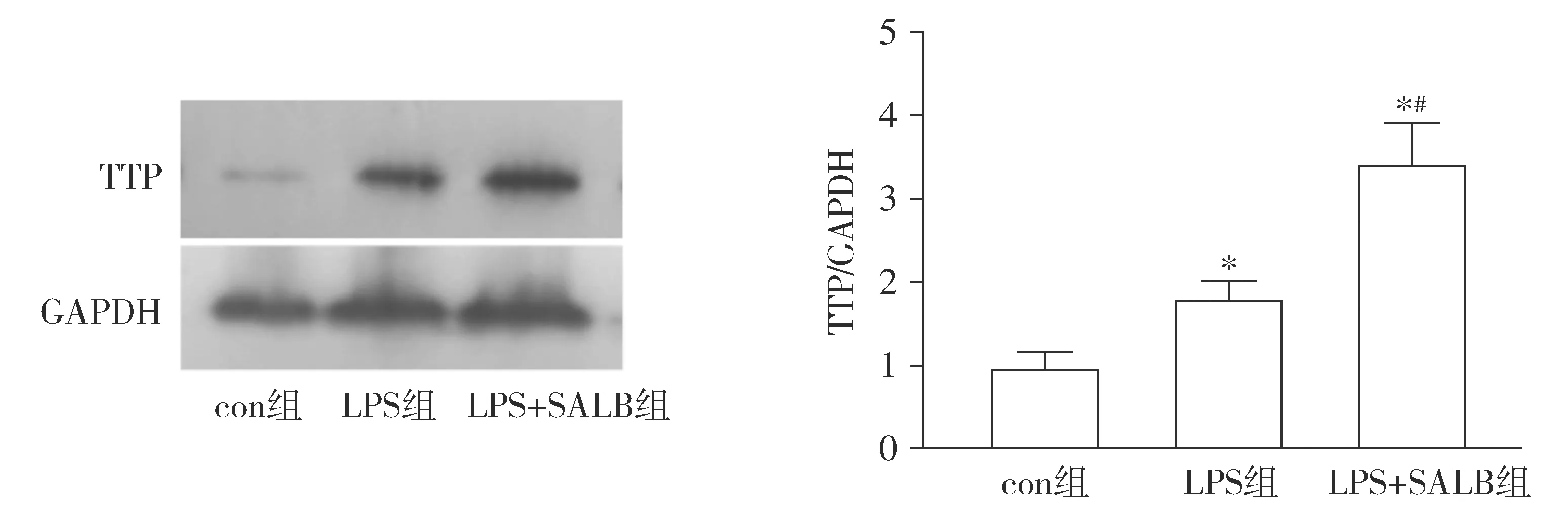
与对照组比较,*P<0.05;与LPS组比较,#P<0.05图4 沙丁氨醇对LPS诱导ALI/ARDS小鼠肺组织TTP蛋白表达的影响 (n=3)Figure 4 Effect of salbutamol on TTP protein levels in lung tissue of LPS-induced ALI/ARDS mice (n=3)
3 讨论
本研究探讨了β2AR激动剂沙丁氨醇在LPS诱导的ALI/ARDS中的作用及其可能的分子机制。在LPS诱导的ALI/ARDS模型中,小鼠的肺组织内皮细胞和上皮细胞被严重破坏,肺水肿、渗出,以中性粒细胞为主的炎症细胞在肺组织内大量浸润,肺部正常的组织形态结构消失;BALF中细胞总数,中性粒细胞分类计数及支气管肺泡灌洗液中TNF-α、IL-1β、IL-6水平均显著升高;提示过度激活的炎症反应是ALI/ARDS发病的重要机制[4]。而应用β2AR激动剂沙丁氨醇预处理后,LPS+SALB组小鼠肺组织中TTP蛋白水平显著升高,伴随肺部炎症反应减弱,提示β2AR激动剂沙丁氨醇能通过增强TTP蛋白的表达,抑制LPS诱导的ALI/ARDS模型小鼠肺部炎症细胞的浸润和炎症因子的合成,减轻肺部炎症损伤。
ALI/ARDS表现为肺部炎症呈级联放大并继发弥漫性肺损害,炎症细胞和炎症因子在ALI/ARDS的发生以及发展中起着重要的作用[9]。肺泡巨噬细胞、中性粒细胞、气道上皮细胞源性TNF-α、IL-1β、IL-6被认为是ALI/ARDS的治疗靶点,阻止上述因子的表达对ALI/ARDS具有显著保护作用。研究表明转录后调节是炎症因子重要的调节方式,炎症因子转录后调节主要依赖其mRNA 3′UTR区的ARE特殊元件介导其降解,其决定着mRNA半衰期,进而负性调节蛋白的表达[10]。TTP蛋白是一种ARE结合蛋白,调节富含ARE mRNA的不稳定性,其促进许多炎症因子和趋化因子(TNF-α、GM-CSF、IL-2、IL-3、IL-6、CCL2、CCL3和COX2)mRNA的降解,从而抑制其表达[11,12]。研究发现TTP蛋白参与调节单核巨噬细胞炎症因子的表达,以及炎症细胞的活化,在炎症性疾病如结肠炎[13]、系统性红斑狼疮[14]、类风湿性关节炎[15]、动脉粥样硬化[16]、内毒素血症[17]、急性肺损伤[18]等起着重要的作用。
在LPS诱导的ALI模型中,吸入低剂量一氧化碳,可以上调TTP蛋白的表达,抑制炎症因子TNF-α、IL-1β和IL-6的表达,对LPS诱导的ALI/ARDS起显著的保护作用[18],提示TTP蛋白参与ALI/ARDS发生发展,可能是ALI/ARDS的治疗靶点。人类TTP蛋白的编码基因ZFP36位于染色体19q13.1,由2个外显子和1个内含子组成。人类ZFP36启动子区域含有多个高度保守的调节元件,与转录因子EGR-1(early growth response-1),TPE1(TTP promoter element 1),AP-2(activator protein-2)和SP-1(specificity protein-1)结合调节TTP基因的转录和表达[11]。研究表明β2肾上腺素受体(β2 adrenergic receptor,β2AR)激动剂、cAMP类似物、内毒素、TGF-β、糖皮质激素、绿茶和肉桂均可以上调TTP mRNA的转录以及表达[19]。体内研究表明,β2AR激动剂能够抑制LPS诱导的ALI/ARDS肺部炎症反应,对急性肺损伤具有保护作用[20]。体外研究表明β2AR激动剂以及cAMP类似物可能通过上调AP-2转录因子增加单核巨噬细胞TTP mRNA和蛋白表达[21];β2AR激动剂亦可以上调TTP蛋白表达,抑制脂肪细胞IL-6的表达[22]。本研究结果提示,在LPS诱导的ALI/ARDS小鼠模型中,BALF中性粒细胞和炎性因子TNF-α、IL-1β、IL-6升高,肺组织组织结构破坏,肺组织TTP蛋白水平升高,LPS在激活炎症炎症反应的同时,亦激活TTP蛋白的表达,提示TTP是一个广泛参与炎症因子转录后负性控制的调节因子[6],上调内源性TTP活性抑制炎症因子表达,可能对ALI/ARDS发挥保护作用。沙丁氨醇处理组小鼠肺组织中的TTP蛋白进一步升高伴随肺部炎症细胞和炎症因子下降,提示沙丁氨醇可能通过提高内源性TTP蛋白水平抑制LPS诱导的ALI/ARDS肺部炎症反应,从而发挥保护作用,其机制可能为沙丁氨醇上调AP-2转录因子增加TTP mRNA转录和TTP蛋白表达[21]。

