胎儿主动脉弓缩窄与染色体异常的关系探讨
李晓兰,赵金财,冯文娟,张思敏
主动脉弓缩窄(CoA)在先天性心脏病中的发生率为5%~8%[1]。胎儿期的CoA主要为导管前型,常位于左锁骨下动脉远端和动脉导管邻接处[2]。CoA的主要特征是先天性主动脉狭窄或闭塞所致主动脉乃至其它脏器的血运循环障碍。目前认为发病原因与遗传因素、环境因素、感染因素等均相关[3],其中遗传因素所占比例最多[4],还有一部分是由于染色体的畸变所致[5]。本研究探讨CoA胎儿发病机制与染色体异常因素的关系,以降低出生缺陷的发生。
1 资料与方法
1.1 一般资料:选取2017年1月-2020年1月在本院行产前超声检查疑似CoA的胎儿建议转诊至上级产前诊断中心明确诊断为CoA患儿10例,且均行细胞遗传学检查。孕妇均有准确的停经史(孕周根据正常末次月经第1天确定),排除严重心脏畸形(例如完全性心内膜垫缺损、单心室、法洛四联症、完全性大动脉转位等)的胎儿。符合以上标准纳入组,所有孕妇了解检查内容及项目并均签署知情同意书。产前超声诊断CoA后,告知孕妇结果并建议行染色体核型、染色体微阵列分析(CMA)检查。
1.2 方法
1.2.1 产前超声检查:采用飞利浦EPIQ5超声诊断仪进行产前超声检查(选用突阵探头,频率为3~5 MHz),对10例确诊为CoA的胎儿的超声诊断、染色体检查报告以及随访结果进行分析。
1.2.2 遗传学检查:①标本采集。超声引导下行羊膜腔穿刺术,提取羊水标本,引产胎儿可取皮肤组织、脐带组织标本。②遗传学检查方法。细胞遗传学核型分析是将采集到的标本进行细胞培养、染色体制备及G显带核型分析,并按照人类细胞遗传学国际命名体制描述核型。CMA是一种高分辨率分子遗传学技术,对提取到的细胞基因组DNA进行芯片检测与分析。
1.3 CoA产前超声心动图综合诊断标准[6-7]:二维超声心动图显示,即:①肺动脉内径(PA)与主动脉(AO)内径之比>1.4;②AO及主动脉弓内径变细;③右心室横径与左心室横径之比>1.3。主动脉弓长轴切面显示,主动脉弓形态僵直呈现“支架征”;CDFI显示主动脉弓部血流信号减少,甚至会出现血流信号反向;频谱多普勒检查,主动脉弓部可探及反向的血流频谱。
1.4 统计学方法:采用描述性统计方法。
2 结果
2.1 CoA胎儿产前超声影像学表现:横弓发育不良与峡部缩窄同时存在者2例,峡部局限性缩窄6例,主动脉弓管状发育不良2例,均合并其它心内或心外异常,见表1,超声声像见图1-3。
2.2 CoA胎儿染色体检查结果:10例胎儿均行染色体核型、CMA检测,无异常6例,异常4例,分别是:45,XO、46,XN,arr[hg19]17q12(34,822465-36,418,529)、46,XN,arr[hg19]22q11.21(18,631,364-21,800,471)、47,XN,seq(18)&3异常各1例。
2.3 CoA胎儿随访结果:10例胎儿中选择终止妊娠5例,出生后行室间隔缺损修补术1例,余4例出生后行超声心动图检查且表型正常,发育尚好,由于这部分婴儿出生后较小,很多表型还未表现出来,将持续跟踪随访。
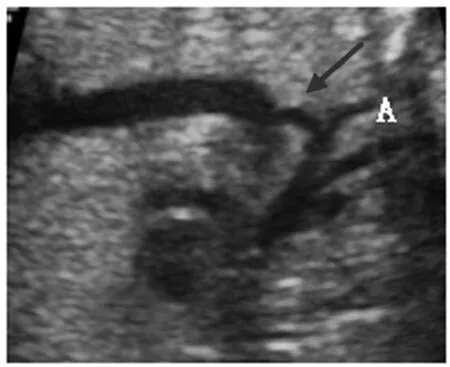
图1 主动脉弓缩窄的二维超声声像图(箭头示峡部)
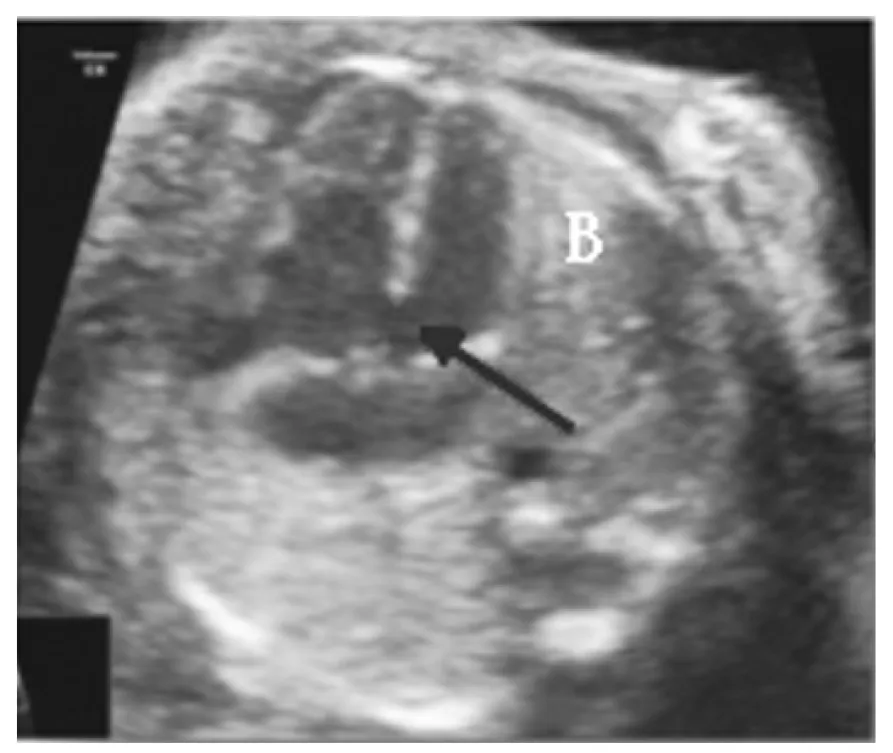
图2 室间隔缺损的二维超声声像图(箭头示缺损部位)

图3 双肾回声增强、左肾集合系统分离的二维超声声像图
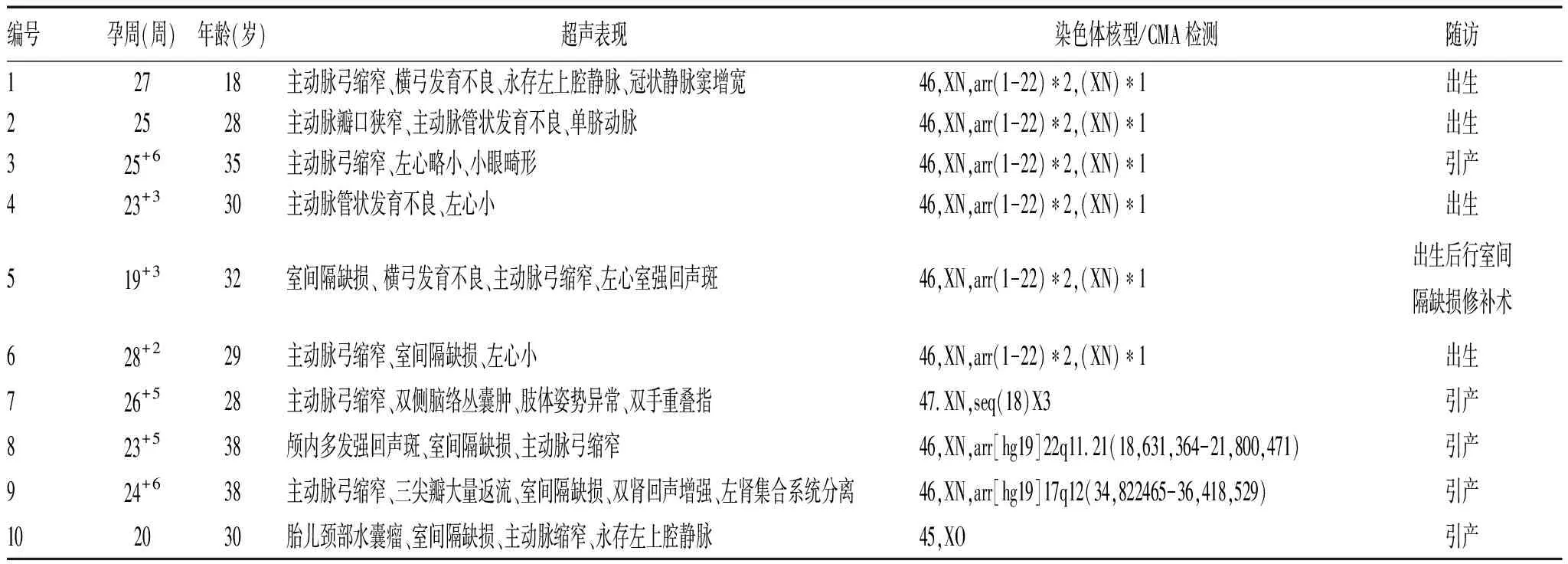
表1 10例胎儿的超声检查表现、染色体结果及随访
3 讨论
胎儿期的主动脉弓在发生发育时,因为不同因素的出现导致其发育或分化失败,就会出现主动脉弓的发育异常。本组10例CoA胎儿的超声表现为主动脉峡部局限性缩窄、主动脉弓管状发育不良以及横弓发育不良和峡部缩窄同时存在,这是由于大血管不同部位的发育异常致使CoA出现不同分型。
有文献报道[8]染色体核型为45,XO(特纳综合征)患儿易合并CoA;有研究认为CoA是左侧第4和第6弓动脉的分化异常所致;也有研究认为与染色体22q11微缺失综合征有关,可能与神经嵴细胞异常迁移、分布有关[9]。Lee等[10]学者报道了53例22q11微缺失综合征胎儿的先天性心脏病的表型,其中7.5%(4/53)为CoA。本研究4例染色体异常的胎儿,分别是:45,XO、46,XN,arr[hg19]17q12(34,822465-36,418,529)、46,XN,arr[hg19]22q11.21 (18,631,364-21,800,471)、47,XN,seq(18)&3。以上几例胎儿均合并心外异常,且主要是颅内异常及肾脏的发育异常,笔者猜想可能是因为肾脏和大脑为丰富血供器官,CoA出现后,使得流经这些脏器的血供不足或血流分布异常有关。
本研究产前诊断为CoA的胎儿,现已出生5例,目前随访至产后1~3个月,均行超声心动图检查。其中1例行室间隔缺损修补术,CoA未达手术指标;余4例新生儿心脏听诊无明显杂音,无明显气促、喂养困难等症状,无明显上下肢脉压差。该4例新生儿在行产前多次超声复查时,缩窄段均无明显加重趋势,且胎儿各项指标均正常。分析原因,可能是极轻度CoA但对其生长发育没有太大的影响,说明胎儿CoA在发育过程中或许存在自我修补功能,也可能是出生后血流动力学改变,消除了继发因素。根据手术后1例新生儿超声检查跟踪随访和临床观察,我们也认识到一些CoA不一定在出生后立刻需要手术,未达手术指标者可先观察病情的改变。出生的胎儿中行CMA检查结果均正常(包括手术1例),提示染色体检测正常更有利于指导孕妇的妊娠。本研究终止妊娠者5例,其中4例为致病性染色体异常,另外1例可能与孕妇过度担心以及对该病的认识不足有关。本研究结果显示,并非所有CoA胎儿出现严重的临床症状,有些极轻度CoA并不影响日后的发育,可予以期待。
综上所述,由于胎儿期CoA的病理生理改变是渐进性的,加之胎儿期特殊的血流循环学特点,使得产前诊断CoA时需要格外慎重。本文浅谈CoA胎儿与染色体异常的关系,并随访到一部分出生后表型尚正常的胎儿,认为产前超声疑诊断主动脉弓缩窄胎儿时,建议行细胞遗传学检查及定期进行超声复查,以此判断胎儿CoA的发展趋势,为孕妇的妊娠指导提出更合理的参考依据。

