教学不止于课堂
——从一个显色实验的准备探讨理论到实践过程
赵子豪, 杨天嘉, 郑 浩, 张 利, 马 荔
(上海交通大学化学化工学院,上海200240)
0 引 言
为庆祝我校学化工学院建院90 周年,计划设计一个变色实验。在舞台上,将1 瓶无色的液体加入量杯中,可以变为红、黄、绿、蓝、紫5 种颜色的溶液。这5种颜色分别代表着责任与激情,理想与梦想,环保、和平与安全,宽广的胸怀以及好奇心。一方面是学院对学生期望,另一方面也是响应习总书记把思想政治教育贯穿教育全过程的指示[1-3],发挥好课堂教学主渠道作用,积极探索“课程思政”在基础科学课堂中的形式。
作为一名化学专业的学生,自然想到的就是使用酸碱指示剂和酸碱溶液之间的变色反应实现这一设想。同一种指示剂在不同的pH值条件下呈现出不同的颜色,但是由于指示剂的变色范围一般较窄,因此通过控制恰当的pH 值来控制颜色相对较难,且能够出现的颜色有限[4]。因此设计了另一种方法:将几种不同的指示剂混合,在不同的比例下,可以使同样pH的溶液呈现出不同的颜色,而呈现出的颜色仅与指示剂的配比、用量有关[4]。
酸碱指示剂一般是有机弱酸或弱碱,当溶液中的pH值改变时,指示剂由于结构的改变而发生颜色的改变[5-6]。酸碱指示剂分子在不同酸碱性的溶液中因电离程度不同而产生颜色变化,其根本原因是分子结构发生了改变,如图1 所示[5-7]。如果在具有某pH值的溶液中加入两种或两种以上的酸碱指示剂,溶液中指示剂分子的结构变化是互不干扰、分别进行的,因此宏观上就会显现出两种酸碱指示剂在此pH下所显颜色的混合色[8]。如果对pH 值、酸碱指示剂配比等变量进行控制,那么理论上可以根据美术中的调色原理得到各种颜色的溶液。
由于在碱性条件下,酚酞指示剂可使溶液显粉红~紫红色(pH >9.1),对硝基苯酚指示剂可使溶液显黄色(pH >7.4),百里酚蓝指示剂可使溶液显蓝色(pH >8.9),与美术三原色(红、黄、蓝)相近。因而以酚酞、对硝基苯酚和百里酚蓝3 种指示剂为基础,按一定比例混合即可调配得到碱性条件下显各种颜色的混合指示剂。
因此选定了NaOH溶液、酚酞试剂、对硝基苯酚试剂以及百里酚蓝试剂,进行实验。
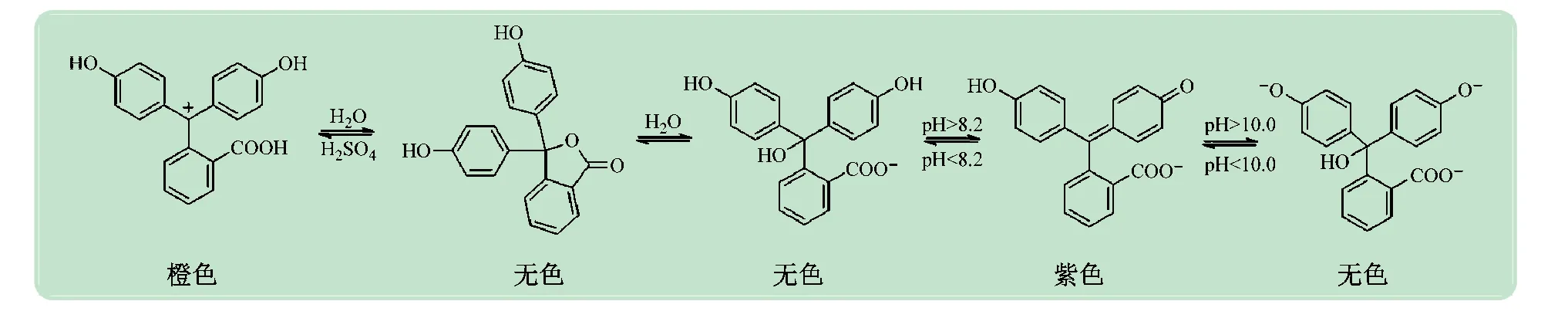
图1 酚酞显色与其分子结构变化的关系[5-7]
1 实验室常规实验确定酸碱指示剂配比和NaOH溶液的浓度
尽管确定了所需试剂及指示剂,但是随即发现,所得溶液的颜色不仅受pH 值和酸碱指示剂的影响,在不同的容器中,肉眼所见同一种溶液的颜色也不完全相同。这是由溶液本身的透明性和形状的可塑性造成的。对于透明物质,在外界光源照射下,有一部分波长的光被物质吸收,另一部分波长不被吸收的光而得以透射,这部分透射光的颜色即为透明物质的颜色,因此在不同的外界光源下,物质的颜色也会发生变化。这些外界环境因素给颜色的调配带来了新的困难。
实验原本仅设计为通过调控酸碱指示剂的比例和加入量而得到不同颜色(红、黄、绿、蓝、紫)的碱性溶液,用于趣味实验的展示活动。但是在准备过程中发现,不仅酸碱指示剂的比例和加入量对溶液的颜色有着显著影响,外界的光源和盛装液体的容器等外界环境条件也对溶液的颜色产生了干扰。因而依据实验展示处的环境对溶液颜色进行了进一步校正:对于容器形状的影响,选择通过微调酸碱指示剂的加入量进行校正;而对于外界光源的影响,选择通过控制溶液的pH值(碱浓度)进行校正。校正完毕之后,得到了理想的展示效果。
从一个简单的指示剂显色实验设计,到发现意料之外的问题,再到根据实际情况提出猜想解决问题,并最终总结解决通用思路,体现了完整的实验创新思维。
实验计划配制红、黄、绿、蓝、紫5 种颜色的溶液(理论上配制其他颜色的溶液亦可),其中黄色溶液可以直接通过加入对硝基苯酚指示剂、蓝色溶液可以直接通过加入百里酚蓝指示剂配制得到,无需进行不同指示剂的配比实验,但是仍然需要确定对应指示剂的加入量。此处需要注意的是,红色溶液不可以通过直接加入酚酞指示剂得到,因为酚酞指示剂在碱性下呈现紫红色,并非所要求的正红色。
2 实验室中确定酸碱指示剂配比和用量
预实验一般可认为是小试实验,重点是用少量的试剂确定实验条件,选择先在20 mL量杯中进行调色实验。为了让实验能够很美观展示给所有的观众,计划选用500 mL量杯进行显色实验。
根据调色原理,初步确定了配制5 种颜色溶液所需的酸碱指示剂种类。并通过实验确定了对应不同颜色指示剂的配比。根据在20 mL量杯中的用量成比例计算得到在500 mL量杯中的用量(见表1)。
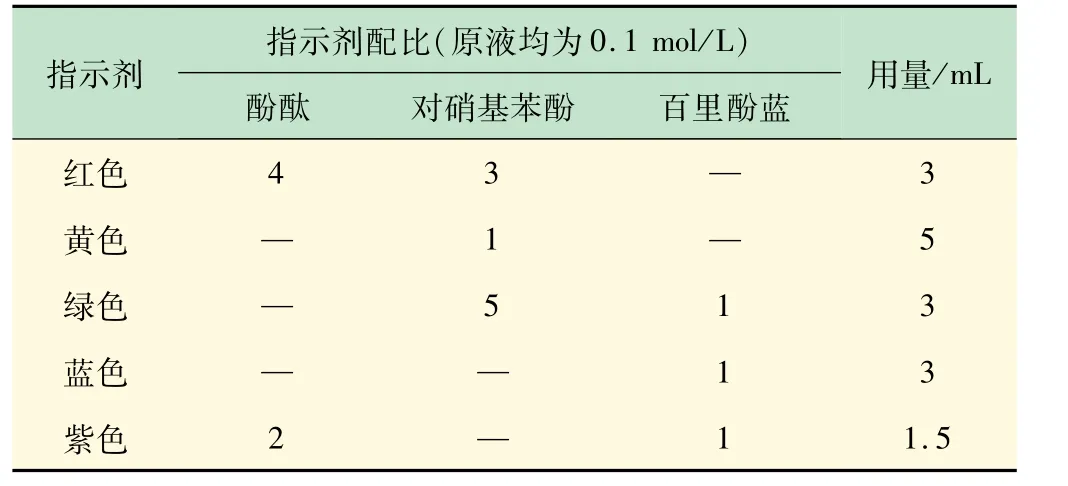
表1 不同颜色溶液所需指示剂的对应配比
按照表1 所示的配比,即可配制所需要的5 种颜色对应的指示剂。根据用量取指示剂,并加入定量的NaOH溶液即可得到所需的5 色溶液,如图2 所示。

图2 以20 mL量杯为容器的5色溶液
3 容器对溶液颜色的影响
如前所述,在20 mL量杯中进行预实验得到理想的颜色,确定了酸碱指示剂的配比,并计算确定了在500 mL量杯中所需各指示剂的体积,对应的酸碱指示剂浓度和pH 值相同,所以溶液的颜色也应当与预实验相同。但是使用500 mL 量杯进行实验时却发现并非如此,对应的溶液颜色与20 mL量杯中溶液相比较浅(见图3)。

图3 以500 mL量杯为容器的5色溶液
这是由于溶液是澄清透明的,且形状具有可塑性,因此在不同容器中光的透过性不同,相同容器的不同部位光的透过性也不同,造成视觉上溶液的深浅程度不同。
根据物质的吸收定律[9-10]:
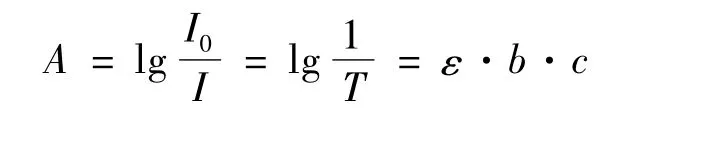
式中:I0/I 为透过率;b 为溶液的厚度;c 为溶液的浓度。
可见,人眼观察的溶液颜色与光透过的情况有关系的,而光透过的情况与溶液的厚度有密切关系,因此容器的大小和形状对光的透过情况有极大的影响。这也可以解释观察到的现象。但是经观察发现,后一种因素导致的溶液深浅差异较小,可以忽略不计。分析原因是500 mL量杯体积远大于20 mL量杯,进入前者的光量大,也就是能够进入其中的光子数多,使得溶液得以被“照亮”,相比于20 mL量杯,溶液的颜色较浅。
容器的影响对红色、黄色、绿色溶液较为显著,而对于颜色较深的蓝色和紫色溶液,虽然颜色变浅,但由于溶液本身颜色较深,因而影响不大。于是,又使用500 mL量杯进行实验,对酸碱指示剂的配比和用量进行了校正,数据见表2。

表2 不同颜色溶液所需指示剂的对应配比校正
4 光源对溶液颜色的影响
预实验所采用的光源为自然光(白光),但是实验展示场地的照明灯光为色彩偏黄的筒灯,且光强非常大,这又使得溶液的颜色出现了偏差。红色溶液的颜色偏向碱性环境下酚酞的粉红色;绿色溶液则偏蓝,呈现蓝绿色,导致和蓝色溶液之间没有显著的色彩差异;而黄色溶液的色彩则几乎无法被明显地观察到,近乎无色。蓝色溶液和紫色溶液虽然颜色与自然光下有少许不同,但是并未出现较大的色彩偏差。
如前所述,对透明物质来说,在外界光源照射下,有一部分波长的光被物质吸收,而另一部分波长的光不被吸收而得以透射,这部分透射光的颜色即为透明物质的颜色。根据这一原理,对上述5 种溶液进行了紫外-可见吸收光谱测试(见图4)。谱图中,谱峰所在位置的波长对应溶液自身颜色的补色。读出谱峰所在波长,将一条谱线中多个谱峰对应的颜色混合而成的颜色即为溶液颜色在色环中的补色[4](见图5),由此可以判断溶液的颜色(即透射光颜色)。以绿色溶液的谱图为例,该谱线在紫色和橙色光处有峰,将紫色与橙色光调和之后为玫红色光,其对应补色光恰为绿色光。同理可以利用紫外-可见吸收光谱图解释其他的几种颜色溶液。因此可以判断,紫外-可见吸收光谱可用来表征本实验中5 种溶液的颜色。
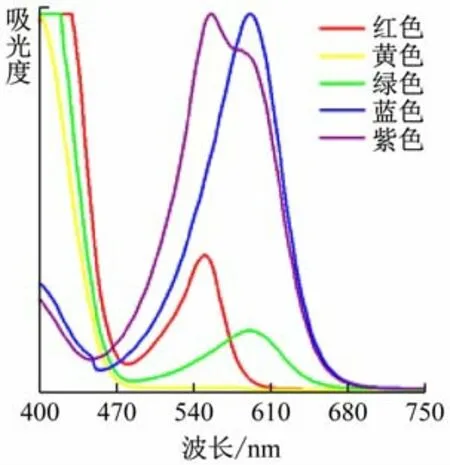
图4 5色溶液的紫外-可见吸收光谱图

图5 颜色互补色环
为了排除场地灯光照射时溶液中出现化学反应的可能性,将5 种溶液置于场地灯光下照射一段时间后,再将各色溶液置于白光下观察,肉眼发现颜色与预实验时一致。再进一步对它们进行紫外-可见吸收光谱测试,谱线并未出现明显差异,见图6,证明溶液中没有发生化学变化。
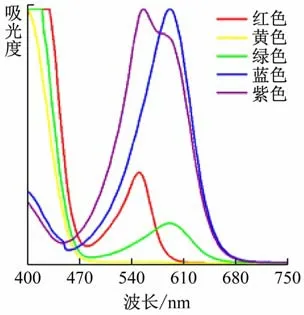
图6 场地灯光照射后的5色溶液紫外-可见吸收光谱图
结合所加入酸碱指示剂的种类考虑,红色溶液所含酸碱指示剂为酚酞和对硝基苯酚,绿色溶液为百里酚蓝和对硝基苯酚,而黄色溶液全部为对硝基苯酚。在偏黄的灯光照射下,此3 种溶液中对硝基苯酚的颜色均没有很好地显现出来,而呈现出类似不含对硝基苯酚时的碱性溶液颜色。可以认为,由于场地的光源色彩偏黄,使得整个场地均呈现出偏黄的色彩。因此对硝基苯酚在碱性下所显现出来的黄色在整个场地的映衬下不够鲜明,因而难以被观察到。此外,本身不含有对硝基苯酚指示剂的蓝色和紫色溶液受到场地灯光影响不大,仍然呈现较为理想的颜色,这一实验现象证明了对实验结果的预计。
接着对红色、黄色和绿色溶液的颜色进行校正。由于对硝基苯酚的颜色不够鲜明,因此首选调整酸碱指示剂配比和加入量来提高对硝基苯酚在溶液中所占的比重。对于红色和绿色溶液,提高对硝基苯酚所占的比例;对于黄色溶液,则选择增加对硝基苯酚的加入量。校正之后发现,提高对硝基苯酚比例对绿色溶液的效果较好,所得色彩较为理想,但是对于红色和黄色溶液却收效甚微。因此对于红色和黄色溶液,不再提高对硝基苯酚比例,而选择提高碱液浓度(pH 值)。在红色和黄色溶液中,使用0.1 mol/L NaOH 溶液,这使得溶液色彩加深效果大大提高,取得了理想的效果。而对于绿色、蓝色和紫色溶液,若使用0.1 mol/L NaOH溶液,会使得溶液颜色过深,影响展示效果。
另外,由于展示现场光强远大于预实验时的自然光强,使得各色溶液色彩均产生了一定程度的变浅。因此对酸碱指示剂的加入量也进行了微调,得到满意的结果。最终配比和用量如表3 所示。
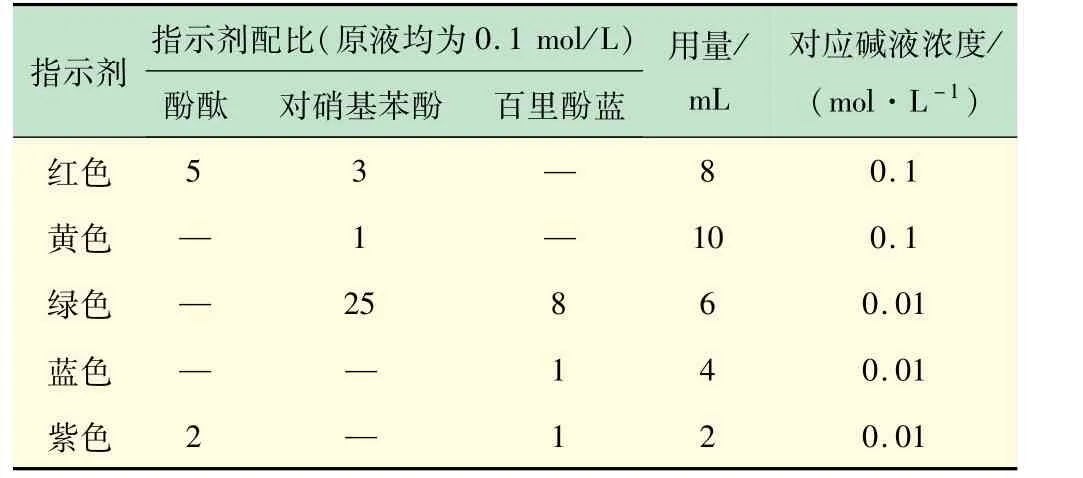
表3 偏黄灯光下不同颜色溶液所需指示剂的对应配比校正
5 结 语
本实验的出发点原本为一个简单的酸碱指示剂变色实验,创新点在于将酸碱指示剂按照不同的比例和用量混合,使用类似美术调色的方法,可以在碱性条件下配制出理论上各种颜色的溶液,用于趣味实验展示。但是在实验准备阶段发现,有诸多因素会对人眼观察溶液的颜色产生影响。因此不仅对酸碱指示剂的配比和用量对溶液颜色的影响进行了研究,还对容器形状、外界光源等因素对溶液颜色的影响进行了讨论,并通过调控酸碱指示剂配比、指示剂用量以及碱浓度(pH值)等参量得到了各种环境下理想的溶液颜色。
本实验不仅能让学生了解化学知识,培养学生学会发现问题、思考问题、解决问题的方法,学会学习,形成创新精神和实践能力等,并且通过动手探究的过程,进一步把握化学学科所蕴含的思政人文精神。通过实验,学生从内心确立起对科学之美的价值追求。这也是将育人贯穿于专业课程教学的全过程,将学生为中心的理念贯穿教学全过程[12-13]。
化学学科中蕴含着丰富的思政元素,只有善于挖掘出思政元素,才能实现与课堂内外的自然融合[15-16],用辩证唯物主义思想去分析问题,反思实验,不仅有助于学生专业知识的学习和动手操作技能的培养,更有助于学生形成科学的思维方式[16]。
本实验尽管化学原理简单,但实验过程伴随着物理因素影响,无形中产生了新的现象,是实验前始料未及的。该实验反映了麻雀虽小,五脏俱全,囊括了提出设想、遭遇问题、探究原理、解决问题等许多学术实验中遇到的常见过程。不仅体现的是实验室基本实验到应用于实际的过程,还体现了物理、化学、美术等多学科的原理对一个展示实验的影响,对一个简单的趣味实验追根溯源,体现了化学实验中的许多探究和创新方法,是一个完整的实验探究过程。这一实验的探索过程,反映了在科研探究中应当采取的态度,对探索基于化学学科的课程思政和培养学生对化学实验的兴趣有着重要意义,同时也为广大化学工作者带来了启迪。

