酸化奶饲喂量对荷斯坦犊牛生长及断奶后期瘤胃菌群的影响
李叔臻,王雅晶,董旭明,朱 云,王雅春,曹志军,李胜利,马 云,淡新刚,康晓龙,史远刚
(1. 宁夏大学农学院,银川 750021;2.中国农业大学动物科技学院,北京 100083)
我国作为奶牛养殖大国,规模化和集约化奶牛场建设加快,奶牛各生长阶段饲养管理技术与营养调控手段不断发展,犊牛培育环节直接影响成年奶牛生产性能和经济效应, 受经营者重视[1-2]。瘤胃发育是犊牛培育环节重要部分。进食初乳后,其消化代谢产物影响犊牛瘤胃发育和微生物区系建立[3-4]。通过宏基因组学测序发现,犊牛瘤胃内存在乳酸杆菌和蛋白水解菌,随食物改变,瘤胃内微生物种类与数量逐渐接近成年[5]。奶牛养殖实践中,犊牛哺乳常用两种模式,一种是自由饮奶,另一种是限制饲喂,不同采食模式影响犊牛瘤胃发育、开食料采食量及断奶后对饲草料的消化吸收能力[6-7]。研究表明自由采食增加犊牛采食量和增重,但对断奶后固体饲料采食量无影响;限量饲喂犊牛后期生长优势更明显[8],生产实践中对自由采食与限量饲喂方案存有疑虑。
本试验研究犊牛哺乳期不同酸化奶饲喂量对其生长发育和断奶后期6 月龄犊牛瘤胃微生物区系建立的影响,旨在为犊牛健康养殖提供科学依据。
1 材料与方法
1.1 试验动物及分组设计
试验于2019 年9 月10 日~2020 年3 月19 日在宁夏回族自治区金宇浩兴第一牧场展开,采用单因子随机试验设计方法,选用12 只出生日期接近健康荷斯坦母犊牛(体重40±3 kg),随机分为2组,每组6头,在哺乳期采用两种不同喂奶量,即L1组:自由采食酸化奶(约12 L·d-1·头-1);L2组:限量饲喂酸化奶(6 L·d-1·头-1)。试验期共6 个月,其中哺乳期60 d(两组犊牛均在60 日龄后断奶),断奶犊牛采食相同饲料至断奶期结束(60日龄~6月龄),每月测量体尺,6月龄末采集瘤胃液。
1.2 试验日粮
奶源由金宇浩兴第一牧场自产。两组犊牛所喂初乳均为巴氏杀菌冷冻乳,常乳为平均乳脂率3.2%~3.5%,平均乳蛋白含量3.0%~3.9%的酸化奶。犊牛开食料由内蒙古博瑞饲料有限公司提供,组成及营养水平见表1。
1.3 饲养管理
犊牛出生后2 h内饲喂优质冷冻巴杀初乳4 L·头-1,6 h 后饲喂同样质量初乳2 L·头-1。2 日龄开始,每个处理的6头犊牛群养于同一畜栏。1~3 日龄通过奶瓶人工饲喂, 4~60日龄L1组使用具有人工乳头的奶桶饲喂,自行吮吸采食,L2 组则奶瓶限量饲喂,50 日龄后,两组犊牛均逐渐减少喂量。具体饲喂量见表2。
1.4 样品采集与处理
1.4.1 生长性能测定
犊牛出生后立即测定体重,试验期间于每月20日测定两组犊牛体重和体高,于测定日晨饲前完成,准确记录,计算日增重。
1.4.2 采食量测定
0~60 d 试验期间,颗粒料称重,每日投放定量开食料和牧草,次日称取剩料量,计算犊牛每日每头开食料采食量,并作记录。

表1 犊牛开食料组成及营养水平(干物质基础)Table 1 Starter composition and nutrient level of calf (DM basis, %)
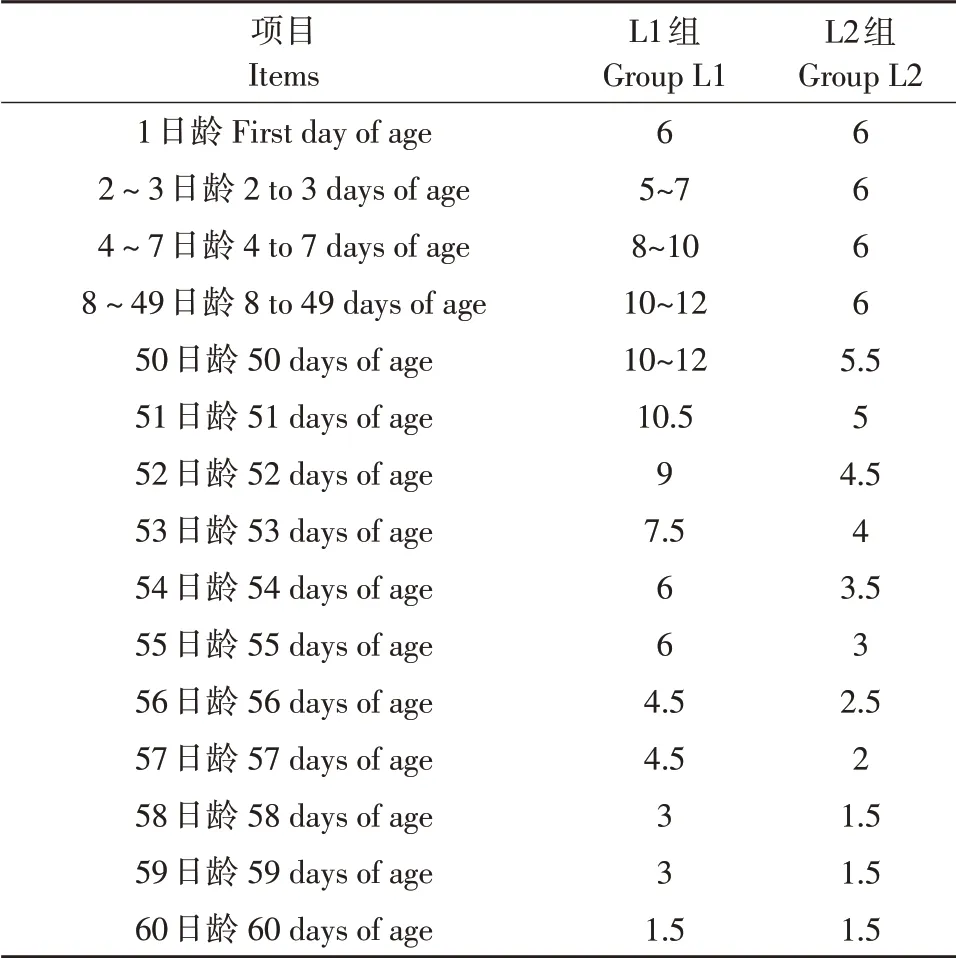
表2 不同日龄犊牛牛奶饲喂量Table 2 Feeding amount of milk to calves in different age(L)
1.4.3 瘤胃液采集与测定
6月龄12头试验牛于晨饲前采样。利用口腔胃管采集瘤胃液,将牛头压低,牛鼻夹固定牛头,用犊牛专用胃管,将一端通过口腔逐步送入瘤胃,另一端用针管缓慢抽取瘤胃液并用4层纱布过滤。所得瘤胃液立即测定pH,取20 mL分装于2个10 mL 离心管-20 ℃保存,用于检测VFA 浓度。另取瘤胃液10 mL,分装于2个5 mL冻存管中,立即投入液氮速冻,干冰运输至天津诺禾致源生物检测公司作16S rDNA 测序分析。瘤胃液pH 用pH 计测定,乙酸、丙酸、丁酸、异丁酸、戊酸、异戊酸和总挥发性脂肪酸用气相色谱法测定。
1.5 瘤胃液菌群多样性测定与分析
瘤胃液菌群多样性采用16S rDNA 高通量测序技术分析。试验操作流程如下:样品DNA 提取及检测;设计合成引物接头(目的片段为V3 +V4区,长度:468 bp,引物为341F-806R,341 正向引物F: CCTAYGGGRBGCASCAG; 806 反向引物R:GGACTACNNGGGTATCTAAT);PCR 扩增与产物纯化;PCR 产物定量与均一化;文库制备及库检;Illumina NovaSeq上机测序。
1.6 数据统计分析
试验数据通过Excel 2010 初步整理, 采用SPSS 22.0 软件分析显著性,数据结果以“平均值±标准差”表示,P<0.05表示差异显著。
2 结果与分析
2.1 酸化奶饲喂量对犊牛体尺及日增重的影响
由表3 可知,L2 组与L1 组犊牛各月龄体重差异均显著(P<0.05);3、5、6月龄L1组犊牛体高显著高于L2组(P<0.05),1、2、4月龄,体高差异不显著(P>0.05);日增重方面, 2、3、4、5 月龄时两组试验牛差异均显著(P<0.05),1、6 月龄时两组试验牛差异不显著(P>0.05)。
2.2 酸化奶饲喂量对犊牛开食料采食量的影响
由表4可知,0~20和41~60日龄因酸化奶饲喂水平不同造成限饲组犊牛开食料采食量极显著高于自由采食组犊牛(P<0. 01),21~40日龄开食料采食量不显著(P>0.05),但限饲组仍高于自由采食组。
2.3 酸化奶饲喂量对断奶后期犊牛瘤胃发酵参数的影响
犊牛瘤胃发酵参数结果见表5。
由表5 可知,哺乳期采食不同量酸化奶对pH、乙酸、丙酸、丁酸、异丁酸、异戊酸及总挥发性脂肪酸浓度影响均不显著(P>0.05)。

表3 不同酸化乳饲喂量对犊牛体高、体重及日增重的影响Table 3 Effect of different milk feeding amount on the height, weight and daily weight gain of calves

表4 酸化奶饲喂量对犊牛开食料采食量的影响Table 4 Effect of acidified milk feed quantity on feed intake of calves

表5 不同酸化奶饲喂量对断奶后期犊牛瘤胃发酵参数的影响Table 5 Effects of different milk feeding amounts on rumen fermentation parameters of calves
2.4 限饲与自由采食酸化奶对犊牛瘤胃微生物多样性的影响
2.4.1 16S rDNA 基因V3+V4 区域扩增结果与数据预处理统计及质控
2.4.1.1 扩增结果
检测12个瘤胃液样品总DNA 质量,浓度及纯度均符合测序平台要求,作16S rDNA 基因V3+V4区扩增,扩增条带如图1所示,目的条带明亮单一且浓度合适,达到建库要求,适合后续分析。
2.4.1.2 数据预处理统计及质控
对Illumina NovaSeq 测序得到下机数据(Raw PE)拼接和质控,得到Clean Tags,再嵌合体过滤,获得可用于后续分析有效数据(Effective Tags)。数据处理过程中数据量与质量统计结果见表6,Q20%与Q30%平均值分别为98%与93%,质量良好。
2.4.2 操作分类单位(OTU)数量
两种不同饲喂方式所得OUT Venn 图(见图2)显示,两组样本共有OTU 数为2 152个,自由采食(L1)组特有OTU 数为330 个,限饲(L2)组特有OTU 数为283个。自由采食使犊牛瘤胃液菌群多样性升高。

表6 数据预处理统计及质控Table 6 Data preprocessing statistics and quality control
2.4.3 测序深度分析
从测序样本中随机抽取一部分数据,统计OTUs 数目,以抽取的测序数据量与对应OTUs 数构建稀释曲线。
由图3~4可知,单样本和组别稀释曲线均逐渐趋于平坦,说明测序数据量渐进合理。
2.4.4 OTU Alpha多样性分析
对L1组与L2组作Alpha多样性指数分析,包括shannon、Simpson、Chao1、ACE、goods_coverage、PD_whole_tree 指数等,由表7 可知,Shannon 指数自由采食组大于限饲组,而Simpson指数自由采食组小于限饲组,说明自由采食提高犊牛瘤胃微生物多样性指数;自由采食组Chao1指数、ACE指数和PD_whole_tree 均高于限饲组,说明自由采食提高瘤胃细菌丰富度指数; 两组覆盖率均大于99%,说明所取样品足以反映瘤胃菌群情况。
2.4.5 多样本比较分析(Beta Diversity)
利用Beta diversity 对不同样本微生物群落构成作比较分析。样本群落结构相似度高则倾向聚集,样本群落差异大则离散。本研究基于非加权距离主成分分析(PCoA)得到图5,由5图可知,主成分2(PC2)贡献率为8.08%,主成分1(PC1)贡献率为21.97%,L1组聚类最好,L2组相对分散,说明组间群落结构差异较大。

表7 样品多样性指数Table 7 Diversity indices of samples
2.5 瘤胃菌群结构分析
2.5.1 门水平
根据注释结果,选取每个样本在各注释层级上最大丰度排名前10 功能信息,分别生成如图6所示12个样本及图7所示2组在门水平上物种相对丰度柱状堆积图,表7 表示排名前10 的门水平菌落,丰度最高细菌为拟杆菌门(Bacteroidetes),其次厚壁菌门(Firmicutes),占总菌群比例90%以上。 与L1 组相比, L2 组增加厚壁菌门(Firmicutes)、未注释球菌门(unidentified_Bacteria)、梭杆菌门(Fusobacteria)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、广古菌门(Euryarchaeota)、疣微菌门(Verrucomicrobia)相对丰度;减少拟杆菌门(Bacteroidetes)、软壁菌门(Tenericutes)、螺旋体门(Spirochaetes)相对丰度,但均不显著(P>0.05)。

表8 酸化奶饲喂量对6月龄犊牛瘤胃液菌群门水平相对丰度的影响Table 8 Effect of acidified milk feeding on relative abundance of gastric flora at gate level
2.5.2 属水平
取每个样本在属水平上排名前10 菌属,分别生成如图8及图9所示柱状图,并将前10属水平菌落如表9表示,可得出两组优势菌属中未注释普雷沃氏菌属(unidentified Prevotellaceae)相对丰度最高,其次是未注释瘤胃球菌属(unidentified Ruminococcaceae)和未注释毛螺菌属(unidentified Lachnospiraceae),且无显著差异(P>0.05)。与L1组相比,L2 组增加未注释瘤胃球菌属(unidentified Ruminococcaceae)、未注释毛螺菌属(unidentified Lachnospiraceae)、 Acetitomaculum、 Sharpea、 Shuttleworthia、拟杆菌属(Alistipes)相对丰度,降低未注释普雷沃氏菌属(unidentified Prevotellaceae)、Saccharofermentans、琥珀酸菌属(Succiniclasticum)相对丰度,其中显著降低未注释韦荣氏菌属相对丰度(P<0.05)。
2.5 样品组间差异LEfSe 分析
利用LEfSe 分析工具分析两组数据如图10 所示,可知L2组梭菌目(Clostridiales)、梭菌纲(Clostridia)、厚壁菌门(Firmicutes)、疣微菌科(Ruminococcaceae)、未注释疣微菌科(unidentified Ruminococcaceae)相对丰度较L1组显著增加(P<0.05);栖瘤胃普雷沃菌(Prevotella ruminicola)、未注释普雷沃氏菌科(unidentified Prevotellaceae)、拟杆菌目(Bacteroidales )、拟杆菌纲(Bacteroidia)、拟杆菌门(Bacteroidetes)、普雷沃氏菌科(Prevotellaceae)相对丰度较L1组显著减少(P<0.05)。
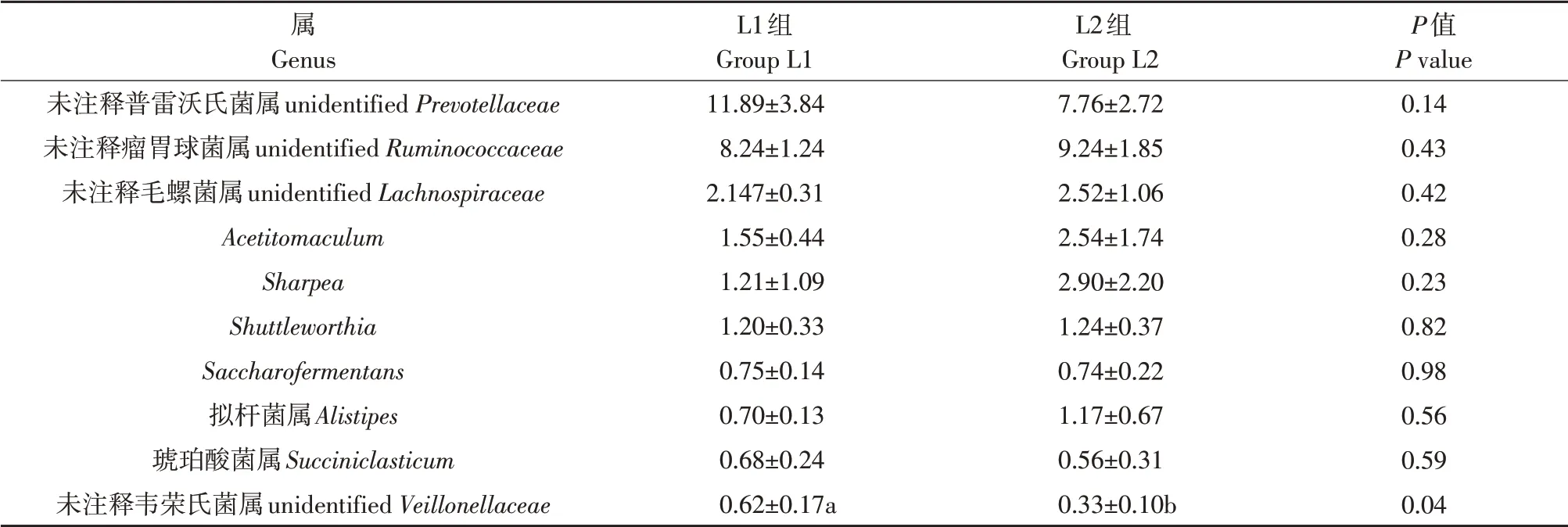
表9 酸化奶饲喂量对断奶犊牛瘤胃菌群在属水平相对丰度的影响Table 9 Effect of acidified milk feeding on relative abundance of gastric flora in genus levels
3 讨 论
3.1 酸化奶饲喂量对断奶犊牛后期体重、体高、日增重的影响
犊牛生长发育情况影响育成牛生长发育、配种产犊及成年牛各项生产性能,因此犊牛培育阶段至关重要。日粮是影响犊牛生长发育主要因素之一,且瘤胃内微生物随日粮而变化[9-10]。本试验中,两组犊牛初生重无显著差异(P>0.05),试验期L1 组犊牛体重显著高于L2 组(P<0.05),这与Schaff报道自由采食可增加犊牛采食量和增重结论一致[11],犊牛出生不久,各项消化机能不完善,不喜食开食料或固体饲料,酸化奶摄入量提高[12]。但吴志强将高牛奶量定为6 L,低牛奶量定为3 L,得出高牛奶饲喂量显著增加2~4、4~6 周龄体重和日增重,而6~8周龄体重、体高、日增重均无显著影响[13],与本研究饲喂配方不同。本试验自由采食组断奶后犊牛体重、体高、日增重高于限制饲喂组,一方面由于犊牛个体发育程度不同,另一方面自由采食组犊牛在哺乳阶段体重较高,断奶后期对饲料需求量更大,这与鲍宇红报道限量饲喂组犊牛后期生长优势更明显结论不一致[14],原因可能是本试验考虑犊牛断奶时日粮突然改变可能引发断奶应激[15],在断奶前调整两组犊牛牛奶摄入量,逐渐减少牛奶摄入量,增加开食料摄取,降低断奶应激。因此,从增重和应激两个方面考虑,哺乳期犊牛一段时间内自由采食效果更好。
3.2 酸化奶饲喂量对犊牛开食料采食量的影响
犊牛从10 日龄开始采食固体饲料,当牛奶饲喂量减少或断奶时,犊牛对固体饲料采食量迅速增加[1]。本试验中酸化奶饲喂量影响犊牛开食料采食量,犊牛在生长发育过程中,当牛奶饲喂量减少时,必须采食更多固体饲料补充能量,所以限量饲喂增加开食料采食量,这与前人研究结果一致[16]。
3.3 酸化奶饲喂量对犊牛瘤胃发酵参数的影响
瘤胃发酵参数中挥发性脂肪酸(VFA),是微生物分解营养物质产生的,且是反刍动物主要能量来源,挥发性脂肪酸主要是由乙酸、丙酸、异丁酸、丁酸,异戊酸、戊酸等组成[17]。研究表明,牛奶不同饲喂量影响后期固体饲料摄入,从而影响瘤胃发酵与微生物区系,但本试验中牛奶饲喂量高低对乙酸、丙酸、异丁酸、丁酸、异戊酸、戊酸以及总VFA无显著影响,这一结果与张千结论一致[18]。自由采食组降低瘤胃pH,但不显著(P>0.05),这与吴志强结论一致[13],瘤胃pH 又受各种VFA 比例影响,其中影响pH最大的是丙酸,瘤胃pH与丙酸浓度可能呈负相关,与乙酸浓度呈正相关,瘤胃pH 和乙酸浓度随纤维含量增加而增加,与本试验结果一致,但与丙酸浓度随纤维含量增加而降低,与本试验结果不一致,可能与日龄因素有关,断奶到六月龄犊牛饲喂模式一致,前期营养干扰在后期同模式饲养下发生改变的原因有待研究。
3.4 酸化奶饲喂量对犊牛瘤胃微生物多样性的影响
本研究探讨限量饲喂和自由采食酸化奶对荷斯坦断奶犊牛后期瘤胃菌群多样性的影响,通过Venn 图和稀释曲线发现,L2组特有OTU数少于L1组,且测序深度合理;通过PCoA 发现L1 组聚类好,L2 组相对分散,组间群落结构差异较大。说明一定时间内自由采食更有利于微生物繁殖,前期饲喂量不足影响瘤胃菌群发展。
在门水平上,大量研究表明拟杆菌门和厚壁菌门是哺乳动物胃肠道优势菌群[19-20],与本试验结论相同,但菌群变化趋势不同,L2 组与L1 组相比,L2 组在厚壁菌门、未注释球菌门、梭杆菌门、变形菌门等呈上升趋势,但拟杆菌门、软壁菌门、螺旋体门等呈下降趋势,且限量饲喂犊牛厚壁菌门相对丰度较自由采食犊牛更高,主要原因是厚壁菌门具有分解纤维的能力,限饲造成犊牛饥饿,犊牛采食开食料,对纤维消化能力更强。两组犊牛除哺乳期哺乳量不同外其他饲养条件均相同,仅牛奶饲喂量不同。
在属水平上,两处理组优势菌属为普雷沃氏菌属、瘤胃球菌属和毛螺菌属,且无显著差异。L2 组普雷沃氏菌属低于L1 组,但差异不显著(P>0.05)。普雷沃氏菌属属于拟杆菌门,这类菌属具有一定蛋白酶活性,是瘤胃主要蛋白降解菌之一[21]。Rey 和郭凯研究发现普雷沃氏菌属在瘤胃中含量与比例不受饲粮结构影响,且一直处于优势地位,与本试验结果一致[22,5]。研究还发现,限饲提高犊牛瘤胃与半纤维素分解有关的毛螺菌属相对丰度,显著降低以利用乳酸为主的未注释韦荣氏菌属相对丰度(P<0.05),可能与开食料采食量有关,但具体机理还需进一步探究。
通过LEfSe分析,限量饲喂组高于自由采食组菌类有梭菌目、梭菌纲、厚壁菌门、疣微菌科、未注释疣微菌科;限饲组低于自由采食组菌类有栖瘤胃普雷沃菌、未注释普雷沃氏菌科、拟杆菌目、拟杆菌纲、拟杆菌门、普雷沃氏菌科。梭菌与哺乳动物腹泻存在相关[24],本试验中限量饲喂犊牛瘤胃微生物中梭菌相对丰度显著高于自由采食(P<0.05),可能是由于犊牛瘤胃发育吸收与利用有关[25],可能是L1组犊牛体重显著高于L2组原因之一。
4 结 论
自由采食酸化奶显著提高哺乳期犊牛日增重及断奶犊牛日增重。门水平上拟杆菌门与厚壁菌门以及属水平上普雷沃氏菌属、瘤胃球菌属和毛螺菌属均为优势菌群。与限量饲喂犊牛相比,自由采食酸化奶提高未注释韦荣氏菌属、栖瘤胃普雷沃菌、未注释普雷沃氏菌科、拟杆菌目、拟杆菌纲、普雷沃氏菌科相对丰度。

