新型纳米粒联合低强度聚焦超声对乳腺癌细胞的抑制作用
张茜,王佳星,丁彦军,冉海涛,米成嵘
1.宁夏医科大学临床医学院,宁夏银川 750004;2.重庆医科大学超声影像学研究所,重庆医科大学第二附属医院超声科,重庆 400010;3.宁夏医科大学总医院超声科,宁夏银川 750004;
乳腺癌是严重威胁女性健康的疾病[1],目前常规治疗包括手术切除、放化疗、内分泌治疗及靶向治疗等,对于新兴治疗方法的研发仍具有重要意义。纳米医学和精准治疗的发展为攻克乳腺癌的治疗难题开辟了新的道路,其利用纳米材料所具备的独特性能,实现针对肿瘤区域的实时动态成像及药物递送等策略。基于超声特性发展而来的声动力治疗(sonodynamic therapy,SDT)具有无创、无辐射、简单便捷等优点,通过产生活性氧(reactive oxygen species,ROS)进而杀伤肿瘤细胞,并具备超声独特的空化作用,具有广阔的治疗前景。本研究利用新构建的高分子复合纳米粒 Ce6@PFP/PLGA,通过低强度聚焦超声(low intensity focused ultrasound,LIFU)介导的SDT,观察其对4T1 乳腺癌细胞生长与转移的抑制作用,探讨其作为精准治疗乳腺癌并抑制转移方法的可行性。
1 材料与方法
1.1 试剂及仪器 PLGA-COOH(分子量12 000 D,济南岱罡),全氟戊烷(perfluoropentane,PFP)、琼脂糖凝胶粉(Sigma),二氢卟吩(Chlorin e6,大连美仑),二氯甲烷、甲醇、异丙醇均为市售分析纯产品,聚乙烯醇(PVA,上海Aladdin),CCK-8 试剂盒(日本同仁),2,7-二氯二氢荧光素二乙酸(2',7'-Dichlorodihydrofluorescein diacetate,DCFH-DA)细胞活性氧探针(美国MCE),钙黄绿素活细胞染料(Calcein-AM,美国MCE),碘化丙锭溶液(PI,北京索莱宝),4T1 细胞株(中科院上海细胞库),650Y 超声声振仪(上海ZOLLO),激光粒径仪(Zetasizer Nano ZS-90,Malvern),飞利浦EPIQ5 超声诊断仪,低强度聚焦超声治疗仪(重庆海扶技术有限公司),激光共聚焦显微镜(Olympus),Synergy 多功能酶标仪(BioTek),低温离心仪(Eppendorf),UH 5300 紫外分光光度计(HITACHI)。
1.2 Ce6@PFP/PLGA 纳米粒的制备 称取Ce6 2 mg、PLGA-COOH 50 mg。甲醇(500 μl)溶解Ce6 后,与PLGA-COOH 共同溶于4 ml 二氯甲烷中,并加入400 μl PFP,于冰浴条件下进行声振3 min(占空比5 s∶5 s)即获得初乳。加入4% PVA 溶液8 ml 继续声振3 min,获得复乳。复乳中滴加10 ml 2%异丙醇,室温搅拌4 h 后低温离心仪(12 000 r/min,5 min)离心洗涤3 次,即得到CPP 纳米粒,于4℃存储备用。
1.3 Ce6@PFP/PLGA 纳米粒的基本特征检测 使用Malvern 激光粒径仪测量CPP 纳米粒的粒径,观察其普通光学形态及透射电镜下形态;采用紫外分光光度计分别测量 Ce6 、 PFP/PLGA 及不同浓度Ce6@PFP/PLGA 的紫外吸收峰;称取一定质量的Ce6用甲醇稀释,测量其吸光度,并制作标准曲线,计算Ce6 的包封率。
1.4 Ce6@PFP/PLGA 纳米粒体外相变及超声造影能力检测 将先前制备的Ce6@PFP/PLGA 纳米粒稀释至1 mg/ml。使用LIFU 仪在不同功率条件下(2~5 W)进行辐照60 s 后光镜下观察其相变情况;称取15 g琼脂糖粉及400 ml 双蒸水置于微波炉中加热至溶解,并搅拌直至无气泡产生。将液体倒入2 ml 离心管盒中并放入2 ml 离心管,凝固后即可得到琼脂糖凝胶模型。模型孔中加入1 mg/ml CPP 纳米粒,LIFU 作用后使用EPIQ 5 超声诊断仪(探头频率12 MHz,MI:0.06)分别观察常规超声及超声造影(CEUS)模式下不同显影结果。
1.5 Ce6@PFP/PLGA 纳米粒细胞内活性氧产生能力利用DCFH-DA 活性氧探针检测细胞内ROS 生成。DCFH-DA 与ROS 作用后可转变为二氯二氢荧光素(dichlorofluorescin,DCF)产生荧光,用于评估CPP纳米粒在LIFU 作用下ROS 的生成能力。将常规培养的4T1 乳腺癌细胞分为对照组、LIFU 组、CPP 纳米粒组、Ce6+LIFU 组和CPP 纳米粒+LIFU 组,置于共聚焦培养皿中培养24 h。随后根据不同组别加入CPP纳米粒或进行LIFU 处理。加入100 μl 稀释的DCFHDA 溶液避光孵育15 min 后,置于共聚焦显微镜下观察细胞内ROS 产生情况。
1.6 Ce6@PFP/PLGA 纳米粒体外安全性检测 将4T1 细胞以1×104个/孔接种于96 孔板,常规培养24 h。使用不含血清的1640 培养基稀释纳米粒,设置不同浓度组(0~0.6 mg/ml,n=5),并分别与细胞共孵育6~24 h后,CCK-8 法检测细胞存活率。
1.7 LIFU 联合Ce6@PFP/PLGA 纳米粒增效声动力治疗及抑制乳腺癌细胞转移的体外实验
1.7.1 声动力治疗 将4T1 细胞进行体外培养,取对数生长期细胞,以1×105个/ml 种于共聚焦皿中培养24 h 并分为4 组:对照组,细胞不进行任何处理;LIFU 组,细胞仅进行LIFU 辐照(4 W,60 s);CPP纳米粒组,细胞中仅加入CPP 纳米粒;CPP 纳米粒+LIFU 组,细胞中加入CPP 纳米粒后,使用LIFU 进行辐照(4 W,60 s)。每皿加入100 μl 稀释的Calcein-AM/PI 溶液,避光共孵育20 min 后,在共聚焦显微镜下观察细胞染色情况。
1.7.2 抑制乳腺癌细胞转移 4T1 细胞按上述分组种于6 孔板中。常规贴壁后,超净台中使用10 μl 枪头用直尺沿6 孔板中央划出均匀划痕,并按照组别进行纳米粒共孵育或超声处理后继续培养24 h,在光学显微镜下观察细胞迁移情况。
1.8 统计学方法 采用SPSS 22.0 软件,符合正态分布的计量资料以表示。多组间迁移面积比较采用单因素方差分析,两两比较采用LSD 法。P<0.05 表示差异有统计学意义。
2 结果
2.1 Ce6@PFP/PLGA 纳米粒的基本特征 制备的CPP 纳米粒水溶液为浅灰色,光镜下大小均匀,分散性良好(图1A),透射电镜下显示纳米粒呈球形(图1B)。Malvern 粒径仪测得CPP 纳米粒粒径为(230.0±50.5)nm,分散度0.048(图1C)。Ce6、PFP/PLGA及Ce6@PFP/PLGA紫外吸收光谱提示Ce6成功包裹在CPP 纳米粒中,Ce6 的紫外光谱显示,在403 nm 处出现最大吸收峰,随着CPP 纳米粒浓度增加,其吸收峰也逐渐增加(图1D),依据Ce6 标准曲线(图1E)可测得CPP 包封率为(91.11±2.25)%。

图1 光学显微镜(A)及透射电镜(B)显示Ce6@PFP/PLGA 纳米粒呈稳定球形;Ce6@PFP/PLGA 纳米粒较为均一的粒径分布(C);不同浓度Ce6@PFP/PLGA 纳米粒及PFP/PLGA、Ce6 紫外吸收光谱提示Ce6 有效包裹(D);依据不同浓度下吸光度计算出的Ce6 标准曲线(E)
2.2 Ce6@PFP/PLGA 纳米粒体外相变能力及超声造影能力 CPP 纳米粒经过不同超声功率辐照后光镜下观察到不同相变效果。结果显示,4 W 辐照60 s 后纳米粒相变较其他功率明显(图2A~D);琼脂糖凝胶模型2D 模式及造影模式均显示4 W 时显影效果最佳(图2E~H)。由此可见,CPP 纳米粒成功包裹相变材料PFP,且在4 W LIFU 辐照下具备最佳超声显影功能。
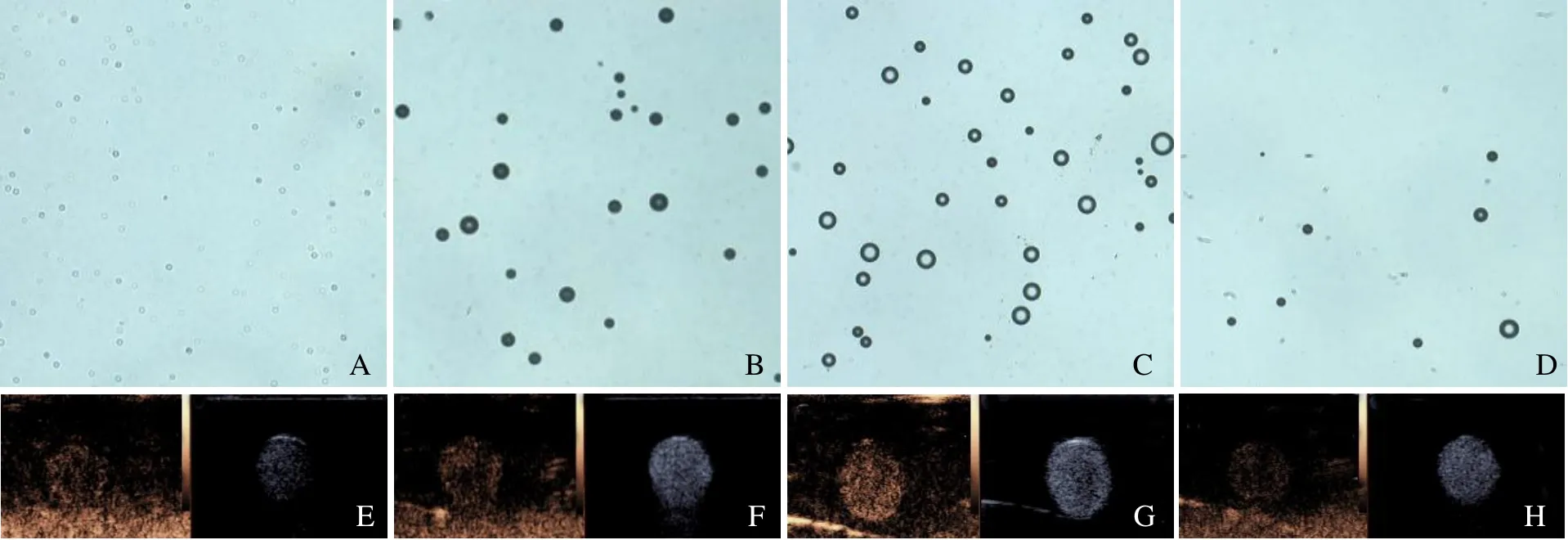
图2 CPP 纳米粒不同功率LIFU 辐照后相变能力。2 W 时纳米粒轻微增大(A);3 W 时开始出现气泡(B);4 W 时气泡明显增多增大(C);5 W 时气泡逐渐减少消失,标尺=50 μm(D);2D 及CEUS 模式下显影情况(2~5 W)与相变结果一致(E~H)
2.3 Ce6@PFP/PLGA 纳米粒细胞内ROS 产生能力共聚焦显微镜显示CPP 纳米粒+LIFU 组绿色荧光显示最明显,其余各组均无或仅有少量绿色荧光(图3),表明在LIFU 作用下,CPP 纳米粒具备良好的ROS 生成能力。
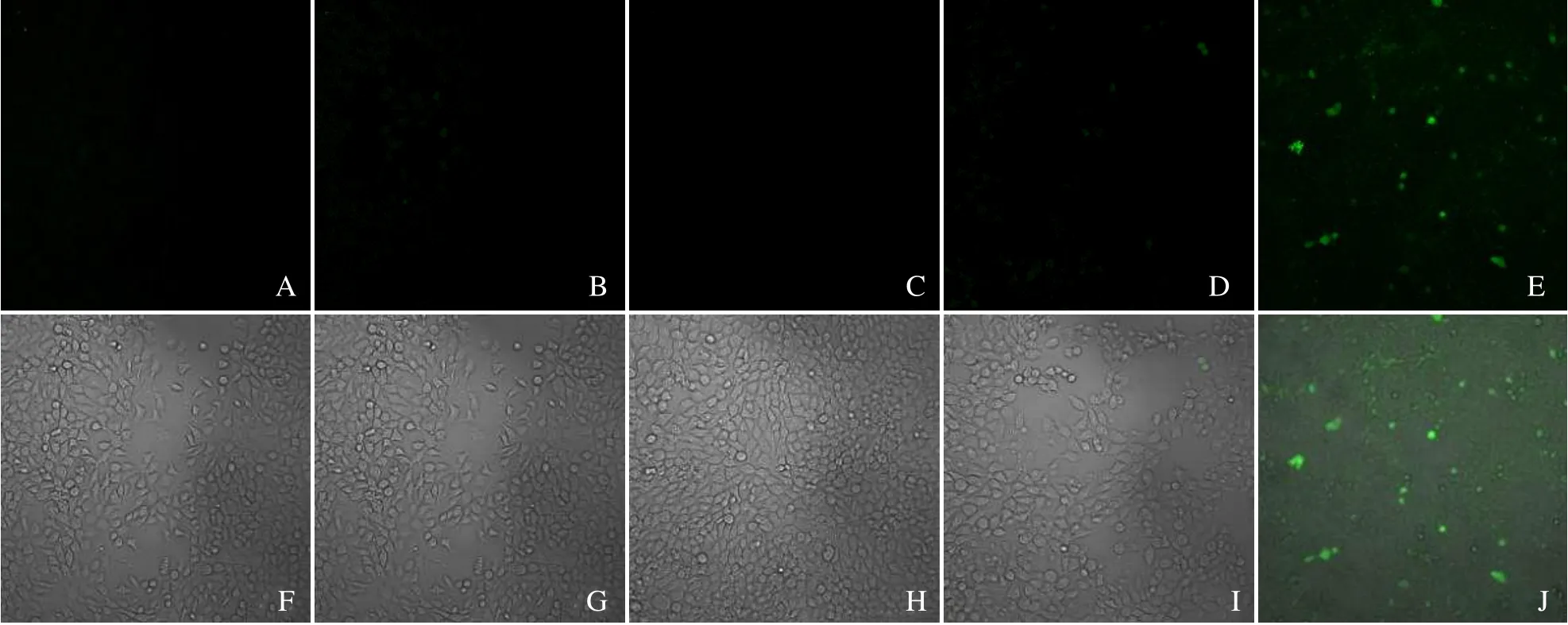
图3 激光共聚焦显微镜下不同分组与4T1 细胞共同作用后ROS 产生情况。A~E 分别为对照组、LIFU 组、CPP 纳米粒组、Ce6+LIFU 组、CPP 纳米粒+LIFU 组;F~J 为以上各组共聚焦显微镜与光镜融合结果;标尺=50 μm
2.4 Ce6@PFP/PLGA 纳米粒细胞活性检测 使用CCK-8 法测定不同时间及不同浓度下与CPP 纳米粒共孵育后4T1 细胞活性,显示随着纳米粒浓度增高及共孵育时间延长,细胞活性仍然可以维持在85%以上(图4),进一步证明CPP 纳米粒的生物安全性。
2.5 LIFU 联合Ce6@PFP/PLGA 纳米粒增效SDT 及抑制乳腺癌转移的体外实验
2.5.1 SDT 激光共聚焦显微镜显示CPP 纳米粒在联合LIFU(4 W)作用60 s 后,死亡细胞数量最多(图5A);其余各组均无明显数量的细胞死亡(图5B~D)。由此可见,经LIFU 辐照后的CPP 纳米粒具备良好的声动力治疗效果。
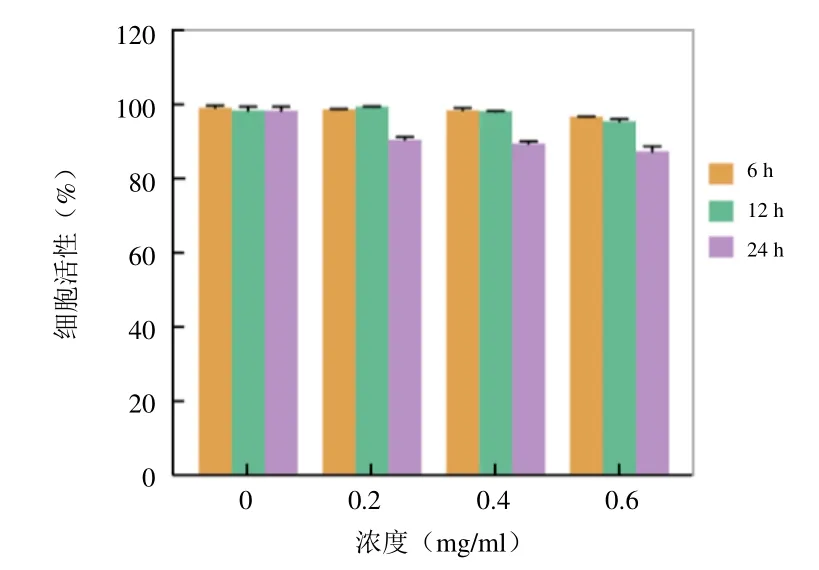
图4 CPP 纳米粒不同时间及不同浓度下细胞存活率
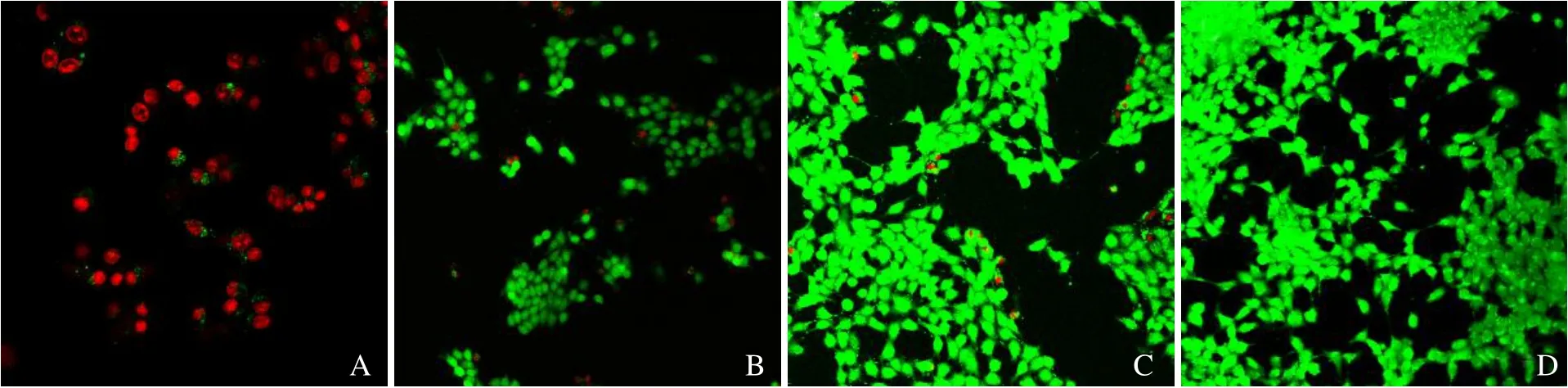
图5 LIFU 联合Ce6@PFP/PLGA 纳米粒SDT 激光共聚焦显微镜结果。A~D 分别为CPP 纳米粒+LIFU 组、LIFU 组、CPP 纳米粒组、对照组;标尺=50 μm
2.5.2 抑制乳腺癌细胞转移 细胞划痕实验结果表明,CPP 纳米粒+LIFU 组24 h 细胞迁移最少,迁移面积最大,与其他3 组相比差异均有统计学意义(F=131.0,P<0.05,图6),表明LIFU 联合CPP纳米粒的SDT 具备抑制4T1 乳腺癌细胞转移的能力。
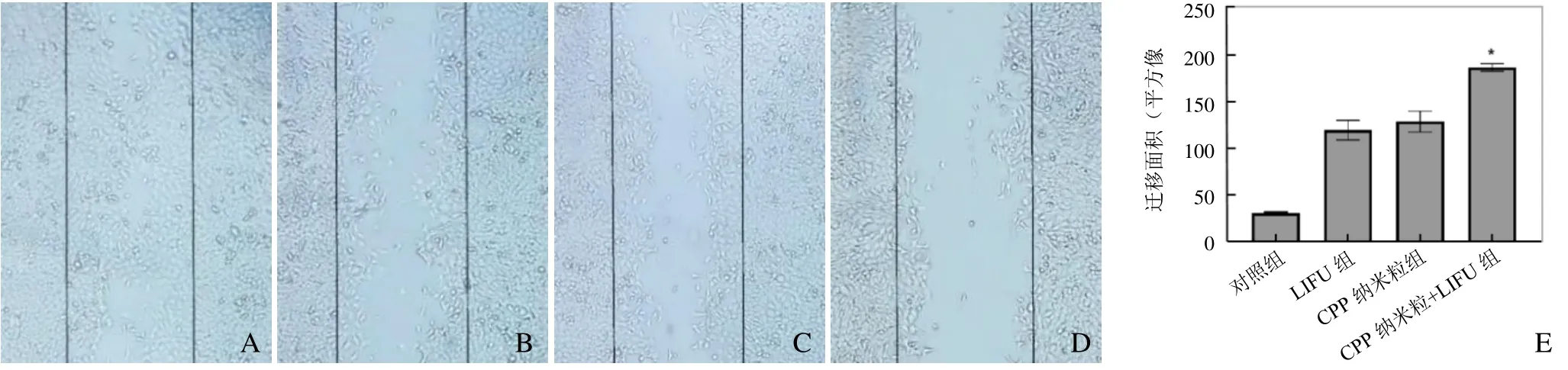
图6 细胞划痕实验结果。A~D 分别为对照组、LIFU 组、CPP 纳米粒组、CPP 纳米粒+LIFU 组光学显微镜下24 h 后细胞迁移情况;E 为CPP 纳米粒+LIFU 组与其他3 组比较,*P<0.05
3 讨论
近年来,SDT 在癌症治疗领域引起广泛关注,其利用超声激活声敏剂产生ROS,通过破坏肿瘤细胞DNA 并引发线粒体相关的肿瘤细胞凋亡,具有独特的深层穿透性和无辐射损伤等优势[2];同时在多种成像引导下,SDT 还可以实现靶向肿瘤区域的精准治疗,有助于推动肿瘤诊疗一体化的发展[3]。既往超声造影多通过微泡实现,然而微泡由于自身微米级大小,难以借助肿瘤的高通透性和滞留效应在病变区域实现有效聚集。此外,微泡稳定性欠佳造成修饰及载药困难,限制了其在肿瘤靶向治疗中的应用。新型纳米材料的发展实现了靶向肿瘤、完成肿瘤动态实时成像的同时具备特定治疗效果的纳米级制剂,对多种癌症的诊断与治疗具有重要意义[4]。
本研究利用PLGA 为外部材料,共同包载PFP 和Ce6,制备出具备超声显影和SDT 的多功能纳米粒。PFP 是一种特殊的相变材料,在外界压力增加或温度升高时可由本身的液体状态变为气体状态,并在不同纳米载体中均能稳定地实现相变能力[5]。本实验中,随着LIFU 功率升高,CPP 纳米粒的显影能力逐步显现,4 W 时最佳,与光镜下相变结果相符,表明LIFU作用下的PFP 液气相变增强了纳米粒的超声造影能力[6]。此外,不同浓度CPP 纳米粒与4T1 细胞共孵育不同时长均未见明显毒性反应及细胞凋亡,表明纳米粒具有良好的生物安全性。二氢卟吩类声敏剂Ce6 由天然叶绿素提炼而来,具有相对良好的稳定性,体内清除速度快。然而,Ce6 的水溶性较差,单独使用时无法保证其在肿瘤区域的聚集,由此导致声动力效应大大降低[7]。本研究中,CPP 纳米粒经过同等条件LIFU 触发后,产生的ROS 水平及SDT 效果远大于其他组,展现出有效杀伤肿瘤细胞的能力,证实CPP纳米粒能够通过肿瘤的高通透性和滞留效应实现Ce6效应最大化,与既往研究结果一致[8-9]。
肿瘤组织增殖异常及其远处转移是恶性肿瘤的基本特性。癌细胞迁移能力通常作为评估其转移能力的指标。抑制乳腺癌转移能力是其治疗的难点。本研究中细胞迁移实验结果表明,CPP 纳米粒与LIFU 的共同作用能够从体外水平抑制乳腺癌细胞的转移,其原因可能为:①SDT 杀伤肿瘤细胞的同时,抑制了细胞本身的增殖能力,进而导致其相应的转移能力有所下降;②超声特有的空化效应特定开放细胞膜,增效ROS 作用效果并定向作用于转移相关细胞因子及通路,从而在一定程度上阻止了肿瘤细胞转移[10]。
总之,本研究成功制备了诊疗一体化的Ce6@PFP/PLGA 纳米粒,并证实在LIFU 辐照下,该纳米粒可同时实现超声造影、抑制乳腺癌细胞生长和转移,为利用多功能纳米平台实现肿瘤诊疗一体化提供了细胞水平依据。但本研究对CPP 纳米粒细胞摄取途径的评价尚不充分,对其抑制肿瘤细胞生长及转移机制未进行更深层的研究;同时,该纳米粒体内超声显影、治疗效果及相关生物安全性尚未得到证实,将在后续实验中进一步完善。

