携ApoPep-1纳米微泡靶向成像评价活体内肿瘤凋亡的实验研究
赵萍,马晓菊,2,杨恒丽,袁丽君,段云友*
1.第四军医大学唐都医院超声诊断科,陕西西安 710038;2.临潼康复疗养中心健康管理部特诊科,陕西临潼 710600;3.西安医学院第二附属医院门诊超声科,陕西西安 710038;
细胞凋亡是肿瘤治疗的主要机制之一[1-3]。监测肿瘤治疗后凋亡应答情况对评估疗效、优化和管理治疗策略具有重要意义[4]。凋亡检测方法很多,而在体内无创及可视化监测肿瘤细胞凋亡鲜有报道[5]。前期,本课题组以凋亡分子探针连接纳米微泡制成靶向超声造影剂用于荷瘤小鼠肿瘤组织凋亡成像的研究[6]取得了重要进展,提示该纳米微泡可在活体肿瘤组织内对发生凋亡的肿瘤组织进行成像,为分子水平上早期、准确评价抗肿瘤疗效以及指导治疗策略提供了重要参考[7]。然而前期研究中,纳米微泡携带的探针Annexin V 分子量偏大,使其粒径稳定性受到一定的限制,体外长时间存储纳米小泡极易融合变大,而体内成像效果也因其半衰期较短无法长时间追踪。凋亡靶向肽-1(apoptosis-targeting peptide-1,ApoPep-1)是一种由噬菌体展示技术鉴定而得,由6 个氨基酸组成的短肽[8],靶向凋亡细胞的性能极强。与Annexin V 不同,ApoPep-1 分子量极小,且以Ca2+非依赖型方式与暴露在细胞表面的组蛋白H1 结合识别凋亡细胞,是凋亡细胞的另一个独特标志物[9-10]。组蛋白H1 暴露于细胞表面发生在凋亡早期(DNA 片段化之前),因此,ApoPep-1 是一种理想的早期细胞凋亡分子成像探针。为进一步提高纳米微泡在体内的存留时间,增强成像效果,本研究拟以分子量更小的ApoPep-1 为分子探针,设计一种新的靶向纳米微泡,通过与前期研究使用的膜联蛋白耦联纳米微泡(annexin V-nanobubbles,AV-NB)进行对比,观察其在荷瘤小鼠肿瘤组织凋亡成像中的优势,为凋亡介导的抗肿瘤疗效评价提供更多的实验依据。
1 材料与方法
1.1 主要试剂与仪器 主要试剂:生物素化聚乙二醇二硬脂酰磷脂酰乙醇胺(Bio-DSPE-PEG 2000)购自Avanti 公司;脂膜红色荧光染料(DiI)、二棕榈酰磷脂酰胆碱(DPPC)均购自Sigma 公司;链霉亲和素购自Invitrogen 公司;生物素化ApoPep-1 由上海科肽生物科技有限公司合成,生物素化Annexin V、0.01 mol/L 磷酸盐缓冲液(PBS)、抗caspase-3 抗体,FITC-二抗、甘油、氯仿、顺铂、医用全氟丙烷(C3F8)气体和超声对比剂声诺维(SonoVue)均为商品化购买。
主要仪器:LCMS-2010EV 液相色谱质谱联用仪(Shimadzu),NanoPlus-3 型纳米粒径/电位分析仪(麦克摩瑞提克);小动物超声成像仪(VisualSonics Vevo 2100,Fujifilm)。
1.2 实验步骤
1.2.1 Bio-ApoPep-1 的合成及特性分析 ApoPep-1采用多肽固相合成法制成,为6 个氨基酸的短肽,序列为CQRPPR。为了与纳米微泡更好地连接,其N 端连接生物素Biotin 分子,得到生物素化ApoPep-1(Bio-ApoPep-1)。采用液相色谱质谱联用仪分析其含量和分子量。
1.2.2 ApoPep-1-NB 的制备 普通纳米微泡(nanobubbles,NB)和AV-NB 的制备参照课题组前期研究[6-7]。ApoPep-1-NB 的制备:将 Bio-ApoPep-1“生物素-亲和素-生物素”法耦联到NB 表面,具体操作:2.5 μl Bio-ApoPep-1(0.5 mg/ml)与7.5 μl 链霉亲和素(0.5 mg/ml)共孵育,于4℃轻微振荡20 min,得到Bio-ApoPep-1-链霉亲和素,加入500 μl 浓度为(8.5±1.2)×108个/ml 的NB 中,室温下孵育30 min。最后,将得到的溶液立即置于冰上,使其静置分层,取上层分层液。微泡使用前以CO60辐照灭菌15 min 后,密封储存。为了后续研究中更好地示踪ApoPep-1-NB,便于荧光显微镜下观察,制备ApoPep-1-NB 时,也可预先加入10 μl 红色脂类染料DiI(10 μmol/L)于Bio-DSPE-PEG 2000 和DPPC中,再加氯仿一起溶解,其余操作步骤同上。
1.2.3 粒径分析 将1 ml 浓度为(4.5±1.2)×108个/ml 的ApoPep-1-NB 溶液存放于4℃冰箱内,分别于0、12、24、36、48、60、72 h 后检测粒径大小,再分别存放于37℃孵箱内,分别于0、20、40、60、80、100、120 min 后检测粒径大小。比较ApoPep-1-NB 与AV-NB 的稳定性。
1.2.4 体外显影效果 为了研究ApoPep-1-NB 在机体组织中的回声特性,本实验设计了一个圆柱形(直径3 cm,高度3 cm,厚度0.5 cm)实验装置。装置材料由琼脂糖凝胶(1%琼脂糖,99%水)制成,用以模拟体内组织材料的回声。将400 μl ApoPep-1-NB 溶液加入该容器内,选用MS 250 线阵超声探头,将探头垂直于容器放置,于低机械指数超声造影成像模式下观察显影效果。将等量的AV-NB 溶液、SonoVue 溶液和生理盐水分别作为对照组。所有图片均在Image J 软件中用光密度法定量分析回声强度。
1.2.5 实验动物模型建立 20 只BALB/c 裸鼠(雌性,6~8 周龄,体重19~20 g)由第四军医大学实验动物中心提供[动物许可证编号:SCXK(陕)2019-001],SPF 级饲养。人乳腺癌细胞系MDA-MB-231(由第四军医大学提供)在37℃、5% CO2饱和湿度下,于含10%胎牛血清的高糖DMEM 完全培养基下培养。接种前,取生长于指数期的MDA-MB-231 细胞(浓度为1.5×107个细胞/ml),然后于皮下接种于裸鼠右前肢腋下后方。肿瘤生长至直径约1 cm 时,开始进行后续造模实验。首先,采用数字表法将荷瘤裸鼠随机分为模型组(治疗组)和非模型组(对照组),每组10 只。治疗组给予一定剂量的顺铂治疗(共治疗3 次,每次间隔1 周),对照组不进行任何治疗,观察肿瘤的自然生长情况。研究人员均严格遵循动物实验的伦理规定。
1.2.6 超声造影实验 治疗组取10 只荷瘤小鼠,异氟烷吸入麻醉后保持仰卧位。采用小动物超声成像仪,MS 250 高频电子线阵探头,频率13~24 MHz,先观察肿瘤于B-Mode 下的二维图像,选取最佳成像切面,存图,并保持该切面不动。然后进行超声造影成像,设置机械指数<0.1,实验组小鼠经尾静脉注射200 μl ApoPep-1-NB 对比剂(浓度2.25×108个/ml)。等量AV-NB 纳泡以同样方式注射,其他条件保持不变。整个造影过程持续5 min。所有图像感兴趣区(ROI)均为肿瘤区域。在Image J 软件中用光密度法定量分析回声强度。对造影图像进行时间-强度曲线(TIC)分析,获得纳米微泡的灌注情况。
1.2.7 免疫荧光分析 将超声造影结束后的小鼠回笼饲养,给予正常饮食,2 h 后进行以下实验。①实验1:选取3 只小鼠,取肿瘤部位做病理切片,以TUNEL 检测试剂盒行免疫荧光染色观察凋亡情况,以对照组小鼠肿瘤切片作为对照。②实验2:选取其中6只小鼠分成两组,一组经尾静脉注射带有荧光DiI的ApoPep-1-NB,另一组注射DiI-AV-NB,5 min 后处死小鼠,取两组肿瘤组织做冰冻切片,并以抗凋亡相关蛋白caspase-3 进行切片染色(1∶100),4℃孵育过夜,以PBS 清洗3 次后再加入FITC 标记的二抗(1∶20 000)孵育30 min,PBS 清洗3 次,以DAPI 染料标记肿瘤组织细胞核,最后于激光共聚焦显微镜下观察。
1.3 统计学方法 采用GraphPad Prism 6.01 软件,正态分布的计量资料以表示,组间比较行独立样本t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 Bio-ApoPep-1 多肽的纯度和分子量 ①色谱条件:Kromasil C18 色谱柱(250 mm×4.6 mm,5 μm),流动相A 为100%乙腈溶液(含0.1%三氟乙酸),流动相B 为100% H2O(含0.1%三氟乙酸),进样量为20 μl,流速为1.0 ml/min,检测波长为220 nm。此条件下,检测合成的Bio-ApoPep-1 的保留时间为14.853 min(图1A),对应时间出现明显的色谱峰,测得峰值面积,并计算峰值面积占比为91.20%(表1),表明合成的Bio-ApoPep-1 纯度符合本实验要求。②质谱条件:电喷雾离子源(ESI),雾化气流速1.5 L/min,喷雾电压4.5 kV。此条件下,检测Bio-ApoPep-1 的离子质荷比,计算得分子量约为982 g/mol(图1B),即982 D,明显小于Annexin V 的35 000 D。

图1 Bio-ApoPep-1(A)色谱图和(B)质谱图
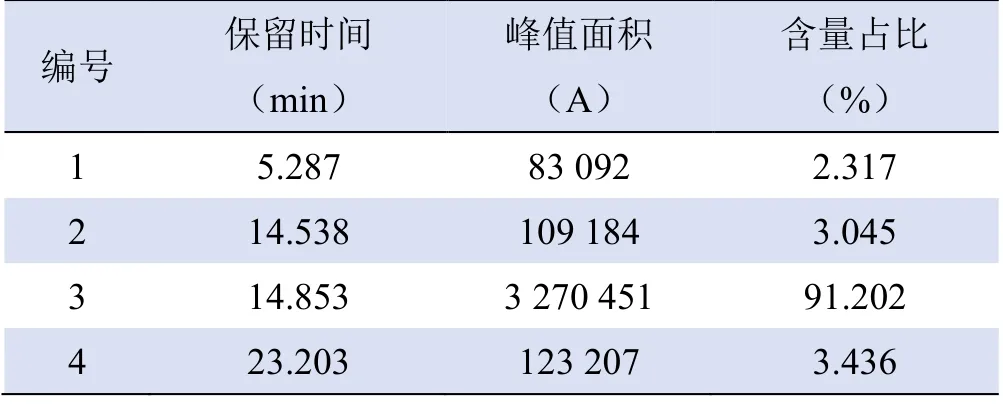
表1 色谱实验数据
2.2 ApoPep-1-NB 粒径分析 测得ApoPep-1-NB 粒径为(588.61±19.89)nm,对照组 AV-NB 粒径为(665.50±25.4)nm(图2A)。将两者于37℃保存120 min,前者粒径几乎无明显变化,其大小始终处于650 nm 以内。AV-NB 粒径增长较快,100 min 时大小超过800 nm。40、60、80、100、120 min 时两种纳米微泡粒径大小比较,差异均有统计学意义(P均<0.05,图2B),表明ApoPep-1-NB 在120 min 内比AV-NB 更稳定。4℃条件下,ApoPep-1-NB 在48 h 内大小无明显变化(P>0.05),粒径均处于610 nm 以内(图2C),60 h 和72 h 时,粒径稍有增大[60 h:(627.47±20.81)nm;72 h:(680.70±20.03)nm],但与48 h 以前的粒径大小比较,差异无统计学意义(P>0.05),表明体外低温保存72 h,ApoPep-1-NB粒径稳定性良好。AV-NB 仅在12 h 内稳定性好,12 h 以后微泡融合变大,逐渐趋于不稳定。
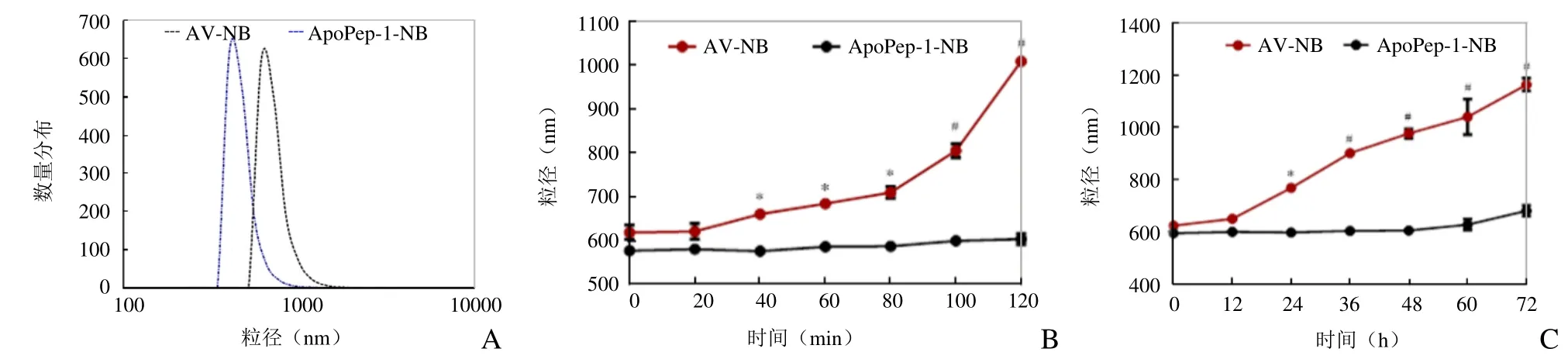
图2 ApoPep-1-NB 粒径及稳定性分析。A.ApoPep-1-NB 和AV-NB 的粒径大小;B.37℃分别存放0、20、40、60、80、100、120 min 两者粒径大小变化(*P<0.05,#P<0.01);C.4℃分别存放0、12、24、36、48、60、72 h 两者粒径大小变化(*P<0.05,#P<0.01)
2.3 ApoPep-1-NB 体外显影效果 体外模拟组织回声的琼脂糖实验装置见图3。与生理盐水比较,ApoPep-1-NB 呈现明显的高增强信号(图3B),与AV-NB 溶液比较,回声强度差异无统计学意义(P>0.05),表明ApoPep-1-NB 体外有显影效果,可用于体内成像研究。
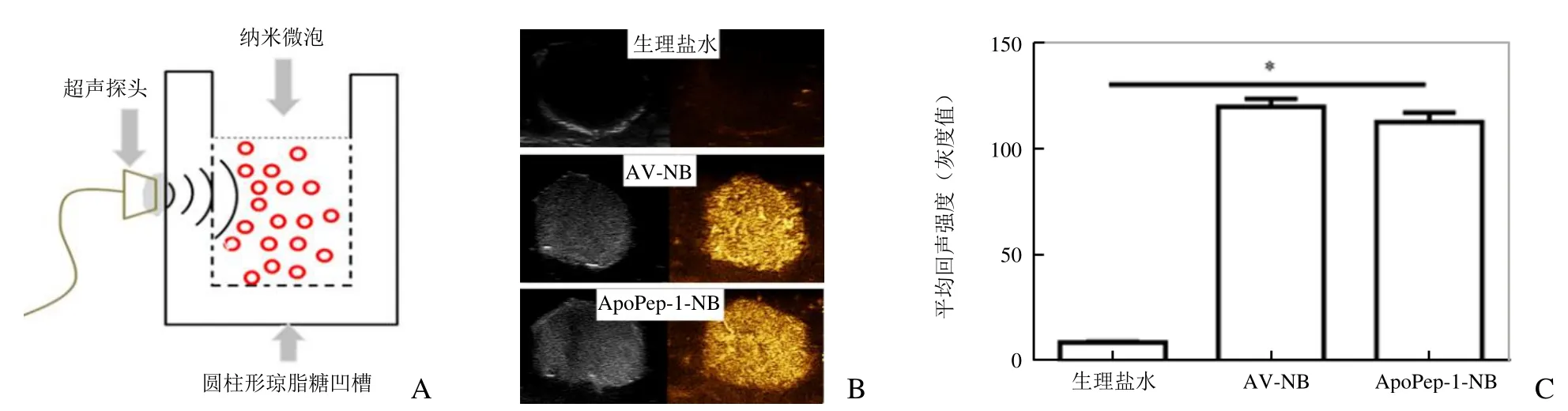
图3 ApoPep-1-NB 体外显影效果分析。A.体外模拟组织回声的实验装置;B.生理盐水、AV-NB 和ApoPep-1-NB 体外显像效果;C.生理盐水、AV-NB 和ApoPep-1-NB 平均回声强度对比(*P<0.01)
2.4 体内成像分析 常规彩色超声观察荷瘤小鼠移植瘤的成像图仅可观察到肿瘤组织边界,无法显示肿瘤组织内的凋亡区域(图4A)。ApoPep-1-NB 为实验组,AV-NB 作为对照,超声造影图像显示,纳米微泡注射10 s,肿瘤组织内两种微泡均无明显增强,凋亡区(红色实线示)仅呈现微弱显影,两者比较差异无统计学意义(P>0.05,图4)。60、120、180 s 时可见两种对比剂均呈高灌注,肿瘤区均出现明显高增强,凋亡区显影边界清晰,造影强度均显著增高,但ApoPep-1-NB 组肿瘤区(60 s:107.56±3.96;120 s:116.06±2.88;180 s:118.68±2.08)和凋亡区(60 s:156.65±1.71;120 s:161.87±3.34;180 s:158.47±2.33)造影增强强度均显著高于对照组AVNB 的肿瘤区(60 s:73.39±0.60;120 s:76.20±0.86;180 s:63.14±1.09)和凋亡区(60 s:114.85±1.74;120 s:119.58±2.67;180 s:93.91±1.16,P<0.01,图4C、D)。与AV-NB 比较,ApoPep-1-NB 在荷瘤小鼠肿瘤区内显影信号持续时间更长,300 s 时仍保持高增强,对照组显影信号逐渐降低(P<0.01,图4C、D)。
2.5 免疫荧光结果 实验组肿瘤组织分布大量的绿色Tunel 染色阳性细胞,对照组无明显绿色分布,表明治疗组肿瘤组织有大量凋亡细胞(图5A)。进一步观察发现,大量DiI 标记的ApoPep-1-NB 与FITC 标记的凋亡蛋白caspase-3 结合,对照组AV-NB 仅少量与凋亡蛋白caspase-3 结合(图5B)。
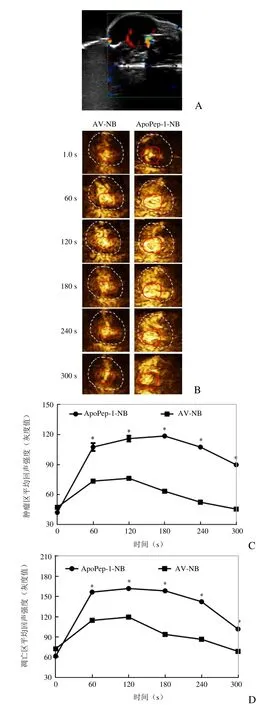
图4 体内荷瘤小鼠肿瘤组织超声成像图。A.彩色超声图像;B.超声造影观察ApoPep-1-NB 和对照AV-NB 在肿瘤部位和凋亡区的灌注情况(白色虚线代表肿瘤区,红色实线代表凋亡部分);C.肿瘤区成像时间-平均回声强度曲线;D.肿瘤组织内凋亡区成像时间-平均回声强度曲线(*P<0.01)
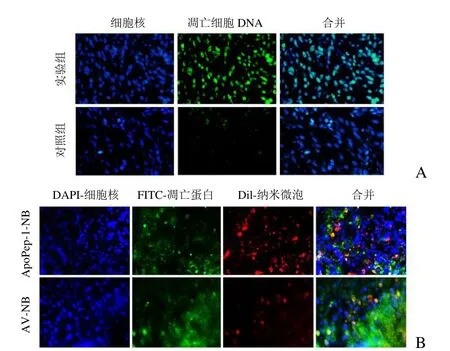
图5 激光共聚焦显微镜观察。A.Tunel 染色法分析治疗组和对照组荷瘤小鼠肿瘤组织凋亡水平;B.ApoPep-1-NB 与治疗组荷瘤小鼠肿瘤组织中凋亡细胞共定位情况,AV-NB 作为对照组
3 讨论
活体内无创监测肿瘤治疗后的凋亡应答情况对评估疗效、优化和管理治疗策略具有重要意义。本研究以小分子凋亡靶向肽ApoPep-1 为探针设计了一种新的靶向纳米微泡,与NB 连接得到靶向纳米微泡ApoPep-1-NB 的大小约为588.61 nm,37℃条件下保存2 h,其粒径大小仍在650 nm 以内;4℃存放3 d 粒径<700 nm,表明其稳定性良好。体外成像显示ApoPep-1-NB 有良好的显影效果,完全具备体内成像的条件。体内超声造影实验证实ApoPep-1-NB 在肿瘤组织内呈较长时间的高增强。除能明显增强肿瘤显像以外,还清楚地显示了肿瘤组织内高增强的凋亡区,充分验证了该靶向纳米微泡的显影能力,也为提高疗效评估提供了非常重要的信息。
前期研究中,本课题组以分子探针Annexin V 连接NB 制成超声靶向对比剂[6,11],用于荷瘤小鼠肿瘤组织内凋亡细胞成像,实现了活体内无创、可视化监测肿瘤细胞凋亡,为分子水平精准、早期评价疗效以及指导治疗方案提供了重要参考。然而,课题组研究发现,与纳米微泡连接的分子探针的大小会对粒径的稳定性产生很大影响。Annexin V 蛋白分子量约为35~36 kD,其与NB 连接制得的靶向纳米微泡存储时间较短,存储时间增加时,粒径易融合变大,导致材料利用率低,不利于长期保存。与Annexin V 相比,本研究使用的ApoPep-1 体积更小,生物素化后的ApoPep-1 分子量仅为982 D,制得的ApoPep-1-NB 粒径也更小,在提升粒径稳定性的同时,极大地提高了纳米微泡的利用率和体内存留时间,增强了靶向凋亡区的成像能力。
由于肿瘤血管壁具有较高的通透性和滞留效应(EPR)[12-13],其内皮间隙约为380~780 nm[14-15],粒径较大的微米级气泡仅能在血管内成像,无法穿透血管内皮到达血管外的肿瘤部位[16]。本研究使用的纳米微泡可顺利透过肿瘤血管内皮到达目标细胞部位实现被动靶向。此外,NB 上耦联的特异性分子探针ApoPep-1 与凋亡细胞靶向性强,可通过识别暴露在凋亡细胞表面的组蛋白H1 与凋亡细胞结合,进一步促进其从肿瘤血管内皮间隙向凋亡肿瘤细胞靶点的主动迁移,为大量聚集并较长时间滞留靶部位提供了有利条件,也更适用于体内靶向成像研究[17-18]。此外,纳米微泡粒径更小、更稳定以及肿瘤组织周围的淋巴液循环不良等特性,使其能逃避机体网状内皮吞噬系统或单核-巨噬细胞吞噬系统的吞噬,在肿瘤局部的聚集密度更高,滞留时间更长,进而提高了聚集靶点的回声强度和成像时间[19]。此外,微泡表面有PEG 修饰,对逃避免疫系统的吞噬和破坏、延长滞留时间也有重要贡献[20]。
总之,本研究发现ApoPep-1-NB 靶向成像在荷瘤小鼠肿瘤组织凋亡成像方面更具优势,有望为动态、实时、精准监测凋亡反应,评价早期抗肿瘤疗效以及优化肿瘤治疗方案提供更多的实验依据。然而,由于本研究使用的肿瘤模型为皮下异位接种,与原位种植瘤可能还存在很大差异,后期还需要进一步实验验证。

