miR-134对蛛网膜下腔出血后软脑膜纤维化的作用
杨培培,李铁柱,周金鑫,王忠海
(沈阳积水潭医院神经外科,沈阳 110027)
蛛网膜下腔出血(subarachnoid hemorrhage,SAH)是多种病因导致颅内血管破裂,血液流入蛛网膜下腔而形成的脑血管疾病,其发病率和死亡率均较高[1]。SAH后常出现早期脑损伤(early brain injury,EBI),若得不到有效控制,2~3周后会发展成慢性脑积水。脑积水是SAH患者不良预后的独立危险因素,主要是由于出血造成应激、炎症反应刺激软脑膜发生纤维化病变,局部组织发生纤维化黏连,使脑脊液吸收减少,循环受阻所致[2]。因此,减轻SAH后软脑膜纤维化,在降低SAH后发生慢性脑积水中具有重要意义。
微小RNA(microRNA,miRNA)是由19~24个核苷酸组成,能结合到目标mRNA上,进而抑制mRNA的翻译及功能,促进相应mRNA降解。miRNA还可靶向结合到基因启动子特定区域并诱导基因表达[3]。miR-134是一种大脑特异性miRNA,与树突和突触棘的发育有关。据报道[4],miR-134在缺血性损伤的脑组织中异常表达,提示miR-134在调节脑缺血损伤中的潜在关键作用。也有研究[5]表明miR-134能够靶向结合到STAT5B的3’UTR区域,在肝纤维化中发挥重要作用。但是目前没有关于miR-134在SAH后软脑膜纤维化过程中作用的研究。有研究[6]发现,SAH后脑脊液中转化生长因子β1(transforming growth factor-β1,TGF-β1)表达水平显著升高,提示TGF-β1与慢性脑积水的发生发展有着密切的关系。TGF-β1是TGF-β家族成员,作为一种有效的促纤维化因子,能够通过与细胞表面的TGF-β Ⅰ型和Ⅱ型受体结合,激活Smad2/3的磷酸化,从而促进纤维化的发生[7]。但是目前尚未见miR-134和TGF-β1在SAH后软脑膜纤维化过程中的作用研究。本研究旨在探究miR-134在SAH后软脑膜纤维化中的作用及其机制,为预防、治疗SAH后脑积水的发生提供实验支持。
1 材料与方法
1.1 实验动物
所有实验方案均获得北部战区总医院伦理委员会的批准,所有动物程序均按照国家卫生研究院《实验动物护理和使用指南》(2011年)第8版进行。雄性SD大鼠40只(6周龄,体质量160~180 g)购自北部战区总医院动物部。按照随机对照表法将大鼠随机分为2组:假手术组(SHAM组)和模型组(SAH组),每组各20只。大鼠置于23~25 ℃、70%湿度和12 h光/暗循环的安静室内饲养。
1.2 主要试剂
SuperScriptⅢ试剂盒购自美国Invitrogen公司;iTaqTM Universal SYBR Green Supermix购自BIO-RAD;血管内皮细胞系RAOEC细胞购自于美国ATCC;Dual-Luciferas双荧光素酶报告基因检测试剂盒购自Promega公司;DMEM培养基、胎牛血清(FBS)购自美国Gibco公司;青链霉素双抗、二甲基亚砜(DMSO)、胰蛋白酶购自美国Sigma公司;细胞全蛋白提取试剂盒购自江苏凯基生物技术股份有限公司;抗体TGF-β1、Collagen Ⅰ和GAPDH购自美国Cell Signaling Technology公司;辣根过氧化物酶标记的山羊抗鼠IgG、辣根过氧化物酶标记的山羊抗兔IgG购自北京中杉金桥生物技术有限公司;Lipofectamine 2000、无意义小链、miR-134+反义链miR-134、miR-134、BCA蛋白定量试剂、ECL发光剂购自上海碧云天生物科技有限公司;空载体慢病毒、Lv-miR-134、Lv-TGF-β1和Lv-miR-134+siRNA-TGF-β1购自于上海吉凯基因技术公司。
1.3 大鼠SAH模型建立
大鼠麻醉后动脉插管,仰卧位置于加热垫上,以保持体温在(36.5±0.5)℃。在枕骨大孔的中心作一1.0~1.5 cm长的纵向正中枕下切口,切开颈部肌肉直到看到硬脑膜。自股动脉抽取自体未抗凝动脉血0.5 mL,用25号蝶形针将其注入大池。然后,将大鼠以45°角放置在倾斜板上,头部朝下,保持中立位置30 min(此定义为第0天)。24 h后用相同程序再次注射血液。SHAM组大鼠接受类似处理,但注射PBS。造模7 d后处死大鼠,获取脑组织。
1.4 基因芯片检测
随机选取SHAM组和SAH组大鼠脑组织标本(1 cm×1 cm×1 cm)各3例,剪碎置于1 mL Trizol裂解液中,提取总RNA,并送至上海丰核信息科技有限公司进行基因芯片检测。
1.5 实时荧光定量PCR(RT-qPCR)
组织或细胞中加入适量的Trizol裂解液,提取总RNA。采用SuperScriptⅢ试剂盒说明书合成第一条链cDNA,以合成的cDNA为模板,进行RT-qPCR。反应体系进行40个循环,参数为95 ℃ 10 min,95 ℃ 15 s,60 ℃ 1 min,60 ℃ 15 s循环40次,60 ℃延伸1 min。引物序列见表1。
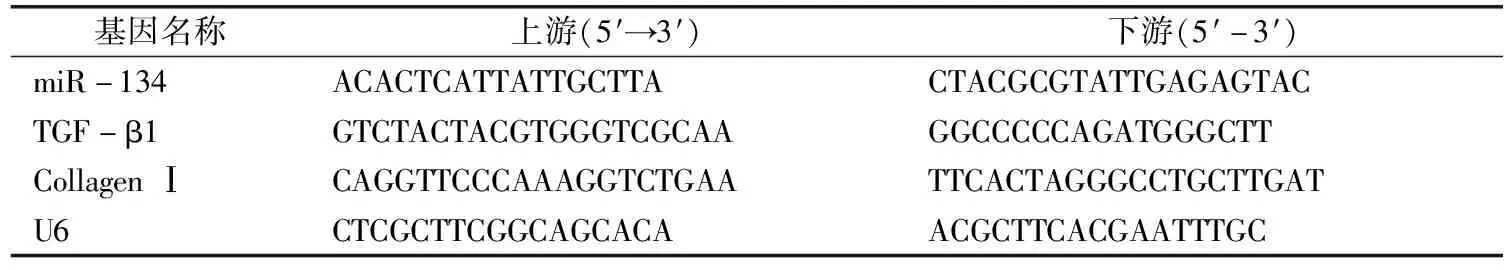
表1 目的基因引物序列
1.6 细胞培养
血管内皮细胞系RAOEC加入含有10% FBS DMEM培养基中,在37 ℃,5% CO2的饱和湿度环境中进行培养。参照Lipofectamine 2000说明书进行转染,当细胞密度30%时,转染无意义小链(Con组)、miR-134+反义链miR-134(miR-134+AS组)、miR-134(miR-134组)。
1.7 双荧光素酶报告基因实验
用TGF-β1上、下游特异性引物扩增TGF-β1的3′UTR序列。将pMIR-REPORT-Luciferase载体进行Spe Ⅰ和Hind Ⅲ双酶切。利用连接酶将TGF-β1的3′UTR序列与pMIR-REPORT-Luciferase载体连接,命名为pMIR-LUC-TGF-β1。当RAOEC细胞处于对数生长期时,接种于96孔板,达到70%融合度时进行转染。将已合成的pMIR-LUC-TGF-β1和pRL-TK分别转染到转染了无意义小链(Con组)、miR-134+反义链miR-134(miR-134+AS组)、miR-134(miR-134组)的RAOEC细胞中。24 h后,PBS洗涤2次,裂解缓冲液裂解细胞,加入LAR Ⅱ,检测萤火虫荧光素酶活性,随后立即加入海肾荧光素酶底物Stop & Glo Reagent,立即用酶标仪测定海肾荧光。
1.8 Western blot
造模后第7 d分离脑组织,置于含有150 mmol·L-1NaCl、50 mmol·L-1Tris-HCl、10 mmol·L-1乙二胺四乙酸、0.1%吐温-20、1%Triton X-100、0.1%β-巯基乙醇、0.1 mmol·L-1苯甲基磺酰氟化物、5 mg·mL-1亮蛋白和5 mg·mL-1抑肽酶的缓冲液中,在4 ℃下以10 000×g离心10 min,并收集上清液,得到蛋白样品。miR-134过表达和低表达的血管内皮细胞系培养到对数生长期按照细胞全蛋白提取试剂盒说明书进行全蛋白提取。测定蛋白质浓度后,用15% SDS-PAGE分离30 μg全蛋白,电转至硝酸纤维素膜,用TBST配置5%的脱脂奶粉封闭1 h。加入1:1000稀释的抗体TGF-β1、Collagen Ⅰ和GAPDH,4 ℃孵育过夜,TBST室温洗3次。加入二抗室温孵育1 h。在暗室里,按照1:1的比例混合发光底物A、B液。取出膜放入Bio-Rad显像仪。保存图片并使用Quantity One分析软件对图像灰度进行分析。
1.9 软脑膜Masson染色
将12只SAH大鼠随机分为4组,即空白慢病毒组、Lv-miR-134组、Lv-TGF-β1组和Lv-miR-134+siRNA-TGF-β1组,每组3只。向大鼠颅骨后注射空白慢病毒、Lv-miR-134、Lv-TGF-β1和Lv-miR-134+siRNA-TGF-β1各5 μL,缓慢注射6 min,并留针5 min,饲养1周后,进行SAH手术。大鼠4%多聚甲醛灌注后取脑OTC包埋,取带脑膜脑组织,bonius氏液中固定2 h,室温晾干后,按照Masson染色说明书进行操作,取400倍下顶部及外侧边缘格3个相同部位视野,利用Image pro pluse软件测量软脑膜纤维化程度,即(100×厚度)/灰度值。
1.10 统计学方法
2 结果
2.1 差异表达miRNAs的筛选
miRNA芯片分析结果显示,SAH组样本中miR-134表达显著低于SHAM组,差异有统计学意义(P<0.01)。见图1。
2.2 miR-134 mRNA在脑组织中的表达比较
RT-qPCR结果显示,SAH组中miR-134 mRNA表达量低于SHAM组(P<0.05)。见图2。
2.3 miR-134靶基因的预测结果
miRDB软件分析结果显示,miR-134能够结合到TGF-β1的3′UTR区域。见图3。
荧光素酶报告基因结果发现,与Con组比较,miR-134组抑制TGF-β1的活性,而miR-134+AS组对TGF-β1活性的抑制作用消失,提示miR-134结合TGF-β1启动子的特定区域调节TGF-β1活性。见图4。
2.4 TGF-β1和Collagen Ⅰ在脑组织中的表达
RT-qPCR结果显示,与SHAM组比较,SAH组的TGF-β1和Collagen Ⅰ的mRNA表达增强(P<0.05),见图5;Western blot结果显示,SAH组的TGF-β1和Collagen Ⅰ的蛋白表达高于SHAM组(P<0.05),见图6。
2.5 血管内皮细胞中miR-134对TGF-β1和Collagen Ⅰ表达的影响
RT-qPCR和Western blot结果显示,与Con组比较,miR-134组抑制了TGF-β1的表达,而miR-134+AS组增加了Collagen Ⅰ的mRNA和蛋白的表达。见图7—8。
2.5 miR-134/TGF-β1对SAH后软脑膜纤维化的作用
空白慢病毒组、Lv-miR-134组、Lv-TGF-β1组和Lv-miR-134+siRNA-TGF-β1组的纤维化灰度值分别为64.131±0.837、42.266±1.236、82.588±1.938、21.337±1.670。与空白慢病毒组相比,Lv-miR-134组和Lv-miR-134+siRNA-TGF-β1组纤维化程度降低(P<0.05),而Lv-TGF-β1组纤维化程度升高(P<0.05)
3 讨论
临床观察发现SAH后约7%~48%发生慢性脑积水,可导致颅内压显著升高,对脑实质造成严重损伤,包括引起软脑膜结构发生纤维化病变[8]。研究表明,众多miRNA在肾纤维化、肝纤维化、心房纤维化进程中发挥重要作用[9-11]。同时,在SAH后脑积水研究中发现miRNA表达失调与脑膜纤维化程度密切相关。因此,差异表达的miRNA可能成为治疗和预防SAH后脑积水的靶点[12-13]。成利等[14]研究发现miR-29c可通过TGF-β1/Smad3信号转导通路参与软脑膜纤维化程度。因此,本研究首先通过基因芯片技术在大鼠SHAM和SAH样本组织中筛选出差异表达的miRNA,发现miR-134呈显著差异表达,同时RT-qPCR证实了这一结果。miR-134位于D1K1/Dio3印记基因区域的miRNA簇中,参与中枢神经系统的发育过程,可以调节由氧葡萄糖剥夺/复氧引起的神经元死亡[12],提示miR-134在调节脑缺血损伤中的潜在作用,但是miR-134在SAH后软脑膜纤维化过程中的作用机制还需进一步的研究。
通过生物信息学软件分析,本研究发现miR-134能够靶向结合TGF-β1;同时,双荧光素酶报告基因结果显示,miR-134可以通过直接与TGF-β1结合而调节TGF-β1的活性。TGF-β1在多个组织器官的纤维化中发挥作用,包括SAH后的软脑膜纤维化。有研究[15]显示,尽管健康人的脑脊液中只发现微量的TGF-β1,但SAH患者中TGF-β1水平显著上调。另有研究[16]认为,在SAH大鼠的脑脊液中TGF-β1的浓度显著升高,可作为SAH后软脑膜纤维化的指标。本研究还发现SAH组织中TGF-β1和Collagen Ⅰ的蛋白和mRNA表达量均高于SHAM组;此外,在血管内皮细胞系中,本研究发现miR-134能够抑制TGF-β1和CollagenI的表达;而且,Masson染色证实,miR-134/TGF-β1能影响SAH后软脑膜纤维化的程度,提示miR-134负向调节TGF-β1,抑制Collagen Ⅰ的表达,从而抑制软脑膜的纤维化程度。
综上,本研究从动物和细胞水平证实miR-134负向调控TGF-β1,抑制纤维化Collagen Ⅰ的表达,进而抑制SAH后软脑膜的纤维化进展,表明miR-134可能是预防、治疗SAH后慢性脑积水潜在治疗靶点。

